修回日期: 2011-10-02
接受日期: 2011-10-06
在线出版日期: 2011-10-08
目的: 探讨Rb基因与转录因子E2F1在新疆哈萨克族食管鳞癌中的表达及临床意义.
方法: 应用RT-PCR法对48例新疆哈萨克族食管鳞癌组织及其配对的癌旁正常组织进行Rb和E2F1表达检测, 分析Rb/E2F1通路与新疆哈萨克族食管鳞癌发生发展之间的关系.
结果: 新疆哈萨克族食管鳞癌组织中Rb的阳性表达高于癌旁正常组织(64.6%, 43.8%)差异有统计学意义(P<0.05); 转录因子E2F1的阳性表达率与癌旁正常组织阳性表达率(70.8%, 75%)差异无统计学意义(P>0.05). Rb、E2F1的表达与组织学分级及临床分期无关(P>0.05). Rb阳性表达强度与E2F1的阳性表达强度之间呈正相关(r = 0.867, P<0.05).
结论: Rb的高表达伴随新疆哈萨克族食管鳞癌的发生, E2F1可能作用于食管癌发生的早期阶段, 二者在新疆哈萨克族食管鳞癌的发生发展中起拮抗作用.
引文著录: 马莉莉, 李卉, 王洪江, 陈艳, 郭琼, 尹娜, 李惠武. Rb/E2F1调控途径在新疆哈萨克族食管鳞癌发生中的作用. 世界华人消化杂志 2011; 19(28): 2937-2941
Revised: October 2, 2011
Accepted: October 6, 2011
Published online: October 8, 2011
AIM: To investigate the expression of Rb and E2F1 in esophageal squamous cell carcinoma (ESCC) and to analyze their clinicopathological significance.
METHODS: Forty-eight ESCC specimens were taken from Xinjiang Kazaks patients and used in the study. Matched normal esophageal mucosal tissues were used as controls. The expression of Rb and E2F1 was detected by RT-PCR. The correlation of Rb and E2F1 expression with the development and progression of ESCC was then analyzed.
RESULTS: The positive rate of Rb expression was higher in ESCC than in normal esophageal mucosal tissue (64.6% vs 43.8%, P < 0.05). E2F1 expression in ESCC showed no significant difference with that in normal esophageal mucosal tissue (70.8% vs 75%, P > 0.05). Rb and E2F1 expression showed no significant correlation with tumor differentiation and stage (both P > 0.05). Rb expression was positively correlated with that of E2F1 in ESCC (r = 0.867, P < 0.05).
CONCLUSION: High expression of Rb may be involved in the development and progression of ESCC.
- Citation: Ma LL, Li H, Wang HJ, Chen Y, Guo Q, Yin N, Li HW. Clinicopathological significance of Rb and E2F1 expression in esophageal squamous cell carcinoma. Shijie Huaren Xiaohua Zazhi 2011; 19(28): 2937-2941
- URL: https://www.wjgnet.com/1009-3079/full/v19/i28/2937.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i28.2937
食管癌是世界常见十大恶性肿瘤之一, 其发病率随着年龄的增高而升高, 5年生存率在10%. 全世界食管癌一半以上发生在中国, 主要为鳞癌. 食管癌发病机制尚不明确, 除环境因素[1]和饮食因素[2]外, 高发区相同环境背景下, 不同家族患食管癌的人数有很大差异, 表明遗传因素在食管癌发病中的作用不可忽视[3]. 新疆是我国食管癌高发区之一, 尤以哈萨克族发病率最高. 其调整死亡率是68.88/10万, 高出其他民族调整死亡率(5.13/10万)的10倍之多[4]. 在恶性肿瘤的发生中, 细胞周期调控紊乱起着重要的作用. E2F1是细胞周期调控机制中Rb/E2F通路最重要的转录活化因子, 主要调节细胞周期由G1期向S期过渡, 是细胞增殖和发育必需环节. 因此, 本实验采用 RT-PCR方法检测Rb和E2F1在新疆哈萨克族食管鳞癌组织及相应癌旁正常组织中的表达, 并分析其与临床病理特征的关系, 为研究Rb/E2F1途径的细胞周期调控在新疆哈萨克族食管鳞癌发生、发展中的作用提供依据.
收集新疆医科大学附属肿瘤医院经手术证实的新疆哈萨克族食管鳞癌及配对癌旁正常食组织48例. 标本组织学分级: 组织分化高中分化39例, 低分化9例; TNM分期T1+T2共11例, T3+T4共37例; 临床分期Ⅰ-Ⅱ期19例, Ⅲ-Ⅳ期29例; 有淋巴结转移31例, 无淋巴结转移17例. RT-PCR扩增基因及内参照GAPDH均由上海生物工程有限公司合成, RNA提取试剂TRIzol购自Invitrogen公司, 逆转录试剂盒购自Promega公司, PCR即用试剂盒购自上海生物工程有限公司.
1.2.1 RT-PCR法: 严格按照RNA提取方法及逆转录试剂盒进行组织RNA提取和逆转录CDNA合成. 将食管鳞癌组织与癌旁正常食管黏膜组织在无菌的研钵中液氮研磨, 每100 mg组织加入1 mL TRIzol, 混匀, 其他步骤参照说明书操作. 提取的总RNA用Smart spec3000型紫外分光光度计测定浓度和纯度, 在紫外透射仪上显示有28S、18S(部分可见到5S)两条rRNA. 说明提取的RNA完整. 取1 μg总RNA量用于反转录合成cDNA. cDNA合成细胞总RNA 2 μL, 50 IU/μL RNA酶抑制剂(RNasin) 0.5 μL, 5×逆转录反应缓冲液3 μL, 10 mmol/L, 脱氧核糖核苷酸(dNTP)1.5 μL, 50 mg/L随机引物1 μL. 逆转录酶15 U, 25 mmol/L. 硫酸镁(MgCl2)0.5 μL, 42 ℃反应90 min, 95 ℃ 5 min终止反应. 以上述逆转录cDNA为模板, 加入引物, 扩增基因片断, 反应总体系20 μL. 基因扩增引物序列及参数如下(表1, 2).
| 基因名 | 引物序列 | 扩增产物(bp) |
| Rb | 上游引物: 5'-AACCCTCCTAAACCACTG-3' | 490 |
| 下游引物: 5'-GGGCCATTCTTACTATCC-3' | ||
| E2F1 | 上游引物: 5'-CCCAACTCCCTCTACCCTT-3' | 217 |
| 下游引物: 5'-CTCCCATCTCATATCCATCCTG-3' | ||
| GAPDH | 上游引物: 5'-CGCGGGCTCTCCAGAACATCAT-3' | 298 |
| 下游引物: 5'-CCAGCCCCAGCGTCAAAGGTG-3' |
| 基因名 | 反应条件 |
| Rb | 95 ℃ 5 min; 95 ℃ 30 s, 56 ℃ 30 s, 72 ℃ 30 s, 35个循环; 72 ℃ 7 min |
| E2F1 | 95 ℃ 5 min; 95 ℃ 30 s, 52 ℃ 30 s, 72 ℃ 30 s, 35个循环; 72 ℃ 7 min |
| GAPDH | 95 ℃ 5 min; 95 ℃ 30 s, 59 ℃ 30 s, 72 ℃ 30 s, 35个循环; 72 ℃ 7 min |
1.2.2 结果判断标准: PCR反应结束后, 扩增产物经2%琼脂糖电泳(80 V, 50 min)后, 紫外成像并在凝胶仪进行扫描定量, 以相关基因与内对照GAPDH的比值代表mRNA表达水平.
统计学处理 应用SPSS17.0统计软件包处理, 采用χ2检验和Pearson相关性分析, 检验水准α = 0.05, P<0.05为差异有统计学意义.
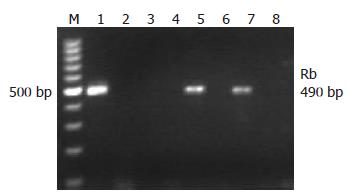
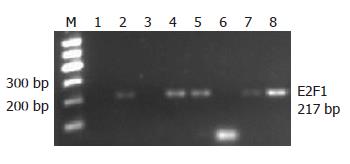
将实验结果进行统计分下发现(表3), Rb、E2F1在食管鳞癌组织中表达的阳性率为64.6%和70.8%, 在正常食管黏膜组织中表达的阳性率为43.8%、75%. Rb在食管鳞癌组织中的阳性率高于正常黏膜组织, 其差异有统计学意义(P = 0.028, P<0.05), E2F1在食管鳞癌和正常黏膜组织中的表达无统计学意义(P = 0.819, P>0.05, 表3). Rb与E2F1 mRNA电泳图(图1, 2).
| 组织 | Rb | E2F1 | ||||
| + | - | P值 | + | - | P值 | |
| 食管鳞癌组织 | 31 | 17 | 34 | 14 | ||
| 正常食管黏膜 | 21 | 29 | <0.05 | 36 | 12 | >0.05 |
经统计学分析, Rb、E2F1的表达在新疆哈萨克族食管鳞癌组织不同分化程度、TMN分期、临床分期、有无淋巴结转移之间差异均无显著性(P>0.05, 表4).
| 项目 | n | Rb(%) | χ2值 | P值 | E2F1(%) | χ2值 | P值 |
| 浸润程度 | |||||||
| T1+T2 | 11 | 7(63.6) | 0.000 | 1.000 | 6(54.5) | 1.832 | 0.176 |
| T3+T4 | 37 | 24(64.9) | 28(75.7) | ||||
| 临床分期 | |||||||
| Ⅰ-Ⅱ期 | 19 | 10(52.6) | 1.964 | 1.161 | 12(63.2) | 0.897 | 0.344 |
| Ⅲ-Ⅳ期 | 29 | 21(72.4) | 22(75.9) | ||||
| 分化程度 | |||||||
| 高中分化 | 39 | 25(64.1) | 0.000 | 1.000 | 30(76.9) | 2.327 | 0.127 |
| 低分化 | 9 | 6(66.7) | 4(44.4) | ||||
| 淋巴结转移 | |||||||
| N0 | 17 | 10(58.8) | 0.382 | 0.537 | 12(70.6) | 0.000 | 0.984 |
| N1 | 31 | 21(67.7) | 22(71.0) |
食管鳞癌中Rb阳性31例, 阴性17例, E2F1阳性34例, 阴性14例. 经Spearman等级相关检验显示, Rb与E2F1在新疆哈萨克族食管鳞癌呈正相关(r = 0.867, P = 0.000, P<0.05).
各种研究表明, 肿瘤的共同特征是细胞失控性生长, 多步骤多基因的发生, 导致细胞周期机制的紊乱[5]. 人们越来越清楚地认识到, 肿瘤是一类细胞周期疾病. Rb基因位于人13号染色体q14, 其产物在细胞周期的控制中起关键作用, 他对肿瘤的抑制作用与转录因子E2F1有关. E2F1是E2Fs转录因子家族的成员之一, 具有激活转录和促进细胞凋亡的作用[6]. Rb/E2F1通路是细胞周期中的重要环节, 主要调节细胞越过细胞周期限制点, 由G1期向S期过渡, 是细胞增殖和发育的必需环节.
Robbins等[6]的实验研究表明, c-fos基因的表达能使静止期细胞进入细胞周期, 野生型Rb基因的蛋白产物能够抑制这种位于细胞核内的c-fos癌基因的表达. Cobrinik等[7]研究发现, 在G0期, cdc2含量很低, 而在G1到S期转变过程中, cdc2的表达量明显升高. 低磷酸化时Rb的作用是抑制原癌基因c-myc和c-fos等的转录, 阻遏细胞的生长; 高磷酸化时Rb的作用是促进细胞周期. 磷酸化为Rb基因调节细胞生长分化的主要形式. 本实验中, Rb基因的阳性表达率随组织分化程度增高变化不大(66.7%, 64.1%), T1+T2期与T3+T4相当(63.6%, 64.9%). 其表达阳性率在临床分期中变化较明显, Ⅲ-Ⅳ期中表达高于Ⅰ-Ⅱ期(72.4%, 52.6%), 在有淋巴结转移组织中表达阳性率高于无淋巴结转移组织(67.7%, 58.8%), 其之间差异均无显著性(P>0.05). Rb基因在食管鳞癌组织中的阳性率高于正常食管黏膜组织(64.6%, 43.8%), 且其表达有显著性差异(P<0.05). 之前, 在对同一批标本c-myc、Survivin等基因的表达检测发现, c-myc、Survivin在新疆哈萨克族食管鳞癌癌组织中高表达且有统计学意义[8,9]. 这些结果提示在新疆哈萨克族食管鳞癌发生过程中, Rb的高表达也许与上述原癌基因过表达导致肿瘤发生的过程有关, 由于c-fos、cdc2和c-myc的高表达可以引发Rb基因的高表达, 但其确切的机制尚待进一步实验研究证实.
越来越多的观点[10]认为E2F1在细胞中扮演着"阴"和"阳"的双重作用. 有研究表明, 敲除E2F1基因的小鼠生殖系统、淋巴管、肺脏等多个器官可发生肿瘤[11]; 另有报道, 在培养的组织细胞和转基因小鼠中过表达E2F1可诱导凋亡[12]. 也有研究显示, E2F1 的异常表达能够促使细胞过度增殖和恶向转化[13].
在食管癌的发生中, 部分伴有HPV感染. Shen等[14]用HPV18 E6/E7体外感染人胚食管上皮, 发现可使细胞永生化, 并在促癌化合物TPA的协同作用下细胞发生了恶性转变. 这一研究结果为HPV与食管癌的病因和发病学的关系提供了直接证据. Whyte等[15]认为Rb基因蛋白产物可能是一个细胞对环境抑制信息作出反应的环节, Rb基因蛋白产物丧失, 使细胞对外界的抑制信息失去反应能力, 造成细胞无限制的生长和增殖, 引起肿瘤形成. 在G1期活性形式的Rb未磷酸化蛋白由于一些病毒癌基因产物的结合而转为失去活性的复合物形式, 导致细胞进入S期.
E7蛋白是HPV的主要转化蛋白, 具有Rb蛋白的结合位点. 正常情况下, 非磷酸化pRb与E2F1特异结合形成pRb-E2F1复合物, 抑制E2F1对靶基因的转录, 抑制细胞增殖. 这种高亲和性使pRb-E2F1复合物解离, E2F1被游离, 从而发挥其转录因子的作用, 转录由G1期进入S期所需的基因, 导致细胞的生长调控特性丧失. 除了结合Rb, E7蛋白还与某些蛋白如p107、p130和一些激酶p33 CDK2 等结合, 激活E2F1. 本实验中, E2F1在食管鳞癌高中分化组织中高表达(76.9%), 在中低分化组织中低表达(44.4%). 在T3+T4期组织中高于T1+T2期组织(75.7,%, 54.5%), 临床分期Ⅲ-Ⅳ期中表达高于Ⅰ-Ⅱ期(75.9%, 63.2%), 在有淋巴结转移组织和无淋巴结转移组织中阳性表达率相当(71%, 70.6%), 但其之间差异均无显著性(P>0.05), 表明由于HPVE7蛋白产物与Rb未磷酸化产物结合而使E2F1游离, 细胞进入增殖状态, 引起肿瘤发生, Rb基因作为抑癌基因抑制肿瘤的发生, 造成过表达. 而E2F1的高表达很可能是食管鳞癌发生的早期事件, 也许与HPV的感染存在关系, 需要进一步实验确定.
总之, Rb在新疆哈萨克族食管鳞癌组织中高表达, 且与E2F1的表达呈正相关, Rb和E2F1主导的Rb/E2F1调控途径与原癌基因诱发的新疆哈萨克族食管鳞癌的发生发展过程起拮抗作用, 其表达也许与食管癌中c-fos、cdc2、c-myc和Survivin基因的表达及HPV感染有关, 这为进一步研究新疆哈萨克族食管癌发生机制提供了实验依据.
食管癌是世界常见十大恶性肿瘤之一, 其发病率随着年龄的增高而升高, 5年生存率在10%. 全世界食管癌一半以上发生在中国, 主要为鳞癌. 食管癌发病机制尚不明确, 除环境因素和饮食因素外, 高发区相同环境背景下, 不同家族患食管癌的人数有很大差异, 表明遗传因素在食管癌发病中的作用不可忽视. 新疆是我国食管癌高发区之一, 尤以哈萨克族发病率最高.
李晟磊, 副主任医师, 郑州大学第一附属医院病理科、河南省肿瘤病理重点实验室、郑州大学医学院病理教研室
Robbins等的实验研究表明, c-fos基因的表达能使静止期细胞进入细胞周期, 野生型Rb基因的蛋白产物能够抑制这种位于细胞核内的c-fos癌基因的表达.
本实验采用 RT-PCR方法检测Rb和E2F1在新疆哈萨克族食管鳞癌组织及相应癌旁正常组织中的表达, 并分析其与临床病理特征的关系, 为研究Rb/E2F1途径的细胞周期调控在新疆哈萨克族食管鳞癌发生、发展中的作用提供依据.
本文选题较好, 有一定的学术价值.
编辑: 李军亮 电编:何基才
| 1. | 王 瑞林. 食管癌研究进展. 郑州: 河南医科大学出版社 1996; 11. |
| 2. | van Rensburg SJ. Epidemiologic and dietary evidence for a specific nutritional predisposition to esophageal cancer. J Natl Cancer Inst. 1981;67:243-251. [PubMed] |
| 5. | Lewin B. Genes. VII. Oxford: Oxford University Press 2000; 999-1005. |
| 6. | Robbins PD, Horowitz JM, Mulligan RC. Negative regulation of human c-fos expression by the retinoblastoma gene product. Nature. 1990;346:668-671. [PubMed] [DOI] |
| 7. | DeCaprio JA, Furukawa Y, Ajchenbaum F, Griffin JD, Livingston DM. The retinoblastoma-susceptibility gene product becomes phosphorylated in multiple stages during cell cycle entry and progression. Proc Natl Acad Sci U S A. 1992;89:1795-1798. [PubMed] [DOI] |
| 9. | 彭 辉, 陈 艳, 刘 涛, 李 卉, 张 雪, 庞 作良, 王 洪江, 周 新, 赵 学信, 李 惠武. Survivin基因在哈萨克族食管癌中表达的研究. 地方病通报. 2008;23:4-6. |
| 10. | Wenzlau JM, Liu Y, Yu L, Moua O, Fowler KT, Rangasamy S, Walters J, Eisenbarth GS, Davidson HW, Hutton JC. A common nonsynonymous single nucleotide polymorphism in the SLC30A8 gene determines ZnT8 autoantibody specificity in type 1 diabetes. Diabetes. 2008;57:2693-2697. [PubMed] [DOI] |
| 11. | Yamasaki L, Jacks T, Bronson R, Goillot E, Harlow E, Dyson NJ. Tumor induction and tissue atrophy in mice lacking E2F-1. Cell. 1996;85:537-548. [PubMed] [DOI] |
| 12. | Holmberg C, Helin K, Sehested M, Karlström O. E2F-1-induced p53-independent apoptosis in transgenic mice. Oncogene. 1998;17:143-155. [PubMed] [DOI] |
| 13. | Dimova DK, Dyson NJ. The E2F transcriptional network: old acquaintances with new faces. Oncogene. 2005;24:2810-2826. [PubMed] [DOI] |
| 14. | Rasschaert J, Malaisse WJ. Glycogen accumulation in cultured tumoral or normal pancreatic islet and acinar cells. Int J Mol Med. 2001;8:63-65. [PubMed] |