修回日期: 2011-08-27
接受日期: 2011-10-06
在线出版日期: 2011-10-08
目的: 探讨在食管鳞癌EC-9706细胞中沉默CXCR4基因对MMP-9基因表达的影响, 为阐明CXCR4基因在食管鳞癌侵袭转移中的作用提供实验依据.
方法: 化学合成2条靶向CXCR4基因的siRNA1和siRNA2, 同时设立荧光标记阴性对照和空白对照. 脂质体法转染入EC-9706细胞, 荧光显微镜下观察转染效率. 转染48 h后, 半定量RT-PCR检测各组细胞CXCR4和MMP-9基因mRNA表达的变化, Western blot检测各组细胞CXCR4和MMP-9基因蛋白表达的变化, 侵袭小室检测各组细胞穿膜细胞数的变化, MTT检测各组细胞的A值.
结果: 与阴性对照和空白对照相比, 转染CXCR4 siRNA1和siRNA2组细胞CXCR4 mRNA和蛋白的表达明显降低, 差异具有统计学意义(P<0.05); 同时与阴性对照和空白对照相比, 转染CXCR4 siRNA1和siRNA2组细胞MMP-9 mRNA和蛋白的表达同样明显降低, 差异具有统计学意义(P<0.05); 转染CXCR4 siRNA1和siRNA2组细胞穿膜细胞数与阴性对照和空白对照相比明显下降, 差异具有统计学意义(P<0.05); MTT结果显示转染CXCR4 siRNA1和siRNA2组细胞增殖能力下降, 与阴性对照和空白对照相比差异具有统计学意义(P<0.05).
结论: 在食管鳞癌EC9706中存在CXCR4基因对MMP-9基因的调控作用, CXCR4基因有可能通过调控MMP-9基因的表达参与食管鳞癌细胞的浸润转移, CXCR4有可能成为食管鳞癌基因治疗的有效靶点.
引文著录: 刘剑, 王峰, 朱利楠, 何炜, 王留兴, 樊青霞. 沉默CXCR4基因对食管鳞癌EC-9706细胞中MMP-9基因表达的影响. 世界华人消化杂志 2011; 19(28): 2913-2918
Revised: August 27, 2011
Accepted: October 6, 2011
Published online: October 8, 2011
AIM: To investigate the effect of small interfering RNA (siRNA)-mediated blockade of CXCR4 signaling on the expression of MMP-9 in human esophageal carcinoma cell line EC9706 and to provide an experimental foundation for further elucidating the role of CXCR4 in metastasis and invasion of esophageal carcinoma (ESCC).
METHODS: Two siRNAs targeting the CXCR4 gene and one fluorescence-labeled negative control siRNA were chemically synthesized and transfected into EC9706 cells, Non-transfected EC9706 cells were used as blank controls. The transfection efficiency was evaluated by fluorescence microscopy. Both CXCR4 and MMP-9 mRNA and protein levels were detected by semiquantitative RT-PCR and Western blot 48 h after transfection. Boyden chamber assay was used to evaluate the invasion capability of cells in vitro and MTT assay was used to evaluate cell growth.
RESULTS: The two siRNAs targeting the CXCR4 gene efficiently suppressed the expression of CXCR4 in EC9706 cells at both mRNA and protein levels compared to negative and blank controls (all P < 0.05). The expression of MMP-9 mRNA and protein in EC9706 cells transfected with the two siRNAs targeting the CXCR4 gene was also suppressed significantly compared to the two control groups (all P < 0.05). Boyden chamber assay results showed that the number of cells that have passed through the membrane were decreased in EC-9706 cells transfected with two CXCR4-specific siRNAs compared to the two control groups (both P < 0.05). Transfection of CXCR4-specific siRNAs greatly decreased the growth of EC9-706 cells compared to control cells (both P < 0.05).
CONCLUSION: CXCR4 may play a role in the metastasis and invasion of ESCC possibly by controlling the expression of MMP-9. CXCR4 may be a potentially valuable therapeutic target for ESCC.
- Citation: Liu J, Wang F, Zhu LN, He W, Wang LX, Fan QX. SiRNA-mediated silencing of the CXCR4 gene down-regulates MMP-9 expression in EC-9706 cells. Shijie Huaren Xiaohua Zazhi 2011; 19(28): 2913-2918
- URL: https://www.wjgnet.com/1009-3079/full/v19/i28/2913.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i28.2913
胰食管鳞癌是我国最常见的恶性肿瘤之一, 由于其早期的浸润转移, 预后不佳. 自Muller等[1]首次报道趋化因子受体与肿瘤浸润转移的关系后, 越来越多的趋化因子受体在随后的研究中被发现与肿瘤的发生、发展关系密切. 其中CXC趋化因子受体4(CXC chemokine receptor4, CXCR4)及其配体基质细胞衍生因子-1(stromal cell derived factor 1, SDF-1)[2]组成的生物轴在至少26中不同类型的肿瘤细胞包括食管鳞癌细胞中表达, 是表达最为广泛的趋化因子受体, 干扰该生物轴的作用可以影响肿瘤细胞的浸润转移[3]. 大量研究证明基质金属蛋白酶-9(matrix metalloproteinase-9, MMP-9)在食管鳞癌中高表达, 且与食管鳞癌早期的浸润转移密切相关[4,5]. 本文通过RNAi技术干扰食管鳞癌细胞EC-9706中CXCR4基因的表达, 观察其对MMP-9基因表达的影响, 同时研究其对食管鳞癌细胞EC-9706浸润转移和增殖能力的影响, 为进一步阐明CXCR4在食管鳞癌浸润转移中的作用机制提供理论依据, 为食管鳞癌的基因治疗提供有效靶点.
食管鳞癌EC-9706细胞、NIH3T3细胞由郑州大学基础医学院保存提供; 胎牛血清购自杭州四季青公司; 1640培养液购自Gibco公司; 脂质体转染试剂LipofectamineTM2000及RNA提取试剂TRIzol均购自Invitrogen公司; CXCR4兔抗人多克隆抗体、MMP-9多克隆抗体、β-actin兔抗人多克隆抗体及辣根过氧化物酶标记羊抗兔抗体均购自北京中杉金桥生物技术公司; RT-PCR一步法试剂盒购自大连宝生物工程有限公司; 胰蛋白酶、MTT均购自美国Sigma公司; Boyden chamber购自江苏海门麒麟医用仪器厂; Matrigel胶购自北京大学医学部细胞生物学实验室; 其他常规试剂均为进口分装或国产分析纯.
1.2.1 siRNA靶序列的选择及合成: 根据GeneBank中CXCR4基因的序列设计两对靶向CXCR4的siRNA序列, 采用BLAST同源性检索确认与人类基因无明显同源性. 分别为: siRNA1序列为: 5'-GCGGCAGCAGGUAGCAAAGdTdT-3'; siRNA2序列为: 5'-CUGGGCAGUUGAUGCCGUGdTdT-3'. 均由郑州创生生物公司合成, PAGE纯化. 同时设计荧光标记的对照组siRNA(与人类基因无同源性).
1.2.2 细胞培养与转染: 食管鳞癌EC-9706细胞在含有100 mL/L胎牛血清的1640培养基中, 37 ℃、50 mL/L CO2条件下培养, 细胞培养2 d即更换1次培养液. 转染前24 h, 将EC-9706细胞用胰蛋白酶消化、传代至24孔培养板, 每孔2×105细胞, 使用不含抗生素1640培养基培养. 实验分为4组: A组为空白对照组, B组为转染阴性siRNA组, C组为转染siRNA1组, D组为转染siRNA2组; 每组设4个复孔, 实验重复3次. EC-9706细胞培养6 h后, 转为全培液培养, 继续培养48 h, 收获细胞, 进行后续试验.
1.2.3 半定量RT-PCR检测各组细胞CXCR4和MMP-9基因表达变化: 用TRIzol试剂提取细胞总RNA, 样品经琼脂糖凝胶电泳. 根据RT-PCR试剂盒说明书, 将CXCR4与β-actin、MMP-9与β-actin分别进行同管扩增. CXCR4引物为: 上游序列: TCTTCTTAACTGGCATTGTG, 下游序列: AGAGGTTGACTGTGTAGATG, 扩增片段长度为219 bp; MMP-9引物为: 上游序列: GGATGGAGGTGATATGTGAA, 下游序列: GCAGGCATAAGAGGAGTG, 扩增片段长度为: 121 bp; β-actin引物为: 上游序列: GGCAGCAGGATGAGATTC; 下游序列: GGAGTCTGTAGTCTTCACC, 扩增片段长度为: 391 bp. 引物由赛百胜生物有限公司设计合成. RT-PCR反应体系总体积为25 μL, 加入0.5 μL的总RNA, 上、下游引物各0.5 μL. 50 ℃ 30 min进行逆转录反应, 94 ℃ 2 min使RNase失活, 然后94 ℃变性30 s, 56 ℃退火30 s, 72 ℃延伸1 min, 共进行32个循环, 最后72 ℃延伸10 min. 取PCR产物5 μL行1.2%琼脂糖凝胶电泳, 使用SYNGENE凝胶分析系统软件扫描各条带灰度值, 分析CXCR4和MMP-9基因在各组细胞中的相对表达水平.
1.2.4 Western blot检测各组细胞CXCR4和MMP-9蛋白表达变化: 按照细胞蛋白提取试剂盒说明书, 提取各组细胞总蛋白. 参考《分子克隆操作指南》Western blot操作步骤, 取各组细胞总蛋白各100 μg, 分别与2×SDS缓冲液按1:1混合, 95 ℃加热10 min, 与预染的蛋白质分子量标准一起上样, 经12%SDS-PAGE分离, 电泳结束后根据蛋白Marker指示的位置切下含有目的带的胶条, 电转到硝酸纤维素膜上, 用丽春红染色, 确定蛋白是否转移成功. 同时每次实验均检测β-actin(42 kDa)的表达, 以作为上样标准. 5%的脱脂奶粉TBST溶液封闭, 4 ℃过夜, 加一抗(CXCR4抗体按1:400稀释; MMP-9抗体按1:600稀释)室温孵育2 h, TBST溶液洗涤10 min×3次, 加辣根过氧化物酶标记的羊抗兔抗体(1:5 000)室温下振摇2 h, TBST溶液洗涤10 min×3次, ECL化学发光剂于暗室中曝光和显影. 测定蛋白条带的A值, 以表示蛋白的相对表达水平.
1.2.5 Boyden小室检测体外侵袭力: 参照Albin等[6]的研究方法并予以改良, Matrigel胶用4 ℃无血清1640稀释, 均匀铺盖于8 μm的聚碳酸酯膜上, 37 ℃放置30 min使其形成凝胶状, 紫外线照射30 min杀菌. 下室加200 μL NIH3T3细胞无血清培养24 h条件培养基作趋化因子, 加盖上述制备好的人工基质胶膜, 上室内滴加浓度为5×105个/mL的单细胞悬液500 μL, 常规培养24 h, 取出小室, 吸弃上室内的细胞悬液, 以棉签小心擦净滤膜上室面的细胞和胶, 950 mL/L乙醇固定, 常规HE染色后中性树胶固封于载玻片上. 用倒置显微镜(×400)计数滤膜上5个视野的穿过孔径的细胞数, 取均数. 每株细胞设3个平行样本.
1.2.6 MTT法检测细胞增殖能力: 分别收集处于对数生长期的各组细胞, 于96孔培养板中接种200 μL细胞悬液(约5 000个细胞/孔); 37 ℃, 50 mL/L CO2培养箱及饱和湿度条件下培养48 h, 加入5 mg/L的MTT溶液20 μL, 继续培养4 h; 吸去上清后每孔加入200 μL DMSO, 在96孔酶标仪上读取A570 nm值. 每组实验至少重复3次, 每次做5个平行孔, 按照公式计算生长抑制率. 抑制率(%) = (1-实验组平均A值/对照组平均A值)×100%.
统计学处理 所有数据采用SPSS11.5软件进行统计处理, 两组均数的比较采用t检验, 检验水准取α = 0.05.
转染带绿色荧光的阴性对照siRNA后48 h, 随机在荧光显微镜下选取5个视野, 发现带绿色荧光的细胞占所有细胞的比例为77.6%±2.33%(图1), 而空白对照组观察不到明显的绿色荧光细胞, 显示转染效率较高.
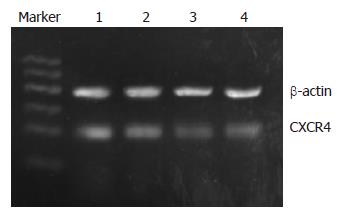
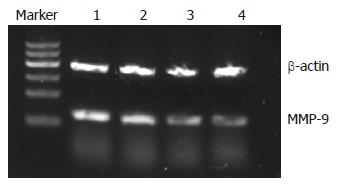
和MMP-9 mRNA表达的影响 半定量RT-PCR检测结果显示, siRNA转染EC-9706细胞48 h后, 与空白组(0.81±0.03)和转染阴性对照siRNA组(0.76±0.02)相比, 转染CXCR4 siRNA1组(0.42±0.09)和转染CXCR4 siRNA2组(0.47±0.05)细胞CXCR4 mRNA的表达明显下降(图2), 差异具有统计学意义(P<0.05). 转染CXCR4 siRNA1组和转染CXCR4 siRNA2组细胞MMP-9 mRNA的表达同样明显下降, 分别为(0.51±0.07)和(0.55±0.03)(图3), 与空白组(0.87±0.04)和转染阴性对照siRNA组(0.90±0.10)相比差异具有统计学意义(P<0.05).
siRNA对CXCR4和MMP-9蛋白表达的影响 Western blot检测结果显示, siRNA转染EC-9706细胞48 h后, 与空白组(0.66±0.01)和转染阴性对照siRNA组(0.61±0.07)相比, 转染CXCR4 siRNA1组(0.24±0.03)和转染CXCR4 siRNA2(0.30±0.04)组细胞CXCR4蛋白的表达明显下降, 差异具有统计学意义(P<0.05). 转染CXCR4 siRNA1组和转染CXCR4 siRNA2组细胞MMP-9蛋白的表达同样明显下降, 分别为(0.33±0.10)和(0.37±0.05), 与空白组(0.69±0.09)和转染阴性对照siRNA组(0.71±0.02)相比差异具有统计学意义(P<0.05, 图4).
siRNA对食管鳞癌细胞EC-9706侵袭能力的影响 侵袭小室结果显示, 转染CXCR4 siRNA1和转染CXCR4 siRNA2组的EC-9706细胞穿透Matrigal基底膜的细胞数分别为(58.30±13.44)和(62.80±11.20), 显著低于空白组(89.00±14.93)和转染阴性对照siRNA组(84.60±16.41)的穿膜细胞数, 差异具有统计学意义(P<0.05). 与空白组相比, 转染CXCR4 siRNA1和转染CXCR4 siRNA2组的EC-9706细胞侵袭抑制率分别达到34.8%和30.3%, 说明两对CXCR4 siRNA均能显著抑制体外培养的EC-9706细胞的侵袭转移能力.
siRNA对食管鳞癌细胞EC-9706增殖能力的影响 转染CXCR4 siRNA1和转染CXCR4 siRNA2组的EC-9706在转染48 h后细胞的增殖能力与空白组合转染阴性对照siRNA组相比明显降低, 分别为(转染CXCR4 siRNA1 0.480±0.013, 转染siRNA2 0.493±0.009, 空白组 0.580±0.017合转染阴性siRNA组0.573±0.008), 可见细胞生长受到明显抑制(P<0.05), 表明CXCR4 siRNA可能同时具有抑制细胞增殖的能力, CXCR4基因在食管鳞癌细胞生长过程中同样起到重要作用.
趋化因子与趋化因子受体的相互作用能诱导靶细胞趋化性的迁移及细胞骨架的重排, 增强靶细胞与内皮细胞的黏附能力, 广泛参与细胞的生长、发育、分化、凋亡等多种生理功能[7-9]. 趋化因子在肿瘤的生物学行为中表现出双向的调节作用. 一方面, 趋化因子能通过刺激肿瘤细胞生长, 趋化肿瘤细胞以及促进血管生长和消化细胞外基质的间接作用促进肿瘤的生长和转移[10,11]; 另一方面则可以通过抑制血管生成、趋化免疫活性细胞来抵抗肿瘤的生长和转移[12,13]. 并且, 特定的肿瘤表现出特定的转移方式, 转移的靶器官也不同[14].
趋化因子CXCL12与其特异性受体CXCR4所构成的CXCL12-CXCR4生物学轴在多种肿瘤的播散和器官特异性转移中发挥着重要的作用[15,16]. SDF-1是由骨髓基质细胞及其他相关的间皮细胞和上皮细胞分泌的一种趋化蛋白, 系统命名为CXCL12(CXC chemokine ligand 12). CXCR4是目前已知 SDF-1的唯一受体, 与其具有高度亲和力[17-19]. 自2001年Muller报道了CXCR4及其配体共同决定了乳腺癌的转移模式后[1], 研究不断表明CXCR4也在前列腺癌、B细胞淋巴瘤、星形胶质瘤及慢性淋巴细胞白血病的细胞系等多种肿瘤中表达, 因此CXCR4的作用可能并不限于乳腺癌[20-22].
食管鳞癌是人类最常见的消化系恶性肿瘤之一, 其生物学特征为易复发和早期的侵袭转移, 而大部分的复发是由于癌细胞的侵袭造成的, 因此食管鳞癌预后差, 死亡率高. 因此控制癌细胞的转移已成为食管鳞癌研究中最具意义的课题. 近年来的研究表明在食管鳞癌中存在CXCR4的高表达, 且CXCR4与食管鳞癌的浸润转移关系密切[23,24]. 本实验设计合成两对针对CXCR4基因不同位点的siRNA序列转染入食管鳞癌细胞EC-9706中, 侵袭小室实验结果显示, 转染siRNA组的EC9706细胞侵袭转移能力明显下降, 与空白组相比分别下降34.8%和30.3%, 差异具有统计学意义. 说明在食管鳞癌细胞EC-9706中抑制CXCR4基因的表达可有效抑制细胞的侵袭转移能力. MTT试验进一步表明在EC-9706细胞中抑制CXCR4基因的表达同样可以抑制细胞的增殖. 说明CXCR4基因在食管鳞癌的发生、发展中发挥重要作用. 不过CXCR4如何参与食管鳞癌的浸润转移目前报道甚少[25].
肿瘤的浸润和转移是一个连续的多步骤过程, 其中细胞基底膜的降解是肿瘤浸润、转移过程中必不可缺的环节[26]. MMPs是肿瘤细胞分泌的最主要的降解基底膜的蛋白酶, 因此MMPs的表达与肿瘤侵袭和转移也密切相关[27]. MMP-9是MMPs家族中相对分子量最大的酶, 他可以降解所有细胞外基质, 在肿瘤的侵袭、转移过程中发挥重要作用. 在正常生理条件下, MMP-9的表达受到严格的调控并保持平衡状态. 但在恶性肿瘤中, MMP-9的表达增强, 降解细胞外基质的能力增强, 引起浸润和转移, 另一方面MMP-9还可通过参与肿瘤血管新生促进肿瘤的生长和扩散[28,29].
RNA干涉技术是生物进化过程中基因组水平上的免疫监控机制, 作为一种特异性基因沉默技术, 越来越多地在某些疾病的发病机制和治疗等研究中发挥着重要作用[30]. 本研究中设计了2对针对CXCR4基因的siRNA片段, 半定量RT-PCR和Western blot检测结果显示, 两对siRNA在食管鳞癌EC-9706细胞中对CXCR4基因和蛋白的表达均有不同程度的抑制作用, 与空白组和转染阴性siRNA组的表达均有统计学意义. 本研究同时检测了siRNA沉默CXCR4基因后, 食管鳞癌EC-9706细胞中MMP-9基因的表达变化, 结果显示, 当CXCR4基因的表达被抑制后, MMP-9的表达无论从mRNA水平或蛋白水平都明显降低, 与空白组和转染阴性siRNA组的表达均有统计学意义, 说明MMP-9的上调机制有可能被阻断.
本研究表明在食管鳞癌EC-9706细胞中阻断CXCR4基因可以下调MMP-9基因的表达, 初步证实了在EC-9706细胞中CXCR4在MMP-9的转录调控中起重要作用, CXCR4可能通过上调MMP-9的表达在食管鳞癌的侵袭转移中发挥重要作用, CXCR4可作为食管鳞癌基因治疗的一个有效靶点.
食管癌是我国特别是河南省最常见的肿瘤之一, 在林州, 食管癌发生率距全国首位, 虽然手术和放化疗可以挽救一些患者的生命, 但转移的高发却使食管癌的治愈率不理想, 了解其转移的机制就至关重要, 本文就此做了相关研究.
王阁, 教授, 中国人民解放军第三军医大学第三附属学院; 葛海燕, 教授, 同济大学附属东方医院普通外科
本文研究把重点放在CXCR4基因上, 对此基因的研究早期主要集中于艾滋病, 近年来发现他不仅在艾滋病中具有研究意义, 在癌症中特别是在癌症的早期侵袭转移中的研究意义同样重要, 因此本文就把重点放在CXCR4在癌症的早期侵袭转移中的作用, 把他和与侵袭转移相关的基因MMP-9结合研究是本文的一个重点, 下一步作者希望在裸鼠体内再进一步研究.
虽然有相关文章研究CXCR4在食管癌发生、发展侵袭转移中的作用, MMP-9在食管癌侵袭转移中的重要作用, 但本文将二者联系起来, 研究表明了CXCR4通过何种途径, 如何参与食管癌发生、发展侵袭转移.
本研究表明在食管鳞癌EC-9706细胞中阻断CXCR4基因可以下调MMP-9基因的表达, 初步证实了在EC-9706细胞中CXCR4在MMP-9的转录调控中起重要作用, CXCR4可能通过上调MMP-9的表达在食管鳞癌的侵袭转移中发挥重要作用, CXCR4可作为食管鳞癌基因治疗的一个有效靶点.
本研究通过体外实验, 利用RNA干扰技术探讨了沉默CXCR4基因后食管鳞癌细胞株MMP-9 mRNA和蛋白水平表达的变化, 其所采用的实验思路及实验方法是正确的, 其结果对这一通路的认识具有比较积极的意义.
编辑: 曹丽鸥 电编:何基才
| 1. | Müller A, Homey B, Soto H, Ge N, Catron D, Buchanan ME, McClanahan T, Murphy E, Yuan W, Wagner SN. Involvement of chemokine receptors in breast cancer metastasis. Nature. 2001;410:50-56. [PubMed] [DOI] |
| 2. | Zhao BC, Zhao B, Han JG, Ma HC, Wang ZJ. Adipose-derived stem cells promote gastric cancer cell growth, migration and invasion through SDF-1/CXCR4 axis. Hepatogastroenterology. 2010;57:1382-1389. [PubMed] |
| 3. | Zhao BC, Wang ZJ, Mao WZ, Ma HC, Han JG, Zhao B, Xu HM. CXCR4/SDF-1 axis is involved in lymph node metastasis of gastric carcinoma. World J Gastroenterol. 2011;17:2389-2396. [PubMed] [DOI] |
| 4. | 周 静, 谢 立群, 李 轩, 陈 小义, 陈 莉, 郑 艳敏, 李 飞. 蛋白酶激活受体2激动剂对食管癌EC109细胞侵袭转移的促进作用. 世界华人消化杂志. 2010;18:1313-1319. [DOI] |
| 6. | Albini A, Iwamoto Y, Kleinman HK, Martin GR, Aaronson SA, Kozlowski JM, McEwan RN. A rapid in vitro assay for quantitating the invasive potential of tumor cells. Cancer Res. 1987;47:3239-3245. [PubMed] |
| 8. | Yoon Y, Liang Z, Zhang X, Choe M, Zhu A, Cho HT, Shin DM, Goodman MM, Chen ZG, Shim H. CXC chemokine receptor-4 antagonist blocks both growth of primary tumor and metastasis of head and neck cancer in xenograft mouse models. Cancer Res. 2007;67:7518-7524. [PubMed] [DOI] |
| 9. | 刘 静, 郭 华雄. 趋化因子CXCL12/CXCR4生物轴在肿瘤中的研究进展. 临床与实验病理学杂志. 2010;26:477-480. |
| 11. | Kodama J, Hasengaowa N, Kusumoto T, Hiramatsu Y. Expression of the CXCR4 and CCR7 chemokine receptors in human endometrial cancer. Eur J Gynaecol Oncol. 2007;28:370-375. [PubMed] |
| 12. | Xu Y, Zhang SZ, Huang PC, Chen J, Cai KR. [Expression of chemokine receptor CXCR4 in nasopharyngeal carcinoma cells]. Ai Zheng. 2004;23:136-140. [PubMed] |
| 14. | Zlotnik A, Burkhardt AM, Homey B. Homeostatic chemokine receptors and organ-specific metastasis. Nat Rev Immunol. 2011;11:597-606. [PubMed] [DOI] |
| 15. | Kryczek I, Wei S, Keller E, Liu R, Zou W. Stroma-derived factor (SDF-1/CXCL12) and human tumor pathogenesis. Am J Physiol Cell Physiol. 2007;292:C987-C995. [PubMed] [DOI] |
| 16. | Zhang JP, Lu WG, Ye F, Chen HZ, Zhou CY, Xie X. Study on CXCR4/SDF-1alpha axis in lymph node metastasis of cervical squamous cell carcinoma. Int J Gynecol Cancer. 2007;17:478-483. [PubMed] [DOI] |
| 17. | Burger JA, Stewart DJ, Wald O, Peled A. Potential of CXCR4 antagonists for the treatment of metastatic lung cancer. Expert Rev Anticancer Ther. 2011;11:621-630. [PubMed] [DOI] |
| 18. | Tseng D, Vasquez-Medrano DA, Brown JM. Targeting SDF-1/CXCR4 to inhibit tumour vasculature for treatment of glioblastomas. Br J Cancer. 2011;104:1805-1809. [PubMed] [DOI] |
| 19. | Yasumoto K, Koizumi K, Kawashima A, Saitoh Y, Arita Y, Shinohara K, Minami T, Nakayama T, Sakurai H, Takahashi Y. Role of the CXCL12/CXCR4 axis in peritoneal carcinomatosis of gastric cancer. Cancer Res. 2006;66:2181-2187. [PubMed] [DOI] |
| 22. | Lee YL, Kuo WH, Lin CW, Chen W, Cheng WE, Chen SC, Shih CM. Association of genetic polymorphisms of CXCL12/SDF1 gene and its receptor, CXCR4, to the susceptibility and prognosis of non-small cell lung cancer. Lung Cancer. 2011;73:147-152. [PubMed] [DOI] |
| 23. | Wang DF, Lou N, Zeng CG, Zhang X, Chen FJ. Expression of CXCL12/CXCR4 and its correlation to prognosis in esophageal squamous cell carcinoma. Ai Zheng. 2009;28:154-158. [PubMed] |
| 24. | Sasaki K, Natsugoe S, Ishigami S, Matsumoto M, Okumura H, Setoyama T, Uchikado Y, Kita Y, Tamotsu K, Sakurai T. Expression of CXCL12 and its receptor CXCR4 correlates with lymph node metastasis in submucosal esophageal cancer. J Surg Oncol. 2008;97:433-438. [PubMed] [DOI] |