修回日期: 2011-09-05
接受日期: 2011-09-15
在线出版日期: 2011-09-18
目的: 观察胃旁路术(gastric bypass, GBP)对非肥胖型2型糖尿病大鼠(Goto-Kakizaki rats; GK大鼠)血糖的影响, 并探讨其机制.
方法: GK大鼠20只, Wistar大鼠10只, 均为雄性. 分为GK手术组、GK假手术组和Wistar假手术组, 每组10只. 手术组行胃旁路术. 测定术前1 wk及术后第1、2、4、8、12 wk各组大鼠的空腹血糖(FPG)、糖化血红蛋白(HbAlc)和血清胰岛素(INS), 并同期检测血清Ghrelin水平.
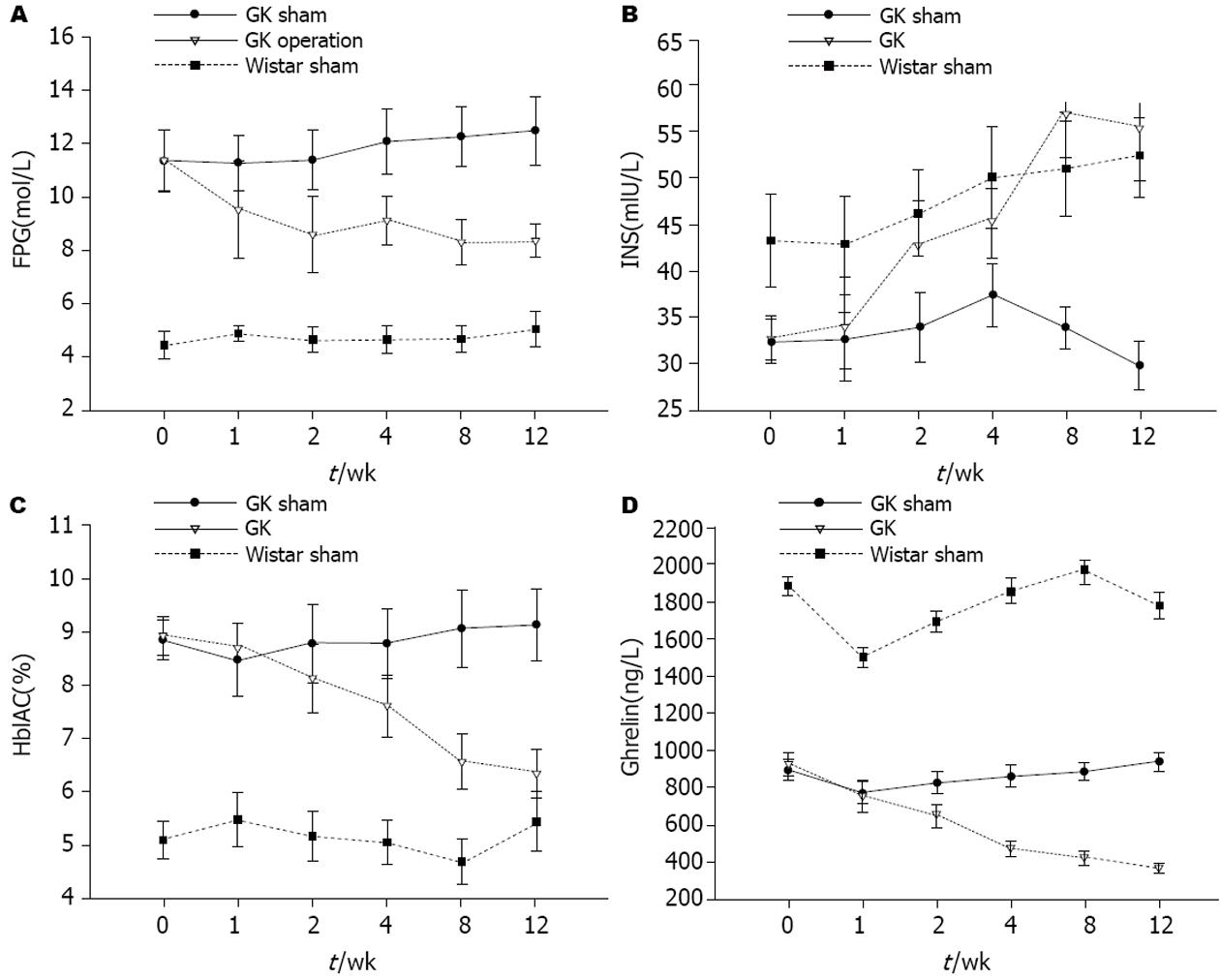
结果: 术后第12周, GK手术组大鼠FPG和HbAlc分别由术前的11.36 mmol/L±1.14 mmol/L和8.91%±0.36%下降到8.36±0.62 mmol/L和6.35%±0.46%, 血清INS由术前32.76 mIU/L±2.37 mIU/L上升到55.14 mIU/L±5.45 mIU/L, 而Ghrelin由术前928.53 ng/L±58.66 ng/L下降到367.83 ng/L±27.78 ng/L, 差异均有统计学意义(P<0.05).
结论: GBP可以明显改善GK大鼠的糖代谢, 其作用机制可能与降低Ghrelin水平, 进而促进胰岛素分泌有关.
引文著录: 曹超, 曾荣, 张鹏, 周晓磊, 尤胜义. 胃旁路术对GK大鼠糖代谢影响及其与Ghrelin的关系. 世界华人消化杂志 2011; 19(26): 2768-2771
Revised: September 5, 2011
Accepted: September 15, 2011
Published online: September 18, 2011
AIM: To investigate the influence of gastric bypass (GBP) surgery on glucose metabolism in Goto-Kakizaki (GK) rats and to explore the possible mechanisms involved.
METHODS: Twenty male GK rats and 10 male Wistar rats were randomized into three groups: GK operation group, GK sham operation group and Wistar sham operation group. The GK operation group underwent gastric bypass surgery. The levels of fasting plasma glucose (FPG), glycosylated hemoglobin (HbAlc), serum insulin (INS) and ghrelin were monitored 1 week before surgery and 1, 2, 4, 8 and 12 weeks after surgery.
RESULTS: In the GK operation group, FPG level decreased from (11.36 ± 1.14) mmol/L before surgery to (8.36 ± 0.62) mmol/L 12 weeks after surgery, and HbAlc from (8.91 ± 0.36)% to (6.35 ± 0.46)%. Serum INS increased from (32.70 ± 2.37) mIU/L before surgery to (55.14 ± 5.45) mIU/L 12 weeks after surgery, while serum ghrelin level decreased from (928.53 ± 58.66) pg/mL to (367.83 ± 27.78) pg/mL. All the above parameters differed significantly between before surgery and 12 weeks after surgery (all P < 0.05).
CONCLUSION: GBP can significantly improve glycometabolism in GK rats possibly by decreasing ghrelin levels and promoting insulin secretion.
- Citation: Cao C, Zeng R, Zhang P, Zhou XL, You SY. Gastric bypass surgery improves glucose metabolism possibly by decreasing ghrelin levels in Goto-Kakizaki rats. Shijie Huaren Xiaohua Zazhi 2011; 19(26): 2768-2771
- URL: https://www.wjgnet.com/1009-3079/full/v19/i26/2768.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i26.2768
近年来临床研究发现, 胃旁路术(gastric bypass, GBP)对肥胖型2型糖尿病(type 2 diabetes mellitus, T2DM)具有一定的治疗作用[1,2], 但其机制尚不明确[3-5], 且对于非T2DM是否同样具有治疗作用还有待于进一步研究. GK大鼠是一种自发性非T2DM大鼠, 是目前公认的T2DM模型之一, 也是建立GBP模型的最佳动物. 本研究拟通过对GK大鼠行GBP, 观察这种术式对GK大鼠空腹血糖(fasting plasma glucose, FPG)、糖化血红蛋白(glycosylated hemoglobin, HblAc)、胰岛素(insulin, INS)以及血清Ghrelin水平等的影响, 并进一步探讨其可能的机制, 为外科治疗非T2DM提供理论依据.
8周龄♂GK大鼠20只, 体质量220-240 g, 购自上海斯莱克实验动物有限公司. 8周龄♂Wistar大鼠10只, 体质量200-230 g, 购自北京维通利华实验动物技术有限公司, 合格证号: SCXK(京)2007-0001. 实验前适应环境2 wk, 严格在无特殊致病菌的条件下饲养. 强生One Touch Ultra型血糖仪(强生公司, 美国), 全自动生化分析仪(瑞士Roche公司, Modular P型)及配套试剂, 大鼠INS ELISA试剂盒(北京友华志科科技有限公司), 大鼠生长激素释放肽Ghrelin(GHRP-Ghrelin)定量检测试剂盒(ELISA)(北京友华志科科技有限公司).
1.2.1 分组与手术: 2 wk后30只大鼠分成3组: GK手术组、GK假手术组和Wistar假手术组. 所有大鼠均在10周龄行手术. 术前各组大鼠禁食16 h, 不禁水. 采用硫喷妥钠(1.0 mL/kg)腹腔注射麻醉, 待麻药生效后, 取上腹正中长约4 cm的切口, 切开腹腔, 行远端胃大部切除, 缝合十二指肠残端, 在距Treitz韧带约8 cm处切断空肠, 远端肠袢与胃残壁行端侧吻合, 近端肠袢在距胃-空肠吻合口以远12 cm处行空肠端侧吻合. 假手术组开腹将胃肠道拉出体外后再放回, 并保持手术时间与手术组一致.
1.2.2 FPG: 术前1 wk及术后第1、2、4、8、12周各组大鼠禁食12 h, 清晨采集大鼠尾静脉血液, 使用强生One Touch Ultra型血糖仪(强生公司, 美国)测量FPG.
1.2.3 HbAlc: 术前1 wk及术后第1、2、4、8、12周内眦静脉取血, 采用免疫抑制比浊法测定HbAlc, 并计算其百分率.
1.2.4 血清INS和Ghrelin: 术前1 wk、术后第1、2、4、8、12周, 禁食12 h后, 清晨尾静脉取血2 mL, 在4 ℃下以3 000 r/min离心10 min, 分离血清, -70 ℃低温冰箱保存待测量. 采用放射免疫法统一检测血清INS, 应用双抗体夹心酶标免疫分析(ELISA)法测定血清标本中Ghrelin水平.
统计学处理 实验数据采用mean±SD表示, 采用SPSS11.3统计软件做统计学处理. 检验各组变量正态分布情况, 不同组之间的同一时间点指标采用独立样本的t检验, 单个指标手术前后的变化采用配对t检验, 以P<0.05为显著性差异标准.
术前GK假手术组与GK手术组血糖均明显高于Wistar假手术组.术后GK手术组大鼠FPG水平降低, 与GK假手术组同期FPG相比均降低, 且12 wk时FPG(8.36 mmol/L±0.62 mmol/L)显著低于术前(11.36 mmol/L±1.14 mmol/L), 差异有统计学意义(P<0.05). 而GK假手术组与Wistar假手术组大鼠术前与术后差异均无统计学意义(图1A).
术前GK假手术组与GK手术组HblAc均高于Wistar假手术组. 术后GK手术组较术前持续下降, 12 wk时HblAc水平(6.35%±0.46 %)显著低于术前(8.91%±0.36 %), 差异有统计学意义(P<0.05). 而GK假手术组与Wistar假手术组大鼠术前与术后差异均无统计学意义(图1B).
术前Wistar假手术组血清INS水平高于GK假手术组与GK手术组. 术后GK手术组INS较术前显著上升, 术后各观察点INS均高于GK假手术组同期水平, 12 wk时(55.14 mIU/L±5.45 mIU/L)与术前比较(32.76 mIU/L±2.37 mIU/L)显著升高, 具有统计学意义(P<0.05). GK假手术组术后1、2 wk也有小幅度上升, 4、8、12 wk呈下降趋势. 而Wistar假手术组INS亦有变化不显著(图1C)
术前Wistar假手术组Ghrelin水平高于GK假手术组与GK手术组. 术后GK手术组各时间点大鼠血清Ghrelin显著下降, 至12 wk时Ghrelin水平(928.53 ng/L±58.66 ng/L)显著低于术前(367.83 ng/L±27.78 ng/L), 具有统计学意义(P<0.05). 而GK假手术组大鼠术后各时间点与术前比较, 差异无统计学意义. 与Wistar假手术组比较, GK手术组Ghrelin均明显低于其同期Ghrelin水平, 具有统计学意义(P<0.05, 图1D).
近年来, 糖尿病的发病率迅速增加, 目前全球糖尿病患者愈1.7亿[6], 预计2025年世界糖尿患者数将达3.33亿, 其中T2DM约占90%以上, 因此T2DM的治疗越来越受到人们的关注. GBP作为一种有效的减肥手术, 临床对T2DM的治疗效果已得到肯定[1,2], 对于GBP该善糖代谢的治疗机制成为一个新的研究热点, 多篇报道认为改良GBP术后血浆胰高血糖素样肽-1(glucagon-like peptide-1, GLP-1)升高, 导致胰岛素分泌增多, 从而达到降低血糖的作用[7-9], 但其论点仍未达成共识. 大多数学者都以大鼠为模型进行研究, 我们选择的GK大鼠是一种自发性非T2DM大鼠, 更接近于人类T2DM的糖代谢变化, 血糖变化值较实验干预诱导的糖尿病模型稳定. 本实验我们动态地观察了GBP对GK大鼠糖代谢的影响, GBP术后第1周GK手术组大鼠的FPG较术前下降, 差异有统计学意义(P<0.05), 随着观察周期的延长, GK手术组大鼠2、4、8、12周FPG始终显著低于术前水平, 并且低于GK假手术组同期FPG, 差异均有统计学意义(P<0.05). 与此同时GK手术组术后HblAc较术前也显著下降, 说明GBP术后第1周开始就能显著改善GK大鼠FPG, 降低HblAc水平, 持久稳定改善糖代谢障碍.
对于GBP治疗T2DM的机制目前尚无定论, 相关研究已证实体质量减轻和饮食减少并不是血糖降低的主要因素[5,10,11]. Ghrelin是日本学者Kojima等[12]于1999年在大鼠胃黏膜细胞中发现的一种脑肠肽, 是促生长激素分泌剂受体(growth hormone secretagogue receptor, GHS-R)的内源性配体. 有研究表明Ghrelin对胰岛细胞分泌功能具有调节作用: 在低浓度的葡萄糖浓度(3 mmol/L)时, Ghrelin不影响胰岛素的分泌; 但在高浓度葡萄糖浓度(15 mmol/L)时, Ghrelin可抑制胰岛素的分泌[13]. 李琳等[14]进一步研究证实, 小鼠胰腺β细胞株NIT-1细胞在DMEM培养基中, 拮抗Ghrelin至零的情况下, 25 mmol/L比5.6 mmol/L葡萄糖刺激后的NIT-1细胞分泌的胰岛素水平增加1倍以上. 胰岛素是维持血糖正常最重要的激素, 本实验我们选用的GK大鼠为高血糖状态, 而Wistar大鼠为血糖正常大鼠, 结果显示, GBP术后GK大鼠的INS水平明显升高, 同时也显著高于GK假手术组同期INS, 差异有统计学意义(P<0.05), 接近于Wistar假手术组, 提示GBP改善GK大鼠糖代谢的治疗机制可能与提高胰岛素分泌有关. GK手术组大鼠术前Ghrelin普遍高于Wistar普通大鼠, 术后血清Ghrelin水平持续下降, 第12周(367.83±27.78) ng/L与术前(928.53±58.66) ng/L比较明显降低(P<0.05), 与此同时血清INS第12周(55.14±5.45) mIU/L与术前(32.76±2.37) mIU/L相比显著升高(P<0.05). 而GK假手术组与Wistar假手术组血清Ghrelin与INS术后与术前相比, 差异无统计学意义(P>0.05). 上述实验结果提示, GBP可能是通过降低Ghrelin水平, 使胰岛素分泌增加, 从而改善GK大鼠糖代谢障碍的.
然而, GBP降低Ghrelin水平的机制仍然不清, 目前被多数学者接受的为"前肠假说", 即GBP旷置了十二指肠和近端空肠, 使得营养素转运, 前肠被排除出肠-胰岛轴, 抑制了Ghrelin的分泌, 但是其具体信号机制仍然有待于进一步探讨.
目前2型糖尿病的治疗是世界性难题, 近年来发病率呈逐年上升趋势. 国外学者意外发现胃旁路术等可以有效改善糖尿病患者糖代谢, 为外科治疗糖尿病开辟了新途径, 掀起了一股研究热潮.
秦环龙, 教授, 上海交通大学附属第六人民医院外科
GBP治疗2型糖尿病的机制仍不明确. 近年来, 国内外大多数学者认同肠-胰岛轴学说, 即术后胃肠激素的变化影响了胰岛素的分泌, 然而至今都没有确切的证据证明是什么因子作为介质, 调节了胰岛细胞分泌胰岛素.
对于GBP可以降低血糖, 已得到广泛认可, 国内也有多篇相关报道, 然而仍未有确切的作用机制. Nicholas等首次提出糖尿病患者接受GBP后血糖的改善可能与血清Ghrelin水平降低有关.
目前, 多数研究主要集中在GBP后GLP-1的变化降低了血糖. 然而多篇国外文献发现GBP后Ghrelin在患者胃肠道和胰腺均有较高表达, 而且本课题组前期体外实验表明Ghrelin能够显著抑制离体胰岛在葡萄糖刺激下的胰岛素释放, 这些均提示Ghrelin可能在肠-胰岛轴学说中扮演重要角色.
GBP可以改善糖代谢为糖尿病的治疗提供了新的思路, 治疗T2DM可能具有广阔前景. 明确GBP治疗治疗T2DM的确切机制, 能够为临床开展外科手术治疗T2DM奠定理论基础.
本研究阐述了大鼠在接受胃旁路手术后糖代谢的影响, 具有一定代表性,有一定的临床参考价值.
编辑: 李军亮 电编:何基才
| 1. | Buchwald H, Williams SE. Bariatric surgery worldwide 2003. Obes Surg. 2004;14:1157-1164. [PubMed] [DOI] |
| 2. | Cummings DE, Flum DR. Gastrointestinal surgery as a treatment for diabetes. JAMA. 2008;299:341-343. [PubMed] [DOI] |
| 3. | Wickremesekera K, Miller G, Naotunne TD, Knowles G, Stubbs RS. Loss of insulin resistance after Roux-en-Y gastric bypass surgery: a time course study. Obes Surg. 2005;15:474-481. [PubMed] [DOI] |
| 4. | Rubino F, Marescaux J. Effect of duodenal-jejunal exclusion in a non-obese animal model of type 2 diabetes: a new perspective for an old disease. Ann Surg. 2004;239:1-11. [PubMed] [DOI] |
| 5. | Alexandrides TK, Skroubis G, Kalfarentzos F. Resolution of diabetes mellitus and metabolic syndrome following Roux-en-Y gastric bypass and a variant of biliopancreatic diversion in patients with morbid obesity. Obes Surg. 2007;17:176-184. [PubMed] [DOI] |
| 6. | Papadopoulos AA, Kontodimopoulos N, Frydas A, Ikonomakis E, Niakas D. Predictors of health-related quality of life in type II diabetic patients in Greece. BMC Public Health. 2007;7:186. [PubMed] [DOI] |
| 8. | Liu Y, Zhou Y, Wang Y, Geng D, Liu J. Roux-en-Y gastric bypass-induced improvement of glucose tolerance and insulin resistance in type 2 diabetic rats are mediated by glucagon-like peptide-1. Obes Surg. 2011;21:1424-1431. [PubMed] [DOI] |
| 9. | Laferrère B, Heshka S, Wang K, Khan Y, McGinty J, Teixeira J, Hart AB, Olivan B. Incretin levels and effect are markedly enhanced 1 month after Roux-en-Y gastric bypass surgery in obese patients with type 2 diabetes. Diabetes Care. 2007;30:1709-1716. [PubMed] [DOI] |
| 10. | Rubino F, Forgione A, Cummings DE, Vix M, Gnuli D, Mingrone G, Castagneto M, Marescaux J. The mechanism of diabetes control after gastrointestinal bypass surgery reveals a role of the proximal small intestine in the pathophysiology of type 2 diabetes. Ann Surg. 2006;244:741-749. [PubMed] [DOI] |
| 11. | Meneghini LF. Impact of bariatric surgery on type 2 diabetes. Cell Biochem Biophys. 2007;48:97-102. [PubMed] [DOI] |
| 12. | Kojima M, Hosoda H, Date Y, Nakazato M, Matsuo H, Kangawa K. Ghrelin is a growth-hormone-releasing acylated peptide from stomach. Nature. 1999;402:656-660. [PubMed] [DOI] |
| 13. | Wierup N, Yang S, McEvilly RJ, Mulder H, Sundler F. Ghrelin is expressed in a novel endocrine cell type in developing rat islets and inhibits insulin secretion from INS-1 (832/13) cells. J Histochem Cytochem. 2004;52:301-310. [PubMed] [DOI] |