修回日期: 2011-09-06
接受日期: 2011-09-07
在线出版日期: 2011-09-08
目的: 对比研究胃癌组织中免疫组织化学法(IHC)检测Her-2蛋白表达和荧光原位杂交法(FISH)检测Her-2基因扩增结果的差异性和相关性, 并评估其临床应用价值.
方法: 采用EliVisionTM plus免疫组织化学染色方法和荧光原位杂交法检测118例胃癌组织中Her-2蛋白表达及Her-2基因扩增状况, 并进行对比分析.
结果: 118例胃癌组织中, IHC检测Her-2蛋白表达(0)40例, (+)33例, (++)16例, (+++)29例, Her-2蛋白过表达率24.6%; FISH检测Her-2基因扩增38例, 无扩增80例, Her-2基因扩增率32.2%. 40例Her-2蛋白表达为(0)的标本中38例经FISH检测Her-2基因无扩增(95.0%); 33例表达为(+)的标本中30例无扩增(90.9%); 16例表达为(++)的标本中9例无扩增, 7例扩增; 29例表达为(+++)的标本中26例扩增(89.7%).
结论: Her-2蛋白表达为(0-+)或(+++)时, IHC和FISH检测结果较一致, 两种方法总符合率为85.6%, 两者呈显著相关(P<0.01), IHC可作为初步筛查胃癌Her-2的首选方法.当Her-2表达为(++)时, 则有必要进一步行FISH法检测.
引文著录: 刘学政, 陈铭, 张家均, 董虹, 柳文菊. IHC和FISH检测胃癌Her-2蛋白表达及基因扩增的比较. 世界华人消化杂志 2011; 19(25): 2679-2683
Revised: September 6, 2011
Accepted: September 7, 2011
Published online: September 8, 2011
AIM: To compare the difference and correlation between immunohistochemistry (IHC) to detect Her-2 protein expression and fluorescent in situ hybridization (FISH) to detect Her-2 gene amplification in gastric cancer and to assess their clinical value.
METHODS: Immunohistochemistry and FISH were used to detect Her-2 protein expression and Her-2 gene amplification in 118 cases of gastric carcinoma, respectively. A comparative analysis was then performed.
RESULTS: Of 118 cases of gastric carcinoma, 40 showed no Her-2 protein expression (0), 33 showed mild expression (+), 16 had moderate expression (++), and 29 had strong expression (+++). The rate of Her-2 protein overexpression was 24.6%. Her-2 gene amplification was detected in 38 cases, and 80 cases had no amplification. The rate of Her-2 gene amplification was 32.2%. Of 40 cases of gastric carcinoma showing no Her-2 protein expression, 38 (95%) had no Her-2 gene amplification (95%). Of 33 patients showing Her-2 protein mild expression, 30 (90.9%) had no Her-2 gene amplification. Of 16 patients showing moderate Her-2 protein expression, 9 had no gene amplification. Of 29 patients showing strong Her-2 protein expression, 26 (89.7%) had Her-2 gene amplification.
CONCLUSION: The total coincidence rate between IHC and FISH was 85.6%. IHC can be used for initial screening of Her-2 expression status in gastric cancer. When moderate or strong Her-2 protein expression is detected, it is necessary to conduct FISH assay to confirm the result.
- Citation: Liu XZ, Chen M, Zhang JJ, Dong H, Liu WJ. Fluorescence in situ hybridization versus immunohistochemistry in the detection of Her-2 gene amplification and protein expression in gastric cancer. Shijie Huaren Xiaohua Zazhi 2011; 19(25): 2679-2683
- URL: https://www.wjgnet.com/1009-3079/full/v19/i25/2679.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i25.2679
Her-2是定位于人类染色体17q12-21.3的原癌基因, 编码一种具有酪氨酸激酶活性的跨膜生长因子受体, 由胞外区、跨膜区及胞内区构成, 是表皮生长因子受体(Epidermal growth factor receptor, EGFR)家族成员之一. 该受体蛋白与Her家族成员及其配体之间相互作用, 通过细胞间的信号传导, 调节细胞生长、分化和增殖. Her-2蛋白过表达和(或)基因扩增不仅与胃癌复发、转移和不良预后密切相关, 并且还是制定有效治疗方案如分子靶向治疗[1,2]、激素治疗和化疗的重要参考指标. 因此准确检测Her-2基因是成功治疗胃癌的关键, 使Her-2表达的准确检测显得尤为重要. 本实验主要讨论应用免疫组织化学(Immunohistochemistry, IHC)检测Her-2蛋白表达, 并结合荧光原位杂交(fluorescence in situ hybridization, FISH)检测胃癌Her-2基因扩增状况, 比较两种方法的差异性和相关性.
收集2009-2010年荆州市第一人民医院消化科患者行外科手术切除的胃癌组织标本118例, 年龄54-72(平均63)岁. 术前均未接受放化疗. 本研究方案已通过本单位伦理委员会批准. 兔抗人Her-2为北京中山生物技术有限公司产品, FISH检测用Her-2探针, 购自Vysis公司, 荧光显微镜为奥林帕斯公司产品(BX51).
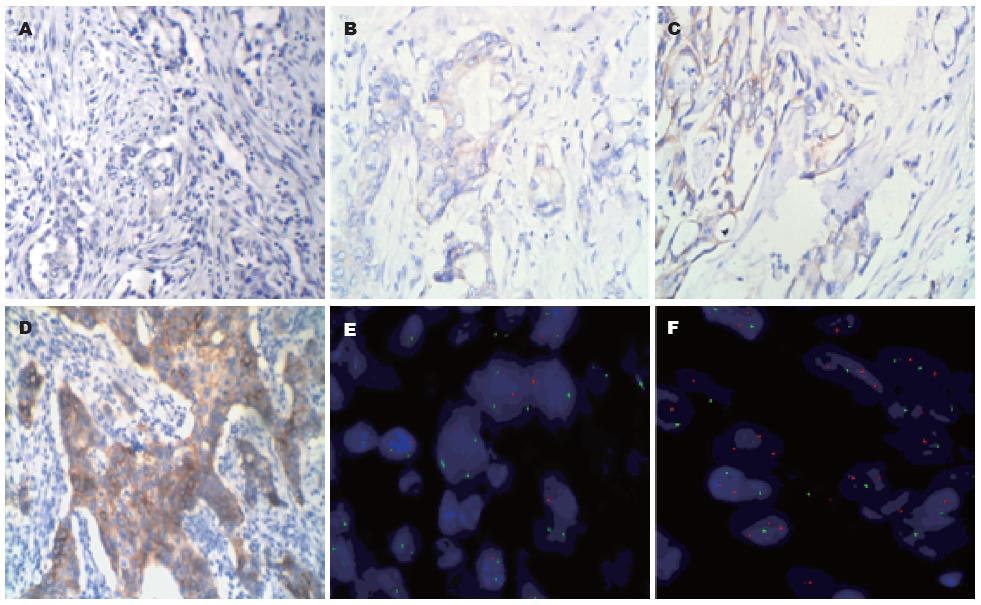
1.2.1 IHC: 标本经40 g/L中性甲醛固定, 常规石蜡包埋, 4 µm连续切片, 采用IHC EliVisionTM plus二步法染色. 高倍显微镜下观察10个视野, Her-2蛋白表达定位于细胞膜, 阳性反应物为棕黄色颗粒.
1.2.2 FISH: 将17号染色体着丝粒(CEP 17)标记为绿色, Her-2基因标记为红色. 具体步骤如下, 切片经二甲苯脱蜡、复水、沸水浴30 min, 200 mg/L胃蛋白酶37 ℃作用20-40 min, 体积分数1%甲醛固定10 min, 梯度乙醇脱水, 加入10 µL探针混合液, 杂交仪83 ℃变性5 min, 42 ℃过夜杂交. 经0.3% NP-40/0.4×SSC 66 ℃ 1 min, 0.11% NP-40/2×SSC室温1 min, 700 mL/L乙醇3 min洗片, 干燥后, 加入10 µL DAPI复染剂复染, 封片, 暗处静置20 min后于荧光显微镜下计数30个细胞, 统计Ratio值(Ratio值 = 30个细胞核中红信号总数/30个细胞核中绿信号总数).
1.2.3 IHC和FISH结果判读标准: Hofmann等[3]推荐专用于胃癌Her-2蛋白检测的评分系统(2008), 该系统判别要点如下[4]. IHC: 细胞膜均无染色或<10%肿瘤细胞膜染色者结果为(0/阴性); 肿瘤细胞>10%, 细胞膜不完整, 弱染色者结果为(+/阴性); 肿瘤细胞>10%, 细胞膜轻度至中度完整, 染色者结果为(++/不确定); 肿瘤细胞>10%, 细胞膜完整, 强染色者结果为(+++/阳性). FISH: Ratio<1.8为阴性结果, 提示该样本无Her-2基因扩增; Ratio在1.8-2.2之间时, 增加细胞计数至100个或重做FISH实验来判断最终结果; Ratio>2.2为阳性结果, 提示样本中Her-2基因发生扩增; 红信号点成簇扩增, 也记为Her-2基因扩增阳性.
统计学处理 应用SPSS13.0软件对数据进行统计, 采用Kendall进行相关性分析, P<0.05有统计学意义.
118例胃癌组织中, 40例标本Her-2表达为(0); 33例标本Her-2表达为(+); 16例标本Her-2表达为(++); 29例标本Her-2表达为(+++). Her-2蛋白过表达率24.6%(29/118).
118例胃癌组织中, 80例标本无扩增, 38例标本扩增. Her-2基因扩增率32.2%(38/118).
IHC检测Her-2蛋白表达(0)40例标本中, 38例经FISH检测无Her-2基因扩增, 2例扩增; Her-2表达(+)33例标本中, 30例无扩增, 3例扩增; Her-2表达(++)16例标本中, 9例无扩增(56.2%), 7例扩增(43.8%); Her-2表达(+++)29例标本中, 3例无扩增, 26例扩增. Her-2蛋白表达为(0-+)和(+++)时, Her-2基因扩增符合率分别为95.0%(38/40)、90.9%(30/33)和89.7%(26/29), IHC和FISH两种方法检测结果总符合率为85.6%(101/118), 两者呈显著相关(τ = 0.753, P<0.01, 表1, 图1).
| IHC | FISH | 合计 | |
| 扩增 | 无扩增 | ||
| 0 | 2 | 38 | 40 |
| + | 3 | 30 | 33 |
| ++ | 7 | 9 | 16 |
| +++ | 26 | 3 | 29 |
| 合计 | 38 | 80 | 118 |
胃癌是我国最常见的消化系恶性肿瘤之一, 病死率居我国各种恶性肿瘤之首. 绝大多数患者确诊时已属进展期, 此期手术治疗效果差, 腹膜播散、肝脏及淋巴结转移严重影响其预后, 术后生存率明显降低. 目前已知, 许多肿瘤的发生和转移都与特定癌基因或受体基因过表达导致的细胞过度增殖有关. 其中, Her-2已被证实是与多种肿瘤发生、发展和转移密切相关的受体. 多数研究表明, Her-2的过表达常常预示肿瘤患者预后不良[5]. Park等[6]的随访结果显示, Her-2阳性患者5年生存率低于阴性者. 陈斌等[7]报道Her-2表达阳性者中位生存时间显著低于阴性者. 从而证实了Her-2表达阳性在胃癌的预后中具有重要作用. Her-2的表达与肿瘤大小、组织分化程度、淋巴结转移有关, 这就意味着随着肿瘤进展, 有更多的肿瘤细胞脱落, 而分化差的肿瘤细胞其侵袭能力、转移能力更强, 淋巴结的转移又进一步促进了肿瘤的远处转移, 这可以解释Her-2表达导致不良预后的原因, 亦与Luebke[8]报道的一致. 有研究显示[9], Her-2表达阳性的乳腺癌或胃癌患者预后显著比Her-2表达阴性患者差. Allgayer等[10]发现Her-2过表达的胃癌患者,生存期较Her-2低表达患者短, 他们认为Her-2是一新的预测胃癌总生存期的独立参数. 最新研究发现Her-2过表达与胃癌患者的预后密切相关[11,12]. 因此, 对 Her-2状态的准确检测有助于判断预后. 在分子靶向治疗方面, 经ToGA研究证实[13], 曲妥珠单抗联合化疗可改善Her-2阳性晚期胃癌患者的生存情况, 尤其是Her-2高水平表达者(IHC++/FISH扩增或IHC+++)的生存期, 由对照组的11.8 mo提高至16.0 mo. 同时, 使缓解率从34.5%提高至47.3%, 而通常胃癌化疗的缓解率为30%, 因此可谓是胃癌治疗的一项里程碑式研究. ToGA研究结果确立了曲妥珠单抗在胃癌中的治疗地位, 使其有望成为Her-2阳性胃癌患者的重要治疗药物.
在Her-2基因与乳腺癌靶向治疗的研究取得了显著进展的同时, 近年来越来越多的学者将目光投向了Her-2基因与胃癌的关系, 并取得了一定的进展. 目前国内关于胃癌组织IHC与FISH检测Her-2基因状态的对比实验较少, 为此, 本研究在两种检测方法的优缺点、Her-2基因状态的一致性及可能导致两者出现差异的原因等方面做出了进一步探讨.
目前美国食品及药物管理局(FDA)批准用于Her-2检测的方法有2种: 即检测Her-2蛋白的IHC和检测Her-2基因的FISH. 因IHC技术具有操作简便、廉价、快速等特点, 胃癌肿瘤异质性较为常见, IHC可通过明视野显微镜能检测到肿瘤组织内的局部Her-2阳性, 并具一定的预后预测价值, 因此IHC成为目前病理学实验室检测Her-2状态及用于Her-2相关靶向治疗患者的首选方法. 由于IHC本身的手工操作特点, 从而检测过程会受许多因素干扰, 首先是方法间接, 再加上判断标准的不一致, 尤其受人为主观因素的影响较大; 其次是石蜡包埋、甲醛固定可能会对免疫组织化学检测的结果产生影响, 抗原修复时, 提高了灵敏度而降低了特异性造成一定的假阳性; 三是如果采用不同公司生产的Her-2抗体, 检测结果也不完全相同. 与蛋白质相比, DNA的检测则具有较高的准确性和稳定性. FISH是分子遗传学常用的检测技术, 不仅可以用于异常染色体的检测, 也可以用于观察目标基因的扩增情况, 该项技术具有高准确性、高灵敏性和高稳定性的特点. FISH既可以在组织和细胞结构相对完整的前提下, 于癌细胞原位分析单细胞核内基因的变化, 又同时排除了其他非癌细胞的干扰, 结果相对客观, 因此FISH能直接和准确地判断Her-2基因是否存在扩增, 被公认为是目前胃癌Her-2基因状态检测的金标准[14], 但存在实验过程相对复杂, 费用较昂贵, 失败率偏高等缺点.崔小伟等[15]报道, 大约6%-35%的Her-2在胃癌中表达的不尽相同. 日本学者[16]研究显示200例胃癌手术切除标本中IHC检测有23%病例Her-2蛋白过表达, FISH检测有27%病例存在Her-2基因扩增, 两者符合率为86.7%. 本研究中IHC检测显示24.6%病例有Her-2蛋白过表达, FISH检测显示32.2%病例存在Her-2基因扩增, 两种方法总符合率为85.6%, 结果与之较为相符. Yaziji等[17]研究显示, FISH检测Her-2基因无扩增和IHC检测Her-2蛋白表达(0-+)病例, 以及FISH检测Her-2基因扩增与IHC检测Her-2蛋白(+++)的病例的结果之间有极好的相关性. 本研究中显示Her-2表达为(0-+)和(+++)时, Her-2扩增符合率分别为95.0%、90.9%和89.7%. 提示如果严格控制实验操作流程, 两种方法检测病例的结果之间的一致性较高(P<0.01), 本研究与之报道较一致. 由于IHC在普通实验室容易开展, 可以作为Her-2状态检测的初筛. 当Her-2蛋白表达(++)时Her-2基因扩增率为43.8%, 两种检测方法的符合率较低. 可能是由于统计病例数量偏少、结果判读主观因素影响和评分标准不同等原因所致. 提示当IHC检测Her-2蛋白表达为(++)时, 结果具不确定性, 病例则有必要进一步行FISH检测以明确Her-2基因状态的变化情况[11].
总之, 综合应用IHC与FISH两种方法检测Her-2状态可以更加准确和客观地为临床提供参考[18], 并在胃癌患者的临床治疗策略和预后[19]评估中具有重要意义.
胃癌在全世界肿瘤死因中占第2位, 大部分患者在诊断时已属晚期, 放化疗效果均不理想. Her-2蛋白过表达和(或)基因扩增不仅与胃癌复发、转移和不良预后密切相关, 并且还是制定有效治疗方案如分子靶向治疗、激素治疗和化疗的重要参考指标, 使Her-2表达的准确检测显得尤为重要.
郑鹏远, 教授, 郑州大学第二附属医院消化科
在HER-2基因与乳腺癌靶向治疗的研究取得了显著进展的同时, 近年来越来越多的学者将目光投向了HER-2基因与胃癌的关系, 胃癌的分子生物学及分子靶向治疗已成为目前肿瘤治疗及预后判断的研究热点之一.
Hofmann等发现胃癌病例较乳腺癌病例肿瘤异质性更常见, 而且部分胃癌病例, 尤其是高分化腺癌病例, 位于腺腔面的瘤细胞保留分泌功能而不被标记物着色. 形成"U"型(基底和侧面)不完整着色. 据此认为胃癌的Her-2评分标准应与乳腺癌的评分标准不同.
本文全面比较了IHC和FISH两种方法检测胃癌组织Her-2蛋白及基因的优缺点, 介绍了胃癌靶向治疗等最新进展, 使读者对胃癌Her-2基因研究现状有全新的认识.
本文为胃癌组织Her-2状态提供不同检测方法及其判断标准, 并为胃癌的诊断、治疗及预后提供参考依据.
本文学术价值较好, 内容详实, 选题新颖有一定的临床意义.
编辑: 何基才 电编:何基才
| 3. | Hofmann M, Stoss O, Shi D, Büttner R, van de Vijver M, Kim W, Ochiai A, Rüschoff J, Henkel T. Assessment of a HER2 scoring system for gastric cancer: results from a validation study. Histopathology. 2008;52:797-805. [PubMed] [DOI] |
| 4. | 陈 娟, 李 东石, 余 英豪, 王 烈, 欧阳 学农, 谢 飞来, 熊 喜生. Her-2蛋白在胃癌中的表达及其临床意义. 世界华人消化杂志. 2010;18:1375-1379. [DOI] |
| 5. | Middleton LP, Price KM, Puig P, Heydon LJ, Tarco E, Sneige N, Barr K, Deavers MT. Implementation of American Society of Clinical Oncology/College of American Pathologists HER2 Guideline Recommendations in a tertiary care facility increases HER2 immunohistochemistry and fluorescence in situ hybridization concordance and decreases the number of inconclusive cases. Arch Pathol Lab Med. 2009;133:775-780. [PubMed] |
| 6. | Park DI, Yun JW, Park JH, Oh SJ, Kim HJ, Cho YK, Sohn CI, Jeon WK, Kim BI, Yoo CH. HER-2/neu amplification is an independent prognostic factor in gastric cancer. Dig Dis Sci. 2006;51:1371-1379. [PubMed] [DOI] |
| 8. | Luebke T, Baldus SE, Grass G, Bollschweiler E, Thiele J, Dienes HP, Hoelscher AH, Moenig SP. Histological grading in gastric cancer by Ming classification: correlation with histopathological subtypes, metastasis, and prognosis. World J Surg. 2005;29:1422-147; discussion 1428. [PubMed] |
| 9. | Gravalos C, Jimeno A. HER2 in gastric cancer: a new prognostic factor and a novel therapeutic target. Ann Oncol. 2008;19:1523-1529. [PubMed] [DOI] |
| 10. | Allgayer H, Babic R, Gruetzner KU, Tarabichi A, Schildberg FW, Heiss MM. c-erbB-2 is of independent prognostic relevance in gastric cancer and is associated with the expression of tumor-associated protease systems. J Clin Oncol. 2000;18:2201-2209. [PubMed] |
| 11. | Zhang XL, Yang YS, Xu DP, Qu JH, Guo MZ, Gong Y, Huang J. Comparative study on overexpression of HER2/neu and HER3 in gastric cancer. World J Surg. 2009;33:2112-2118. [PubMed] [DOI] |
| 12. | Jørgensen JT. Targeted HER2 treatment in advanced gastric cancer. Oncology. 2010;78:26-33. [PubMed] [DOI] |
| 14. | Matsui Y, Inomata M, Tojigamori M, Sonoda K, Shiraishi N, Kitano S. Suppression of tumor growth in human gastric cancer with HER2 overexpression by an anti-HER2 antibody in a murine model. Int J Oncol. 2005;27:681-685. [PubMed] |
| 16. | Yano T, Doi T, Ohtsu A, Boku N, Hashizume K, Nakanishi M, Ochiai A. Comparison of HER2 gene amplification assessed by fluorescence in situ hybridization and HER2 protein expression assessed by immunohistochemistry in gastric cancer. Oncol Rep. 2006;15:65-71. [PubMed] |
| 17. | Yaziji H, Goldstein LC, Barry TS, Werling R, Hwang H, Ellis GK, Gralow JR, Livingston RB, Gown AM. HER-2 testing in breast cancer using parallel tissue-based methods. JAMA. 2004;291:1972-1977. [PubMed] [DOI] |
| 18. | Egervari K, Szollosi Z, Nemes Z. Immunohistochemical antibodies in breast cancer HER2 diagnostics. A comparative immunohistochemical and fluorescence in situ hybridization study. Tumour Biol. 2008;29:18-27. [PubMed] [DOI] |