修回日期: 2011-08-25
接受日期: 2011-09-01
在线出版日期: 2011-09-08
目的: 检测肿瘤型M2丙酮酸激酶(M2-PK)与热休克蛋白90α(HSP90α)在胃癌患者血清中的表达水平, 并与癌胚抗原 (CEA)进行比较, 评估其临床应用价值.
方法: 收集胃癌患者和健康对照血清标本各80例, 检测血清中的M2-PK、HSP90α及CEA的含量.
结果: M2-PK、HSP90α和CEA在胃癌患者血清的表达水平均显著高于对照组(P<0.05). M2-PK的灵敏度为56.25%, 特异度为91.25%. HSP90α的灵敏度为52.50%, 特异度为92.50%. CEA灵敏度为45.00%, 特异度为92.50%. 与HSP90α和CEA相比, M2-PK灵敏度较高, 三者联合检测的灵敏度高达91.25%. 胃癌组间比较结果显示, M2-PK在病变大于5 cm、临床病理晚期、肿瘤浸润深度较深和存在淋巴结转移的情况表达水平较高, 有显著性差异(P<0.05). 此外, Spearman相关分析显示, M2-PK和HSP90α的在血清中的表达水平具有明显的相关性.
结论: M2-PK和HSP90α可以作为潜在的胃癌血清标志物, 且M2-PK和HSP90α可能存在较强的正相关关系, 可能对胃癌的诊断、治疗和预后具有较高的应用价值.
引文著录: 刘志刚, 宋永春, 孙瑞芳, 雷光焰. M2-PK和HSP90α在胃癌患者血清中的表达及意义. 世界华人消化杂志 2011; 19(25): 2673-2678
Revised: August 25, 2011
Accepted: September 1, 2011
Published online: September 8, 2011
AIM: To measure serum levels of tumor type M2 pyruvate kinase (M2-PK) and heat shock protein 90α (HSP90α) in patients with gastric cancer and to evaluate their clinical significance by comparing to serum carcinoembryonic antigen (CEA).
METHODS: A total of 80 patients with gastric cancer and 80 controls were enrolled in this study. Serum levels of M2-PK and HSP90α were measured by ELISA, while those of CEA were determined by radioimmunoassay.
RESULTS: Serum levels of M2-PK, HSP90α and CEA were significantly higher in patients with gastric cancer than in controls (all P < 0.05). The sensitivity and specificity of detection of M2-PK, HSP90α and CEA were 56.25% and 91.25%, 52.50% and 92.50%, and 45.00% and 92.50% respectively. Compared to detection of HSP90α and CEA alone, detection of M2-PK had a higher sensitivity. The sensitivity of combined detection of M2-PK, HSP90α and CEA was increased to 91.25%. Serum M2-PK was positively correlated with tumor size, TNM stage, invasion depth and lymph node metastasis (all P < 0.05). A significant positive correlation was noted between serum M2-PK and HSP90α levels in patients with gastric cancer.
CONCLUSION: Serum M2-PK and HSP90α can be used as potential markers for gastric cancer. There is a strong positive correlation between serum M2-PK and HSP90α levels in patients with gastric cancer.
- Citation: Liu ZG, Song YC, Sun RF, Lei GY. Clinical significance of serum levels of tumor type M2-pyruvate kinase and heat shock protein 90α in patients with gastric cancer. Shijie Huaren Xiaohua Zazhi 2011; 19(25): 2673-2678
- URL: https://www.wjgnet.com/1009-3079/full/v19/i25/2673.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i25.2673
蛋白质组学技术给临床肿瘤早期标志物的检测带来了划时代的革命. 本研究小组前期实验已利用基质辅助激光解析飞行时间质谱技术(matrix assisted laser desorption/ionization time of flight mass spectrometry, MALDI -TOF MS)检测到胃癌患者和健康对照血清中若干种差异表达的蛋白质/多肽[1], 并对其氨基酸序列进行了鉴定, 我们选择其中鉴定出的两个表达具有正相关的蛋白质-肿瘤型M2丙酮酸激酶(M2 pyruvate kinase, M2-PK)和热休克蛋白90α(heat shock protein 90α, HSP90α)作为本次研究对象. M2-PK是丙酮酸激酶的一种同工酶, 近年来在胰腺癌、肺癌及结直肠癌等恶性肿瘤标志物中的研究越来越多[2-4]. HSP90α是高度保守的"分子伴侣"家族成员, 具有促进肿瘤的增殖、抑制肿瘤细胞凋亡的作用[5], 已有研究发现HSP90α在胃癌组织中高表达, 而对其在胃癌患者血清中的表达研究较少. 目前研究表明, 二者的表达均分别与缺氧诱导因子-1(hypoxia inducible factor-1, HIF-1)有关[6-8]. 因此, 本研究检测M2-PK和HSP90α在胃癌患者血清中的表达情况, 验证前期实验所鉴定的血清差异蛋白结果的可靠性; 进一步检验二者的相关性; 与CEA作比较, 并评估二者是否可以共同作为胃癌的血清标志物, 为胃癌的早期诊断、治疗及预后判断提供依据.
病例组选取胃癌患者80例, 来自西安交通大学第一附属医院肿瘤外科(2009-10/2010-05), 所有病例均无放化疗史, 其中男42例, 女38例, 年龄33-81(平均59.15±9.8)岁. 所有患者均经影像学、胃镜和手术确诊. 有无淋巴结转移以手术所见和临床病理学结果为主要依据, 部分晚期胃癌患者无手术指征者参考临床表现和影像学检查确定. TNM分期(以美国癌症联合委员会AJCC第六版为标准): Ⅰ期3例, Ⅱ期22例, Ⅲ期40例, Ⅳ期15例. 有淋巴结转移51例, 无淋巴结转移29例. 对照组80例, 选取经体检排除胃癌病史的正常健康人(肝功能等各项指标均正常, 无胃肠道及其他疾病), 男40例, 女40例, 年龄34-77(平均57.98±7.8岁). 病例组及对照组所有个体均知情同意.
1.2.1 样本收集: 所有研究对象均术前空腹静脉采血3 mL, 乙二胺四乙酸(EDTA)抗凝, 混匀, 3 000 r/min 4 ℃离心10 min, 收集血清并保存于-80 ℃冰箱待测.
1.2.2 M2-PK和HSP90α测定: 采用双抗体夹心酶联免疫吸附试验(ELISA)法检测血清M2-PK和HSP90α, 试剂盒均购于上海亚培生物科技有限公司分装(原产地以色列), 严格按照试剂盒说明书操作, 在Triturus全自动酶免疫测定仪上进行测定. CEA采用常规放射性免疫法检测, 试剂盒由北方免疫试剂研究所提供, 操作按说明书, CEA≥15 μg/L为阳性阈值.
统计学处理 使用SPSS13.0进行统计学处理, 一般计量资料数据描述采用mean±SD表示, 满足正态和方差齐性的计量资料进行两独立样本均数t检验; 采用Spearman方法进行相关分析; 多组间比较采用单因素方差分析(One-way ANOVA). P<0.05表示差异有统计学意义.
2.1.1 M2-PK、HSP90α和CEA在胃癌患者及健康对照血清中表达水平的比较: 胃癌组M2-PK、HSP90α和CEA的表达水平均显著高于对照组(P<0.05, 表1).
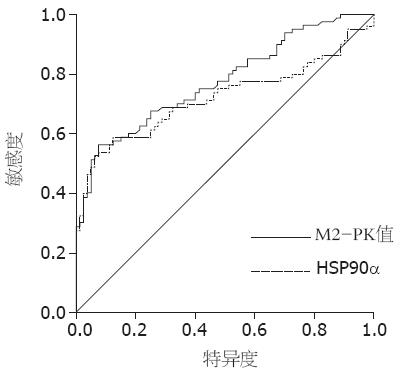
2.1.2 M2-PK、HSP90α和CEA单项及联合检测在胃癌诊断中的价值: M2-PK和HSP90α的表达水平在大多数胃癌患者中有明显上调趋势, 为了将胃癌组和对照组更好地加以区分, 利用ROC曲线划定了M2-PK和HSP90α的最佳临界值(cut-off point), 当M2-PK的最佳临界值(A值)为16.34时, 灵敏度为56.25%, 特异度为91.25%, 曲线下面积(AUC)为0.775; 当HSP90α的最佳临界值(A值)为154.68时, 灵敏度为52.50%, 特异度为92.50%, 曲线下面积(AUC)为0.720(图1, 表2). 进一步与CEA比较显示, 胃癌患者M2-PK、HSP90α和CEA阳性检出率均高于对照组, 差异有显著性(P<0.05, 表3). 联合检测几个标志物的特异度与单项检测相比差异无显著性(P>0.05), 而灵敏度显著提高(P<0.05). 与HSP90α和CEA相比, M2-PK对胃癌阳性检出率最高, 相应的, 灵敏度也最高(56.25%). 多个指标联合检测显示, M2-PK和CEA联合灵敏度为87.50%, HSP90α和CEA联合灵敏度为85.00%, M2-PK和HSP90α联合灵敏度为70.00%, 远远高于三个指标单项检测的灵敏度值, 而三者联合检测的灵敏度更是高达91.25%.
| 曲线下面积(AUC) | CUT-OFF | 标准误 | 95%CI | ||
| 上限 | 下限 | ||||
| M2-PK | 0.775 | 16.34 | 0.037 | 0.703 | 0.847 |
| HSP90α | 0.720 | 154.68 | 0.042 | 0.637 | 0.803 |
| M2-PK | HSP90α | CEA | M2-PK/CEA | HSP90α/CEA | M2-PK/HSP90α | 三项联合 | |
| 胃癌组阳性率 | 56.25 | 52.50 | 45.00 | 87.50 | 85.00 | 70.00 | 91.20 |
| 对照组阳性率 | 8.75 | 7.50 | 7.50 | 16.25 | 12.50 | 16.25 | 23.75 |
| 灵敏度 | 56.25 | 52.50 | 45.00 | 87.50 | 85.00 | 70.00 | 91.25 |
| 特异度 | 91.25 | 92.50 | 92.50 | 83.75 | 87.50 | 83.75 | 76.25 |
2.1.3 M2-PK、HSP90α和CEA的血清水平与胃癌临床病理特征的关系: M2-PK的表达水平在病变≥5 cm组显著高于病变<5 cm组(P<0.05); 病理分期为Ⅲ期和Ⅳ期的表达水平显著高于Ⅰ期和Ⅱ期(P<0.05); 存在淋巴结转移的表达水平均显著高于无淋巴结转移的病例(P<0.05), 根据肿瘤胃癌浸润的不同深度, 发现随着病变累及黏膜及黏膜下层、肌层、浆膜层及邻近器官, 其M2-PK的血清表达水平逐渐升高(P<0.05). HSP90α和CEA的表达水平在不同的临床分型间没有显著性差异(P>0.05, 表4).
| 项目 | 临床病理学参数 | n | M2-PK(IU/mL) | HSP90α(pg/mL) | EA(ng/mL) |
| 年龄 | ≥60 | 45 | 25.66±16.10 | 170.13±73.13 | 19.69±9.25 |
| <60 | 35 | 21.29±12.77 | 151.74±75.63 | 17.36±7.98 | |
| 性别 | 男 | 42 | 26.48±15.28 | 168.76±77.46 | 17.49±8.02 |
| 女 | 38 | 20.74±13.86 | 154.73±71.01 | 19.36±10.98 | |
| 组织学分级 | 高分化 | 28 | 23.18±14.30 | 165.93±80.69 | 18.52±9.34 |
| 中分化 | 32 | 24.85±15.34 | 158.88±74.14 | 17.28±8.66 | |
| 低或未分化 | 20 | 22.82±15.31 | 161.87±68.65 | 19.94±8.52 | |
| 病变大小 | <5 cm | 48 | 20.21±13.44 | 156.71±75.24 | 16.50±7.26 |
| ≥5 cm | 32 | 29.08±15.39a | 170.16±73.38 | 19.40±8.98 | |
| 病理分期 | Ⅰ期, Ⅱ期 | 25 | 15.68±9.10 | 138.48±61.93 | 16.95±7.86 |
| Ⅲ期, Ⅳ期 | 55 | 27.42±15.50a | 172.83±77.48 | 19.03±8.98 | |
| 浸润深度 | 黏膜及黏膜下 | 9 | 12.24±4.89 | 146.26±66.22 | 16.50±7.33 |
| 肌层 | 24 | 18.10±12.02 | 151.88±77.16 | 15.69±6.56 | |
| 浆膜及浆膜外 | 47 | 28.85±15.21a | 170.34±74.67 | 19.63±8.78 | |
| 淋巴结转移 | 有 | 51 | 26.94±15.99a | 170.63±73.51 | 17.90±11.58 |
| 无 | 29 | 18.16±10.57 | 147.08±74.64 | 19.22±10.66 |
对80例胃癌配对标本进行比较分析, 其中, 38.75%(31/80)的胃癌M2-PK及HSP90α均为阳性, 30.00%(24/80)的胃癌M2-PK及HSP90α均为阴性, 17.50%(14/80)的胃癌M2-PK阳性但HSP90α阴性, 13.75%(11/80)的胃癌M2-PK阴性但HSP90α阳性, M2-PK及HSP90α表达呈正相关(P<0.05). Spearman相关分析结果显示, M2-PK和HSP90α的表达水平在胃癌组具有明显的相关性, 其相关系数为0.501(P<0.001).
近年来, 肿瘤血清标志物的研究越来越被重视, 灵敏性和特异性较高的肿瘤标志物对肿瘤的诊断、随访及预后评估起到重要作用. 蛋白组学的出现为血清标志物的筛选带来了划时代的革命, 采用质谱技术寻找血清标志物是目前蛋白组学研究领域最常用的方法. 本次研究所选M2-PK和HSP90α即为前期蛋白组学鉴定出在胃癌组显著增高的两个蛋白.
M2-PK是丙酮酸激酶的一种同工酶, 在正常细胞中, M2-PK主要以四聚体形式存在, 而在肿瘤中, M2-PK大量表达并主要以二聚体形式存在, 故又称为肿瘤型丙酮酸激酶(Tu M2-PK)[10]. M2-PK在核酸合成代谢活跃的细胞中起重要作用, 如胚胎细胞、成人干细胞、特别是肿瘤细胞[11]. M2-PK在肿瘤细胞的糖代谢及生长起到至关重要的作用[12], 是糖酵解代谢和细胞增殖分化凋亡的调节因子[13]. 近年来在胰腺癌、肺癌及结直肠癌等恶性肿瘤标志物中的研究越来越多[2-4].
热休克蛋白(heat shock proteins, HSPs)是高度保守的"分子伴侣"家族, 已有研究证明[15,16], 在许多肿瘤细胞(如乳腺癌、肺癌、卵巢癌、神经母细胞瘤、前列腺癌等)中HSP呈高水平的表达. HSP90是HSP家族中最活跃的分子伴侣蛋白之一, 在肿瘤组织中, 突变或异常蛋白的存在刺激了HSP90的表达, 这种持续高表达以HSP90α为主, 可以达到正常水平的2-10倍. 研究认为肿瘤细胞尤其依赖于HSP90α生存于氧含量低、营养缺乏的微环境[17], HSP90α参与低氧诱导因子的信号传导通路[18]. 目前以HSP90α作为靶点的肿瘤干预研究越来越受到重视[19].
胃癌大多数起病隐匿, 有时不易确诊, 因而探寻胃癌相关的肿瘤标志物也一直是临床研究的热点. Kumar等[20]对M2-PK与其他标志物对胃肠道肿瘤的诊断进行Meta分析发现, M2-PK对胃癌、结直肠癌诊断的敏感性高于传统的肿瘤标志物. 又有研究发现, 联合检测多种标志物可以提高诊断的敏感性[21], M2-PK对结直肠癌、胃癌的敏感性分别为48%、61%, M2-PK联合CEA检测结直肠癌敏感性提高到63%; M2-PK联合CA72-4检测胃癌敏感性提高到81%, 但是M2-PK联合两种以上肿瘤标志物对提高诊断的敏感性有限. 本研究选取经病理证实的胃癌患者, 观察其血清中M2-PK和HSP90α的水平在胃癌患者和健康对照的差异, 并与CEA比较. 我们的结果显示, M2-PK和HSP90α的灵敏度均高于CEA. 鉴于迄今尚无高灵敏度和特异度的单一肿瘤标志物以筛查胃癌, 本研究同时测定了胃肠道常用的肿瘤标志物CEA, 联合检测M2-PK、HSP90α和CEA结果显示灵敏度大大提高, 达91.25%, 提示我们在临床应用中可以联合三者做胃癌的早期诊断. 进一步分析M2-PK、HSP90α和CEA的血清表达情况与胃癌临床病理特征的关系发现, M2-PK的表达水平与病变大小, 临床病理分期、有无淋巴结转移和浸润深度的不同有关系, 与谢峰等的研究结果类似[22]. 这说明, 肿瘤较大者, 病理分期较晚, 且浸润深度较深的肿瘤, 随着肿瘤的进展, 大量肿瘤细胞坏死后或者转移过程中继发释放出大量的肿瘤型M2-PK, 导致其在血清中的浓度逐步增加, 说明M2-PK表达水平可以间接反映肿瘤的大小和分期. 对于HSP90α在肿瘤组织中的研究较多, 作为血清标志物的研究, 目前开展甚少, 黄凌云等[23]研究发现, HSP90α能区分肺癌及良性肺病患者和健康人, 其敏感性为0.817, 特异性为0.919. 而在胃癌中的研究, 目前尚未见报道. 本次研究发现HSP90α对胃癌的灵敏度为52.50%, 特异度为92.50%, 是否能成为胃癌早期诊断、治疗及预后判断的标志物, 后期尚需进一步研究.
关于M2-PK和HSP90α之间是否存在相关性的研究, 尽管二者的表达均分别与HIF-1有关[6-8], 然而其具体相互作用机制尚未阐明. 本研究发现, M2-PK和HSP90α的表达存在正相关, 可能为偶然因素所得, 也可能二者的确存在着一定的相互作用关系, 这将为进一步揭示二者与HIF-1的相互作用提供依据. 后期尚需扩大样本量做验证, 并采用免疫共沉淀等方法将二者之间的关系做进一步的研究.
总之, 本研究结果显示, M2-PK和HSP90α可以作为潜在的胃癌血清标志物, 联合检测M2-PK、HSP90α和CEA将大大提高胃癌诊断的灵敏度. 基于M2-PK的表达与病变大小、肿瘤分期的关系, 提示今后有可能将M2-PK作为临床诊断和监测胃癌发生、发展, 指导治疗、判断预后的标志物. 后期我们需要进一步在体内研究M2-PK和HSP90α之间的相互关系, 探讨二者共同作为胃癌的标志物, 从而指导临床的诊断、治疗和预后.
蛋白质组学技术给临床肿瘤早期标志物的检测带来了划时代的革命. 本研究小组前期实验已利用基质辅助激光解析飞行时间质谱技术(MALDI -TOF MS)检测到胃癌患者和健康对照血清中若干种差异表达的蛋白质/多肽, 并对其氨基酸序列进行了鉴定, 我们选择其中鉴定出的两个表达具有正相关的蛋白质-肿瘤型M2丙酮酸激酶(M2-PK)和热休克蛋白90α(HSP90α)作为本次研究对象.
曹秀峰, 教授, 南京医科大学附属南京第一医院肿瘤中心
近年来, 肿瘤血清标志物的研究越来越被重视, 灵敏性和特异性较高的肿瘤标志物对肿瘤的诊断、随访及预后评估起到重要作用.
Kumar等对M2-PK与其他标志物对胃肠道肿瘤的诊断进行Meta分析发现, M2-PK对胃癌、结直肠癌诊断的敏感性高于传统的肿瘤标志物.
本研究设计较为严谨, 具备一定连续性、完整性, 数据可信.
编辑: 曹丽鸥 电编:何基才
| 1. | Serum peptidome profiling in patients with gastric cancer. Clin Exp Med. 2011; Epub ahead of print. [PubMed] |
| 2. | Joergensen MT, Heegaard NH, Schaffalitzky de Muckadell OB. Comparison of plasma Tu-M2-PK and CA19-9 in pancreatic cancer. Pancreas. 2010;39:243-247. [PubMed] [DOI] |
| 5. | Jäättelä M. Escaping cell death: survival proteins in cancer. Exp Cell Res. 1999;248:30-43. [PubMed] [DOI] |
| 6. | Gordan JD, Thompson CB, Simon MC. HIF and c-Myc: sibling rivals for control of cancer cell metabolism and proliferation. Cancer Cell. 2007;12:108-113. [PubMed] [DOI] |
| 7. | Trisciuoglio D, Gabellini C, Desideri M, Ziparo E, Zupi G, Del Bufalo D. Bcl-2 regulates HIF-1alpha protein stabilization in hypoxic melanoma cells via the molecular chaperone HSP90. PLoS One. 2010;5:e11772. [PubMed] [DOI] |
| 8. | Luo W, Hu H, Chang R, Zhong J, Knabel M, O'Meally R, Cole RN, Pandey A, Semenza GL. Pyruvate kinase M2 is a PHD3-stimulated coactivator for hypoxia-inducible factor 1. Cell. 2011;145:732-744. [PubMed] [DOI] |
| 9. | Marrelli D, Roviello F, De Stefano A, Farnetani M, Garosi L, Messano A, Pinto E. Prognostic significance of CEA, CA 199 and CA 72-4 preoperative serum levels in gastric carcinoma. Oncology. 1999;57:55-62. [PubMed] [DOI] |
| 10. | Mazurek S. Pyruvate kinase type M2: a key regulator within the tumour metabolome and a tool for metabolic profiling of tumours. Ernst Schering Found Symp Proc. 2007;4:99-124. [PubMed] |
| 11. | Mazurek S, Szostak R. Quantitative determination of diclofenac sodium in solid dosage forms by FT-Raman spectroscopy. J Pharm Biomed Anal. 2008;48:814-821. [PubMed] [DOI] |
| 12. | Christofk HR, Vander Heiden MG, Harris MH, Ramanathan A, Gerszten RE, Wei R, Fleming MD, Schreiber SL, Cantley LC. The M2 splice isoform of pyruvate kinase is important for cancer metabolism and tumour growth. Nature. 2008;452:230-233. [PubMed] [DOI] |
| 13. | Spoden GA, Rostek U, Lechner S, Mitterberger M, Mazurek S, Zwerschke W. Pyruvate kinase isoenzyme M2 is a glycolytic sensor differentially regulating cell proliferation, cell size and apoptotic cell death dependent on glucose supply. Exp Cell Res. 2009;315:2765-2774. [PubMed] [DOI] |
| 14. | Didelot C, Schmitt E, Brunet M, Maingret L, Parcellier A, Garrido C. Heat shock proteins: endogenous modulators of apoptotic cell death. Handb Exp Pharmacol. 2006;172:171-198. [PubMed] [DOI] |
| 15. | Kang GH, Lee EJ, Jang KT, Kim KM, Park CK, Lee CS, Kang DY, Lee SH, Sohn TS, Kim S. Expression of HSP90 in gastrointestinal stromal tumours and mesenchymal tumours. Histopathology. 2010;56:694-701. [PubMed] [DOI] |
| 16. | Zagouri F, Sergentanis TN, Provatopoulou X, Kalogera E, Chrysikos D, Lymperi M, Papadimitriou CA, Zografos E, Bletsa G, Kalles VS. Serum levels of HSP90 in the continuum of breast ductal and lobular lesions. In Vivo. 2011;25:669-672. [PubMed] |
| 17. | Jolly C, Morimoto RI. Role of the heat shock response and molecular chaperones in oncogenesis and cell death. J Natl Cancer Inst. 2000;92:1564-1572. [PubMed] [DOI] |
| 18. | Xiong L, Zhao T, Huang X, Liu ZH, Zhao H, Li MM, Wu LY, Shu HB, Zhu LL, Fan M. Heat shock protein 90 is involved in regulation of hypoxia-driven proliferation of embryonic neural stem/progenitor cells. Cell Stress Chaperones. 2009;14:183-192. [PubMed] [DOI] |
| 19. | Patterson J, Palombella VJ, Fritz C, Normant E. IPI-504, a novel and soluble HSP-90 inhibitor, blocks the unfolded protein response in multiple myeloma cells. Cancer Chemother Pharmacol. 2008;61:923-932. [PubMed] [DOI] |
| 20. | Kumar Y, Tapuria N, Kirmani N, Davidson BR. Tumour M2-pyruvate kinase: a gastrointestinal cancer marker. Eur J Gastroenterol Hepatol. 2007;19:265-276. [PubMed] [DOI] |
| 21. | Schneider J, Bitterlich N, Schulze G. Improved sensitivity in the diagnosis of gastro-intestinal tumors by fuzzy logic-based tumor marker profiles including the tumor M2-PK. Anticancer Res. 2005;25:1507-1515. [PubMed] |