修回日期: 2011-06-21
接受日期: 2011-06-28
在线出版日期: 2011-09-08
目的: 探讨金黄益胆颗粒(jinhuangyidan granules)对大鼠重症急性胰腺炎肝损伤的保护作用和可能机制.
方法: 54只♂SD大鼠随机分为假手术组(sham operation group, SO)、重症急性胰腺炎组(severe acute pancreatitis, SAP)和金黄益胆颗粒治疗组(jinhuangyidan granules treatment, JHT), 每组分为2、6、12 h三个时间点组, 每个时间点组6只.5%的牛黄胆酸钠逆行胰胆管注射制备SAP模型. 各组于造模后2、6、12 h处死大鼠, 检测血清淀粉酶(serum amylase, AMY)、谷丙转氨酶(ALT)、谷草转氨酶(AST), 计算肝脏系数, HE染色观察胰腺、肝脏组织病理, 酶联免疫吸附试验(ELISA)方法检测TNF-α、IL-6、ET-1水平.免疫组化检测肝脏组织中核转录因子-κB的活性.
结果: 各时间带点SAP组与SO组比较, AMY、ALT、AST、TNF-α、IL-6、ET-1均升高, 肝脏系数在6 h、12 h差异有统计学意义(P<0.05); 在6 h、12 h JHT组与SAP组比较, AMY、肝脏系数、ALT、AST、TNF-α、IL-6、ET-1指标均明显降低(P<0.05). 6 h时间点SO组、SAP组和JHT组NF-κB表达分别为(5.32±0.24 vs 49.89±3.53 vs 19.18±1.51), 三组之间差异有统计学意义(P<0.05); 12 h时间点各组之间NF-κB表达分别为(6.38±0.24 vs 54.73±1.68 vs 31.15±2.25), 三组之间差异有统计学意义(P<0.05). 胰腺和肝脏的病理镜下观察水肿和炎性介质表达JHT组较SAP组明显改善.
结论: 金黄益胆颗粒可以一定程度的改善大鼠重症胰腺炎肝脏的损伤, 改善微循环, 其对大鼠重症急性胰腺炎肝损伤的保护作用机制可能与抑制NF-κB的活性进而下调TNF-α、IL-6的表达有关.
引文著录: 赵立新, 马向明, 曹立瀛, 刘四清, 付庆江, 张青松. 金黄益胆颗粒对大鼠重症急性胰腺炎肝损伤的保护作用. 世界华人消化杂志 2011; 19(25): 2654-2659
Revised: June 21, 2011
Accepted: June 28, 2011
Published online: September 8, 2011
AIM: To investigate the protective effect of Jinhuangyidan Granules on liver injury in rats with severe acute pancreatitis (SAP) and to explore the possible mechanisms involved.
METHODS: Fifty-four male Sprague-Dawley (SD) rats were randomly divided into three groups: sham operation group, SAP group and Jinhuangyidan Granules group. Each group was further divided into three subgroups for testing at different time points after treatment (2, 6 and 12 h). SAP was induced by retrograde injection of 5% sodium taurocholate into the biliary pancreatic duct. Serum amylase (AMY), ALT, AST and the liver coefficient were measured. The levels of TNF-α, IL-6 and ET-1 were examined by ELISA, and the expression of NF-κB in the liver was evaluated by immunohistochemistry.
RESULTS: Compared to the sham operation group, the levels of AMY, ALT, AST, TNF-α, IL-6, ET-1 and NF-κB increased significantly in the SAP group. The liver coefficient also differed significantly between the sham operation group and SAP group at 6 and 12 h (both P < 0.05). Compared to the SAP group at 6 and 12 h, the levels of AMY, ALT, AST, TNF-α, IL-6, ET-1 and NF-κB decreased significantly in the Jinhuangyidan Granules group (all P < 0.05). At 6 h, the expression of liver NF-κB was significantly higher in the SAP group than in the sham operation group at 6 and 12 h (6 h: 49.89 ± 3.53 vs 5.32 ± 0.24; 12 h: 54.73 ± 1.68 vs 6.38 ± 0.24, both P < 0.05), but was significantly lower in the Jinhuangyidan Granules group than in the SAP group (6 h: 19.18 ± 1.51 vs 49.89 ± 3.53; 31.15 ± 2.25 vs 54.73 ± 1.68, both P < 0.05). Compared to the SAP group, the levels of edema and inflammatory mediators ameliorated significantly in the Jinhuangyidan Granules group.
CONCLUSION: Jinhuangyidan Granules ameliorates liver injury and improve microcirculation in SAP rats possibly by inhibiting NF-κB activity and down-regulating inflammatory mediators.
- Citation: Zhao LX, Ma XM, Cao LY, Liu SQ, Fu QJ, Zhang QS. Protective effect of Jinhuangyidan Granules on liver injury in rats with severe acute pancreatitis. Shijie Huaren Xiaohua Zazhi 2011; 19(25): 2654-2659
- URL: https://www.wjgnet.com/1009-3079/full/v19/i25/2654.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i25.2654
重症急性胰腺炎(severe acute pancreatitis, SAP)起病急、发展快、病情重, 是一种累及多系统多器官的外科急腹症之一, 常常并发全身炎症反映综合征(systemic inflammatory response syndrome, SIRS)和多器官功能障碍综合征(multiple organ dysfunction syndrome, MODS), 死亡率达20%, 严重威胁着患者的生命. 近年来有学者研究发现SAP并发肝损伤的发生率达89%[1], 肝损伤时其调节微循环及清除炎性物质及毒素的能力下降, 加重了炎症反映对全身其他脏器的损害, 从而影响了疾病的临床治疗效果和病情预后[2]. 因此, 防治SAP时的肝损伤对疾病的治疗很重要. 关于SAP导致肝损伤的机制还不清楚, 本实验通过建立大鼠重症急性胰腺炎模型, 应用金黄益胆颗粒观察对大鼠SAP肝损伤的保护作用, 并探讨其可能机制.
清洁级♂SD(Sprague-Dawley)大鼠54只, 饲养8 wk, 室温维持在23 ℃±1 ℃, 定期紫外线消毒, 体质量为180-310 g, 购于北京华阜康生物科技股份有限公司[许可证号: SCXK(京)2009-0004]. 金黄益胆颗粒(冀药制字Z20051588)购自开滦总医院药剂科, 由唐山太阳石药业有限责任公司生产; 牛黄胆酸钠购自Sigma公司; NF-κB p65单克隆抗体、SP免疫组织化学试剂盒购自北京博奥森生物技术有限公司; TNF-α、IL-6和ET-1 ELISA试剂盒均购自北京博奥森生物技术有限公司; WZS-50F6型微量泵购自浙大医疗有限公司.
1.2.1 实验分组: 适应性饲养1 wk后, 大鼠按完全随机法分SO组、SAP组和JHT组, 每组分为2、6、12 h 三个时间点组, 每个时间点组6只.
1.2.2 模型的制备和标本的检测: 采用改良式的 Aho法[3], 拉细硬膜外导管经十二指肠乳头逆行经电子微量泵注入5%牛磺胆酸钠(1 mL/kg, 0.1 mL/min)制作SAP模型, 经空场上段营养管注入生理盐水(10 mL/kg), 此后1次/6 h; JHT组在SAP造模成功后由空肠营养管注入25%金黄益胆颗粒溶液(10 mL/kg), 此后1次/6 h; SO组大鼠打开腹腔找到胰腺组织后翻动数次后关腹. 各组大鼠试验中均禁食水, 皮下注射生理盐水20 mL/kg, 1次/6 h. 各组对应的时间点处死大鼠, 收集腹水, 腹主动脉取血4 mL, 检测AMY、ALT和AST, ELISA 法进行TNF-α和IL-6、ET-1的测定. 实验中由同一人剪取各组相同部位的胰腺和肝脏组织1 cm×1 cm×0.5 cm大小, 生理盐水冲洗表面残余血迹, 清洁滤纸吸干水分后, 电子天平称量肝脏湿质量, 计算肝脏系数(W/G×100%), 4%的多聚甲醛溶液固定组织, 修剪、石蜡包埋、切片, HE染色和免疫组化. 由实验室专业病理人员观察胰腺和肝脏的病理改变, 按照Schmid标准[4]进行病理评分.
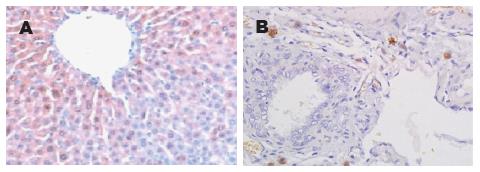
1.2.3 SP免疫组织化学检测NF-κB的表达: 常规免疫组化法(immunohistochemical, IHC)检测肝脏的NF-κB活性. 组织生理盐水清洗后, 4%多聚甲醛固定常规脱水、石蜡包埋、制备3 μm的单层切片, SP法免疫染色, 一抗浓度为1∶300, 操作步骤完全按照试剂盒的说明来完成. 参照文献[5]方法, 用PBS代替一抗做空白对照. 结果判定: 阳性细胞为细胞核和(或)胞质呈棕黄色染色. 在高倍视野(10×40)下随机选取5个视野, 计算每个阳性细胞数取其均数代表该样本的阳性表达数N1, 总细胞数为N, 阳性率 = N1/N×100%.
统计学处理 计量资料采用mean±SD表示, 计数资料采用χ2检验, 应用SPSS13.0统计学软件包进行方差分析. 同时段组间比较采用t检验, 以P<0.05为差异有统计学意义.
实验造模成功后, SO组2、6、12 h三个时间点无一例死亡, 死亡率为0; SAP组12 h内死亡6只, 死亡率为33.33%(6/18), JHT组12 h内死亡2只, 死亡率为11.11%(2/18), 明显低于SAP组, 两组之间的χ2检验显示, 差异无统计学意义.
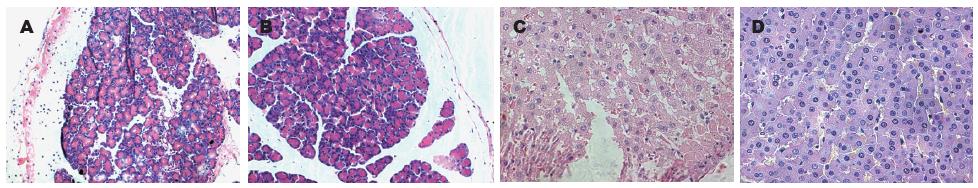
光镜下观察SO组各时间点肝脏和胰腺形态学结构没有明显变化. SAP组各时间点肝脏可见不同程度水肿及肝窦扩张, 肝细胞排列紊乱, 炎性细胞浸润, 部分肝实质可见点状或斑块状出血坏死; 胰腺组织可见不同程度的腺叶局限性水肿、出血, 部分结构坏死区, 组织间隙大量炎性细胞浸润. JHT组肝脏和胰腺组织的水肿、出血、坏死与炎细胞浸润程度较SAP组病变为轻(图1).
6、12 h同时间点SAP组和SO组比较, 肝脏系数有所升高, 差异有统计学意义; JHT组和SAP比较肝脏的系数降低, 差异有统计学意义(P<0.05, 表1).
在2、6、12 h同时间点, SAP组和JHT组腹水、AMY、ALT、AST水平较SO组有所升高(P<0.05). 三个时间点JHT组较SAP组比较ALT明显下降, 6、12 h时间点JHT组较SAP组AMY、AST明显降低(P<0.05, 表2).
| 分组 | 时间点 | 腹水(mL) | AMY(U/L) | ALT(U/L) | AST(U/L) |
| SO组 | 2 | 0.40±0.65 | 1536.67±274.01 | 31±4.89 | 120.33±21.65 |
| 6 | 0.42±0.67 | 1541.50±355.95 | 50.67±12.50 | 149.39±3.63 | |
| 12 | 0.38±0.60 | 1586.17±288.71 | 69.67±14.00 | 204.50±30.28 | |
| SAP组 | 2 | 4.17±0.68a | 3490.17±465.41a | 107.67±31.74ac | 249.33±66.88a |
| 6 | 6.85±0.70a | 4976.83±142.22ac | 151.83±43.65ac | 429.13±21.68ac | |
| 12 | 7.63±0.76ac | 5129.00±227.88ac | 218.83±20.59ac | 527.83±10.40ac | |
| JHT组 | 2 | 3.92±1.43a | 3401.50±703.16a | 71.67±6.77a | 211.50±49.32a |
| 6 | 5.92±1.36a | 4385.00±232.37a | 116.67±15.59a | 320.63±9.50a | |
| 12 | 5.35±1.38a | 4177.83±284.57a | 156.17±26.96a | 437.67±13.48a |
与SO组比较, SAP和JHT组各时间点血清TNF-α、IL-6、ET-1水平明显升高, 差异有统计学差异(P<0.05); 6、12 h JHT组与SAP组比较, TNF-α、IL-6、ET-1水平明显降低, 差异有统计学差异(P<0.05, 表3).
| 分组 | 时间点 | TNF-α(ng/L) | IL-6(ng/L) | ET-1(ng/L) |
| SO组 | 2 | 31.38±6.81 | 40.06±2.92 | 27.55±1.97 |
| 6 | 34.55±3.88 | 52.24±5.04 | 48.11±1.95 | |
| 12 | 46.10±5.07 | 62.18±4.94 | 56.10±1.54 | |
| SAP组 | 2 | 54.08±4.35a | 66.76±5.08a | 85.83±1.71ac |
| 6 | 72.88±4.97ac | 78.65±6.92ac | 124.42±5.35ac | |
| 12 | 97.60±11.38ac | 99.78±14.92ac | 180.60±5.42ac | |
| JHT组 | 2 | 50.82±5.68a | 63.21±4.92a | 61.71±3.23a |
| 6 | 60.36±6.07a | 65.4±2.42a | 110.81±6.90a | |
| 12 | 82.46±3.44a | 83.98±3.79a | 136.00±9.64a |
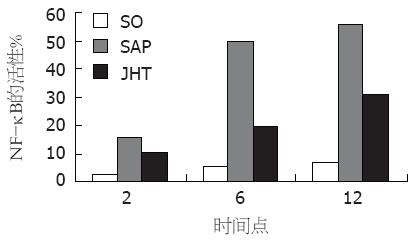
NF-κB在SO组少量表达. 在2、6、12 h同时间点, SAP组NF-κB的活性表达逐渐升高, 均明显高于SO组, 差异有统计学意义(P<0.05); JHT组NF-κB的活性表达均较SAP组显著下降, 但仍高于SO组[SO vs SAP vs JHT, 2 h: (2.20±0.27 vs 15.96±1.06 vs 10.17±0.54); 6 h: (5.32 ±0.24 vs 49.89±3.53 vs 19.18±1.51) , 12 h: (6.38±0.24 vs 54.73±1.68 vs 31.15±2.25), P<0.05, 图2, 3].
近年有研究发现SAP的高死亡率与肝损伤有着密切的联系[6]. 肝脏作为调节物质代谢、参与凝血因子生成及解毒的主要器官, 在SAP的发生、发展中起着重要的作用. SAP时由于其特殊复杂的生理功能变化及电解质紊乱使肝脏成为SAP时胰外器官病理损害较早的器官之一, 同时也成为其病理机制研究的重要器官之一. 目前, 众多学者对SAP的发病机制已经不局限于单一的肺脏和肾脏研究, SAP合并肝损伤已成为研究的新方向. 肝损伤的机制探讨取得了一定进展, 炎性介质起到了不可忽视的作用. 邹树等[7]报道炎性细胞因子TNF-α和IL-6在SAP的发病过程中起着重要作用, 与早期肝脏损伤有着密切关系. 因此, SAP早期保护肝损伤有着重要的意义.
SAP模型制备成功后会导致大鼠在相应处死时间点之前死亡.本实验过程中, 12 h内SO组、SAP组和JHT组死亡率分别为0、33.33%和为11.11%, 虽然JHT组的死亡率在百分率上低于SAP组, 但两组之间的进行χ2检验, 差异无统计学意义. 笔者考虑到样本量较小, 以后应加大样本量进一步观察JHT组和SAP组在死亡率方面的差异性.
本实验采用清洁SD大鼠, 用拉细的硬膜外导管经十二指肠乳头逆行穿入胰胆管电子微量泵恒速注射5%牛黄胆酸钠建立SAP模型. SAP组随着时间的延长肝脏系数逐渐升高, 说明随着SAP病情的发展, 炎性因子和毒素作用于肝脏组织, 使肝脏中央静脉及毛细血管扩张, 毛细血管淤血加剧; 6、12 h时间点, JHT组与SAP组比较, 肝脏系数有所降低, 且有统计学意义(P<0.05), 说明金黄益胆颗粒可以降低SAP早期肝脏系数, 减少组织水肿和渗漏. 在病理形态学上, JHT组肝脏和胰腺组织的水肿、出血、炎细胞浸润程度较SAP组病变明显减轻. 许多研究表明TNF-α、IL-6参与了SAP诸多器官损伤的过程, 是炎性细胞的代表因子. 各时间点SAP组与SO组比较, ALT、AST、TNF-α、IL-6均明显升高, 说明SAP时早期肝脏已受到损伤, 与邹树等报道一致. 本实验证实, 6 h和12 h 时间点JHT组与SAP组比较TNF-α、IL-6的水平明显降低, 说明金黄益胆颗粒在改善SAP早期肝脏损伤起着一定的保护作用.
内皮素(endothelin, ET)是由内皮素前体原(prepro ET)水解而成的、由21个氨基酸组成的多肽. 血液中的ET主要为ET-1. ET-1是强烈的缩血管物质, 参与了SAP微循环障碍的发生, 其作用机制包括血管收缩、缺血-再灌注损伤、毛细血管通透性增加、血液流变学改变、影响白细胞-内皮细胞相互作用等多个方面, 对微循环起着重要的作用. 研究发现在急性胰腺炎早期就存在胰腺血液循环障碍, 缺血缺氧刺激内皮细胞前ET原基因表达, ET mRNA表达上调从而导致ET合成增加, 加重组织微循环障碍[8]. 研究表明, 活血化淤的中药制剂可以改善急性胰腺炎动物模型血清ET-1浓度, 降低组织的损伤程度[9]. 本研究表明, SAP组和JHT组ET-1水平在2、6、12 h较SO组明显为高, JHT组较SAP组显著降低, 病理镜下可见肝脏和胰腺组织的水肿程度和红细胞渗漏均减少, 说明金黄益胆颗粒可以减缓血管收缩, 缓解组织缺氧和代谢障碍, 降低毛细血管渗漏, 从一定程度上改善了损伤组织的微循环障碍.
NF-κB是一种具有多向转录调节作用的蛋白, p50/p65异源二聚体是NF-κB活化的最常见形式. 当机体受到损伤及病原微生物入侵时, 血管及免疫系统迅速作出反应, NF-κB被激活, 然后进入细胞核, 与其靶基因上的启动子或增强子结合而调节基因转录, 激活与细胞应激相关的基因和炎症早期反应基因, 产生大量的包括TNF-α、IL-1等炎症因子.炎症介质在SAP发生、发展中起重要作用, 因此研究如何抑制NF-κB的活性, 减少促炎因子的表达, 从而减轻组织损伤和炎症反应以改善SAP的预后具有重要意义. 有报道证实, 通过阻断NF-κB的活化, 可以减轻急性胰腺炎的重型化[10]. 先前研究显示, 用N-乙酰半胱氨(N-acetylcysteine, NAC)抑制胰腺NF-κB活性, 能显著减少胰腺炎症细胞浸润, 降低TNF-α、IL-6等细胞因子基因表达[11]; 同时研究发现NAC能抑制肝脏NF-κB活性及iNOS mRNA 的表达, 降低ALT、AST的水平, 对肝损伤有一定的保护作用[12], 说明NF-κB在SAP发生与发展中发挥着及其重要作用. 本研究证实, SAP组NF-κB的活性表达高于SO组, JHT组NF-κB的活性表达较SAP组明显下降, 差异有统计学意义(P<0.05). 可见金黄益胆颗粒在SAP早期对肝脏NF-κB的活性表达有一定的抑制作用.
金黄益胆颗粒(原胆胰和胃冲剂)根据肝胆胰胃十二指肠疾病间的少阳之邪、阳明之实, 以大柴胡汤为基础, 由柴胡、大黄、黄连、黄芩、枳壳、香附、木香、郁金、金钱草、陈皮及元胡11味中药组方组成, 具有疏肝理气、通里攻下、清热利胆、健脾和胃、活血化瘀等综合功效[13]. 研究发现金黄益胆颗粒可以增强肠黏膜对氧自由基的清除能力, 提高肠黏膜的免疫力; 同时调控炎症介质的释放、降低肺毛细血管通透性, 对SAP早期小肠黏膜的损伤和肺损伤有保护作用[14,15]. 本实验显示, SAP时ALT、AST、TNF-α、IL-6、ET-1、NF-κB的活性表达均明显高于SO组(P<0.05), 在6、12 h JHT组上述指标均显著下降(P<0.05). ALT、AST、TNF-α、IL-6表达水平的下降表明金黄益胆颗粒可以一定程度改善SAP的肝脏损伤. ET-1在SAP组明显升高与肝脏损伤导致微循环障碍有关, 肝脏系数及ET-1降低表明金黄益胆颗粒可能改善了肝脏的微循环和毛细血管通透性.
总之, 金黄益胆颗粒可以一定程度的改善大鼠重症胰腺炎肝脏的损伤, 改善微循环, 其对大鼠重症急性胰腺炎肝损伤的保护作用机制可能与抑制NF-κB的活性进而下调TNF-α、IL-6的表达有关. 而关于金黄益胆颗粒抑制肝损伤的具体机制还有待于进一步研究.
感谢张秀平、张永健及华科雷同志在实验过程中给予的大力帮助和支持, 感谢肝胆外科和中西医肝胆科李英俊和王瑞霞护士长对实验的准备协助工作.
急性胰腺炎(AP)是一种发生在胰腺的急性炎症性疾病, 常累及胰腺周围组织, 其发病急, 病情发展迅猛, 多器官功能不全综合征(MODS)发生率高. 由于胰腺和肝脏在解剖位置、生理功能和血流动力学方面的联系, SAP时往往胰外首先累及肝脏, 引起肝损伤, 其损伤使Kupffer细胞激活, 肝脏释放大量的炎性介质, 又可加重SAP的病情, 形成恶性循环, 使MODS进一步加重, 导致SAP的高死亡率.
李胜, 研究员, 山东省肿瘤防治研究院肝胆外科; 崔云甫, 教授, 哈尔滨医科大学第二附属医院普外一科
目前急性胰腺炎的发病机制还不是很清楚, 死亡原因主要是发展到SAP时导致肝、肺、肾脏等器官受损, 合并了MODS, 死亡率在20%左右. 研究发现NF-κB的活性表达参与SAP的发生、发展过程, 其在SAP合并肝损伤时的变化情况是目前研究的热点.
Rakonczay等认为, 过度活化的NF-κB可促使炎性细胞释放大量炎性因子, 从而导致组织的炎性损伤; 阻止NF-κB 活化, 可明显减轻胰腺的炎症反应. Geisler等发现AP伴发的胰酶血症也参与了全身性炎症反应, 其中胰腺弹性蛋白酶随血流到胰外的肝脏, 可激活肝Kupffer细胞NF-κB信号途径, 增加炎性细胞因子的产生, 进而引起肝脏损伤. 刘石龙等研究发现N-乙酰半胱氨酸可以抑制NF-κB活性表达, 对SAP肝损伤有一定的保护作用.
以急性胰腺炎的发病机制及治疗的基础研究为前提, 根据少阳之邪、阳明之实组方自制中药"金黄益胆颗粒"对大鼠SAP合并肝损伤进行早期实验研究, 效果较可靠, 研究较新颖, 为中西医结合治疗提供了理论基础, 有一定的科学性和创新性.
目前, 单一的应用生长抑素等制剂已不能满足SAP的治疗及预后, 中西医结合治疗急性胰腺炎在临床上有着一定的应用前景.
本研究具有一定的科学性及创新性, 可读性强, 具有一定的临床参考价值.
编辑: 何基才 电编:何基才
| 2. | Zhang XP, Wang L, Zhang J. Study progress on mechanism of severe acute pancreatitis complicated with hepatic injury. J Zhejiang Univ Sci B. 2007;8:228-236. [PubMed] [DOI] |
| 3. | Aho HJ, Koskensalo SM, Nevalainen TJ. Experimental pancreatitis in the rat. Sodium taurocholate-induced acute haemorrhagic pancreatitis. Scand J Gastroenterol. 1980;15:411-416. [PubMed] [DOI] |
| 4. | Schmidt J, Rattner DW, Lewandrowski K, Compton CC, Mandavilli U, Knoefel WT, Warshaw AL. A better model of acute pancreatitis for evaluating therapy. Ann Surg. 1992;215:44-56. [PubMed] [DOI] |
| 5. | Zhao YF, Zhai WL, Zhang SJ, Chen XP. Protection effect of triptolide to liver injury in rats with severe acute pancreatitis. Hepatobiliary Pancreat Dis Int. 2005;4:604-608. [PubMed] |
| 6. | 李 国庆, 王 旺河, 张 超, 田 鹏, 张 辉, 王 志凯, 梁 鸿. 肿瘤坏死因子-α、Fas/FasL在急性胰腺炎肝细胞凋亡中的作用. 中华实验外科杂志. 2010;27:600-602. |
| 8. | Kourembanas S, Marsden PA, McQuillan LP, Faller DV. Hypoxia induces endothelin gene expression and secretion in cultured human endothelium. J Clin Invest. 1991;88:1054-1057. [PubMed] [DOI] |
| 9. | Jung WS, Chae YS, Kim DY, Seo SW, Park HJ, Bae GS, Kim TH, Oh HJ, Yun KJ, Park RK. Gardenia jasminoides protects against cerulein-induced acute pancreatitis. World J Gastroenterol. 2008;14:6188-6194. [PubMed] [DOI] |
| 10. | Hagiwara S, Iwasaka H, Hidaka S, Hasegawa A, Noguchi T. Neutrophil elastase inhibitor (sivelestat) reduces the levels of inflammatory mediators by inhibiting NF-kB. Inflamm Res. 2009;58:198-203. [PubMed] [DOI] |
| 11. | 邹 忠东, 张 再重, 宋 香全, 王 烈, 涂 小煌, 陈 少全, 王 瑜. N-乙酰半胱氨酸对重症急性胰腺炎大鼠肝损伤的保护作用. 世界华人消化杂志. 2008;16:3894-3899. [DOI] |
| 13. | 付 庆江, 马 向明, 陈 丽荣, 曹 立瀛, 屈 顺喜, 董 浩. 胆胰和胃冲剂预防急性胰腺炎重型化. 中国中西医结合外科杂志. 2011;17:239-241. |
| 14. | 曹 立瀛, 刘 四清, 王 保强, 李 勇, 郭 振武. 胆胰和胃冲剂对大鼠急性胰腺炎早期小肠黏膜抗氧化损伤的保护. 中国中西医结合外科杂志. 2002;8:150-152. |
| 15. | 曹 立瀛, 刘 四清, 李 勇, 王 保强, 王 东, 祁 刚, 赵 群, 郭 振武. 胆胰和胃冲剂对大鼠重症急性胰腺炎合并肺损伤的治疗作用. 中国中西医结合外科杂志. 2003;9:170-172. |