修回日期: 2011-08-26
接受日期: 2011-08-27
在线出版日期: 2011-08-28
目的: 探讨替比夫定抗病毒治疗对HBeAg阳性慢性乙型肝炎患者细胞免疫功能的影响与HBeAg阴转的相关性.
方法: 治疗组, 30例HBeAg阳性慢性乙型肝炎患者应用替比夫定抗病毒治疗48 wk, 30例健康体检者为对照组. 在治疗前、治疗后12、24、48 wk, 对外周血DCs进行体外培养, 流式细胞仪检测分析DC表面分子及淋巴细胞亚群水平.
结果: 30例患者抗病毒治疗48 wk, 26例HBVDNA阴转(86.7% HBV DNA<500 copies/mL), 有8例发生HBeAg阴转(26.7%). 与治疗前比较, 治疗12 wk时DCs表面分子CD1a、CD40、CD83、CD86、MHC-D的表达无明显变化; 治疗24、48 wk时上调, 与治疗前相比较有显著性差异(P<0.05), 但均低于健康对照组. 淋巴细胞亚群12 wk时无明显变化; 治疗24、48 wk时, CD4+及CD4+/CD8+比值明显提高, 与治疗前比较有显著性差异(P<0.05); CD3+T、CD8+ T和CD19+ B细胞未见明显改变. 48 wk时, HBeAg阴转患者与HBeAg未阴转患者比较, DCs表面分子CD1a、CD40、CD86, MHC-DR的表达, CD4+水平及CD4+/CD8+比值均明显升高(P<0.01).
结论: 替比夫定抗病毒治疗慢性乙型肝炎患者细胞免疫功能增强, 提示替比夫定在抑制HBV DNA复制的同时, 可能通过调节DCs和淋巴细胞亚群的功能, 增强细胞免疫应答, 提高HBeAg阴转率.
引文著录: 朱斌, 张平, 禹萌, 王天宝, 毛乾国. 替比夫定对HBeAg+慢性乙型肝炎患者外周血树突状细胞及淋巴细胞亚群的影响. 世界华人消化杂志 2011; 19(24): 2577-2582
Revised: August 26, 2011
Accepted: August 27, 2011
Published online: August 28, 2011
AIM: To investigate the association of HBeAg negative conversion with the effect of cellular immunity in patients with HBeAg-positive chronic hepatitis B (CHB) after telbivudine treatment.
METHODS: Thirty HBeAg-positive chronic hepatitis B patients were treated with telbivudine (LDT) for 48 wk, and thirty healthy people were used as controls. DCs were isolated from peripheral blood and cultured in vitro before treatment, 12, 24, and 48 wk after treatment. Subsequently, surface molecular markers on DCs and lymphocyte subsets were detected and quantified by flow cytometry.
RESULTS: Of 30 patients undergoing telbivudine therapy for 48 wk, 26 (86.7%) had HBV DNA negative conversion (HBV DNA < 500 copies/mL), and 9 (26.7%) had HBeAg negative conversion. The expression of surface molecular markers CD1a, CD40, CD83, and CD86 was not changed at 12 wk, but were up-regulated at 24 and 48 wk compared to pretherapy levels. However, the expression levels of these markers were lower in the treatment group than in the control group. Lymphocyte subsets were not changed significantly at 12 wk. The percentage of CD4+ T cells and the CD4+/CD8+ ratio were increased significantly at 24 and 48 wk, while no significant changes were found in the percentages of CD3+ T cells, D8+ T cells, and D19+ B cells. At 48 wk, compared to patients who did not have HBeAg negative conversion, the expression of CD1a, CD40, CD86 MHC-D, the percentage of CD4+, and CD4+/CD8+ ratio were increased obviously (all P < 0.01) in patients who had HBeAg negative conversion.
CONCLUSION: Cellular immunity is enhanced in HBeAg-positive CHB patients after telbivudine therapy. Telbivudine not only restrains virus reproduction but also participates in cellular immunity and promotes HBeAg negative conversion by regulating the function of DCs and lymphocyte subsets.
- Citation: Zhu B, Zhang P, Yu M, Wang TB, Mao QG. Association of HBeAg negative conversion with the effect of telbivudine on peripheral blood dendritic cells and lymphocyte subsets in patients with HBeAg-positive chronic hepatitis B. Shijie Huaren Xiaohua Zazhi 2011; 19(24): 2577-2582
- URL: https://www.wjgnet.com/1009-3079/full/v19/i24/2577.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i24.2577
乙型肝炎病毒(hepatitis B virus, HBV)是引起肝炎的始动因素, 由病毒感染所诱发的免疫损伤是慢性肝炎的主要发病机制, 有效的抑制或清除病毒是慢性乙型肝炎(chronic hepatitis B, CHB)病情稳定或治愈的关键. CHB的免疫机制复杂多样, 宿主的免疫耐受是肝炎慢性化的主要机制. 树突状细胞(dendritic cells, DCs)是最强的抗原递呈细胞, 能激活T细胞, 诱导一系列免疫反应, 在免疫调节中起着关键性的作用[1]. 研究表明[2,3], CHB患者的外周血中DCs, T、B淋巴细胞表达或功能下降, 从而导致免疫功能受损, 病毒持续复制. 替比夫定(telbivudine, LDT)是一种核苷类抗病毒药物, 能有效抑制HBV复制, 临床资料表明LDT抗病毒治疗, 能强效抑制HBV复制, 患者血清HBeAg阴转或血清转换率较其他核苷(酸)类药物高, 推测LDT除强效抑制HBV复制外, 可能具有免疫调节作用, 能上调患者的免疫功能, 提高患者的细胞免疫应答. 但有关LDT如何调节患者的免疫功能方面的研究尚少, 本研究通过观察CHB患者应用LDT抗病毒治疗前后外周血DCs表型分子的表达及淋巴细胞亚群的变化, 探讨LDT治疗CHB较高HBeAg阴转或血清转换率的免疫机制.
30例HBeAg阳性CHB患者选自我院2010-01/2011-01住院患者, 应用LDT抗病毒治疗, 作为实验组, 临床诊断标准均符合2005《慢性乙型肝炎防治指南》诊断标准[4], 入组标准: (1)初治患者, 治疗前没有应用拉米夫定、阿德福韦酯、恩替卡韦及干扰素抗病毒治疗史, 年龄18-55岁; (2)HBsAg(+)、HBeAg(+)、HBcAb(+)及HBV DNA 1.0×105-7; (3)ALT升高达正常值上限(ULN)2-5倍; (4)排除HCV、HIV、HDV感染, 均无心、脑、肾、或其他器官并发症. 所有入选者均口服LDT 600 mg qd, 并予复方甘草酸制剂护肝治疗. 治疗12 wk时检测肝功能、HBV DNA, 24 wk时检测肝功能、HBV DNA, 乙型肝炎五项. 抗病毒治疗有效标准: (1)生化指标应答, ALT正常或明显改善; (2)病毒学应答: HBV DNA阴转或HBVDNA滴度下降≥2log. 另以健康体检者30例为对照组. 淋巴细胞分离液(Ficoll, 美国Mediatech产品), 重组人粒细胞巨噬细胞集落刺激因子(rhGM-CSF), 重组人肿瘤坏死因子(rhTNF-α)rhIL-4(PEPRO TECH公司产品), RPMI 1640和胎牛血清(FBS)购置Gibco公司. FITC标记的鼠抗人CD1a、PE标记的鼠抗人CD40、CD83、抗CD86 mAb, 均为Immunotech公司产品. FITC-CD45/PE-CDl4(A液)、FITC IgGI/PE-IgG2a(B液)、FITC-CD3/PE-CD19(C液)、FITC-CD3/PE-CD4(D液)、FITC-CD3/PE-CD8(E液)、FITC-CD3/PE-CD16+ CD56(F液)双色免疫荧光试剂盒(美国BD公司), 仪器为美国BD公司FACS Calibur流式细胞仪.
1.2.1 LDT抗病毒治疗前后生化指标、临床病毒学、免疫学指标的动态检测: 分别于抗病毒治疗后、12、24、48 wk检测ALT、乙型肝炎五项、HBV DNA, 12、24、48 wk进行外周血DCs培养和淋巴细胞亚群检测.
1.2.2 DCs的分离、纯化与扩增: 取研究对象抗凝外周血10 mL, 与等量的RPMI 1640液混匀, Ficoll密度梯度离心法分离单个核细胞(PBMC); 用含100 mL/L NCS的RPMI 1640液悬浮PBMC, 将分离的外周血单个核细胞在6孔板上贴壁, 每孔加2 mL, 3 h后吸去悬浮细胞, 并用37℃预温新鲜培养液轻轻洗去未贴壁的细胞, 加入Ⅰ号营养液: 100 mL/L小牛血清RPMI 1640中含GMCSF 50 μg/L, IL-4 10 μg/L, 在37℃, 50 mL/L CO2孵箱中培养, 每日半量换液1次, 第3次换液用Ⅱ号营养液: 100 mL/L小牛血清RPMI 1640中含GMCSF 50 μg/L, IL-4 10 μg/L, TNF-α 20 μg/L, 仍每日半量换液1次. 细胞培养至10 d左右收集.
1.2.3 树突状细胞的表型分析: 按试剂盒说明FITC标记的CD83、CD40、HLADR、CD86标记DC并用流式细胞仪分析DC的表型, 并拍摄细胞照片.
1.2.4 外周血淋巴细胞亚群的检测: 取研究对象外周血, 分别于A、B、C、D、E、F样品测定管中各加50 μL抗凝血标本, 然后每管再分别加入A、B、C、D、E、F液20 μL, 振荡混匀, 室温避光静置20 min, 加入2 mL溶血素, 振荡混匀, 室温避光放置10 min, 1 200 r/min离心5 min, 弃上清, 加入2 mL PBS, 1 200 r/min离心5 min弃上清, 加入400 μL PBS, 混匀后上机检测, 以Simulset软件分析.
统计学处理 应用SPSS12.0统计软件, 采用单因素方差分析方法, 组间进行t检验比较.
30例HBeAg阳性CHB患者应用LDT连续治疗后HBV DNA含量下降、ALT持续改善. 治疗12 wk时, 18例CHB患者HBV DNA<500 copies/mL, 22例HBV DNA均下降≥2log, ALT逐渐复常. 24 wk时, 22例HBV DNA<500 copies/mL, 26例ALT恢复正常, 治疗48 wk时, 30例CHB患者ALT均正常, 26例HBV DNA<500 copies/mL, 其中8例HBeAg发生阴转. 1例出现YIDD变异, 对LDT耐药, 2例出现一过性轻度肌酸激酶升高(CK).
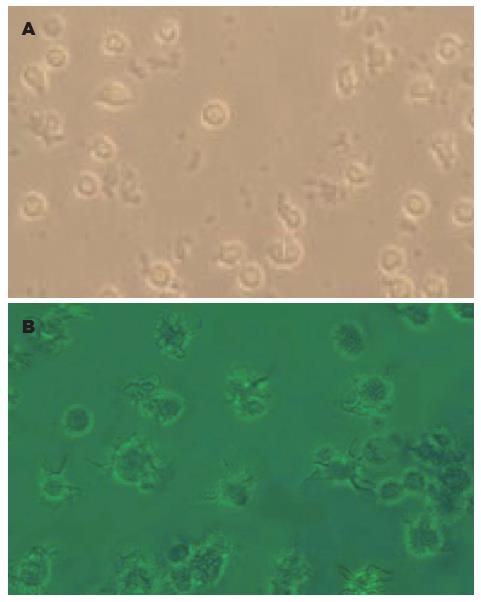
在倒置显微镜下观察, 与健康对照组比较, LDT抗病毒治疗12 wk时CHB患者DCs形态及数量变化不大, 治疗24和48 wk时, DCs绝大部分呈半悬浮生长, 胞体较大, 可见胞膜向外延伸出异样突起, 簇聚明显, 数量增加(图1).
流式细胞仪分析发现, 抗病毒治疗24、48 wk时DCs表面分子CD1a、CD40、CD83、CD86和MHC-DR表达均较治疗前明显提高(P<0.05), 但均低于健康对照组(P<0.05), 二时相间比较差异有显著性(P<0.05), 而治疗12 wk时DC表面分子表达无明显变化(表1).
流式细胞仪检测表明, 抗病毒治疗12 wk时, CHB患者淋巴细胞亚群无明显变化; 治疗24和48 wk时, CD4+ T及CD4+/CD8+ T比值较治疗前显著提高(P<0.05), NK细胞比例与治疗前比较差异无显著性(P>0.05), CD3+ T、CD8+ T和CD19+ B细胞未见明显改变(表2).
| 分组 | CD3+ | CD4+ | CD8+ | CD19+ | CD4+/CD8+ | NK |
| 治疗组 | ||||||
| 治疗前 | 65.7±10.6 | 30.4±5.2 | 26.3±4.2 | 17.2±6.7 | 1.16±0.19 | 15.2 ±4.7 |
| 治疗 | ||||||
| 12 wk | 64.2±7.3 | 31.8±6.1 | 26.6±5.4 | 16.6±5.9 | 1.19±0.23 | 16.6±3.9 |
| 24 wk | 65.3±6.1 | 34.9±7.3ac | 25.8±6.1 | 15.9±4.6 | 1.35±0.28ac | 17.3±3.1 |
| 48 wk | 66.4±5.7 | 35.2±4.7ac | 25.4±3.6 | 15.7±3.8 | 1.39±0.33ac | 1.7±4.2 |
| 对照组 | 61.6±7.8 | 43.4±7.2 | 23.3±3.4 | 12.4±3.6 | 1.86±0.34 | 24.5±2.6 |
CHB的发病的免疫机制复杂多样, 宿主的免疫耐受是肝炎慢性化的主要机制. DCs是最强的抗原递呈细胞, 能激活T细胞, 诱导一系列免疫反应, 产生CTL, 清除病原体. 研究表明, CHB患者由于HBV感染, 引起严重的CD8T细胞功能异常, 分泌低水平的抗病毒细胞因子, 损害细胞毒T淋巴细胞活性(CTL)[5], 免疫功能受损, 外周血中DCs, T、B淋巴细胞表达或功能下降, 从而导致免疫功能受损, 病毒持续感染. 本研究通过观察CHB患者应用LDT抗病毒治疗前后外周血DCs表型的表达及淋巴细胞亚群的动态变化, 观察到, LDT能强力抑制HBV复制, 很高的ALT复常率, 特别是有较高的HBeAg阴转率(26.7%), 高于文献报道拉米夫定抗病毒治疗CHB患者1年的HBeAg阴转率(16%)[6].
30例HBeAg+ CHB患者, LDT抗病毒治疗24和48 wk时DCs表面分子CD1a、CD40、CD83、CD86和MHC-DR表达均较治疗前明显提高(P<0.05), 但均低于健康对照组(P<0.05), 二时相间比较差异有显著性(P<0.05), 治疗24和48 wk时, CD4+ T及CD4+/CD8+ T比值较治疗前显著提高(P<0.05), NK细胞比例与治疗前比较无统计学意义(P>0.05), CD3+ T、CD8+ T和CD19+ B细胞未见明显改变, 治疗12 wk时, DC表面分子, CD4+ T及CD4+/CD8+ T比值与治疗前比较均无明显变化, 提示随着LDT抗病毒治疗时间的延长, 患者DCs表面分子的表达上调, CD4+ T水平及CD4+/CD8+ T比值升高, 患者的细胞免疫功能增强, HBeAg阴转CHB患者较未阴转患者, DCs表面分子的表达上调, CD4+ T水平及CD4+/CD8+比值升高更加明显, LDT通过强力抑制HBV的复制, 提高患者的细胞免疫功能, 这可能是LDT有较高HBeAg阴转率的原因之一.
DCs在免疫应答过程中发挥重要的作用, 研究表明, CHB患者外周血DCs的数量少于健康体检者, 并且DCs功能存在缺陷, 这可能与HBV的持续感染有关[7,8]. DCs分为髓系和浆细胞系DCs, 不同来源及分化阶段的DCs在表面标志物及功能方面有很大的不同, 未成熟的DCs仅表达低水平的MHC分子、协同刺激分子(CD80、CD86)和黏附分子(CD40、CD44、体外激发混合淋巴细胞反应(mixed lymphocyte reaction, MLR)的能力较弱, 但具有极强的摄取和加工处理抗原的能力. 在摄取抗原后或接受某些刺激因素(如LPS、IL-1β、TNF-α)后可以分化成熟. 成熟DCs表达高水平的MHC分子, 特征性标记(CD1a、CDIIc、CD83)等, 并能分泌IL-12、IL-21、IL-26、TNF-α等细胞因子, 同时激发MLR能力很强, 但抗原摄取能力大大下降. DCs在成熟过程中同时发生迁移, 由外周组织进入次级淋巴器官, 在CD40L的作用下, 分泌Th1型细胞因子, 有效地将抗原提呈给初始T细胞并使之激活, 促进细胞介导的免疫应答[9,10].
HBeAg是HBV复制活跃的重要血清学指标, 在免疫基础上发生的HBeA血清学阴转或转换是CHB病情好转或稳定的重要标志[11]. LDT抗病毒治疗HBeAg阳性CHB有较高的HBeAg阴转或血清转化率, 其机制目前尚不明确, 但资料研究表明, 有多个指标可能与LDT抗病毒治疗CHB患者, 血清高HBeAg阴转或转换率密切相关, ALT升高是CHB患者免疫激活, 清除HBV引起免疫损伤所致. Lv等[11]研究表明, LDT抗病毒治疗HBeAg阳性CHB, 高基线ALT水平可以预测高HBeAg血清转换, CHB患者外周血或肝脏内CD4+CD25调节性T细胞(Tregs)增多, 潘秀成等[12]研究显示, LDT抗病毒治疗CHB过程中能降低外周血Tregs 比例, 解除Tregs对HBV特异性T淋巴细胞功能的抑制作用, 改善特异性抗HBV免疫应答, 可能是LDT具有较高HBeAg血清阴转或转换率的原因, CHB患者, 记忆CD8TCD127分子表达下降, CD8TCD127分子表达水平上调与CD38和PD-1下调有密切相关性[13,14]. CD8T细胞CD127分子表达水平与血清HBV DNA和HBeAg水平有明显负相关性, 有效的抗病毒治疗可以提高CD8T细胞CD127分子的表达, 同时也可以增加HBV特异性CD8T细胞水平[15]. 其机制可能与LDT抗病毒治疗后, 患者免疫功能, 特别是细胞免疫功能增强有关. 替比夫定能强力抑制HBV复制, 外周血CDs表面分子的表达明显提高, Th1辅助T细胞功能上调, CD4+/CD8+ T比例提高, 这可能与LDT抗病毒治疗CHB, 高HBeAg血清学转换免疫基础, 对于LDT治疗HBeAg阴性CHB患者, 外周血DCs及淋巴细胞亚群的变化有待于今后进一步研究.
替比夫定抗病毒治疗慢性乙型肝炎(CHB), 临床观察及实验研究均显示较其他核苷(酸)类药物有较高的HBeAg阴转或血清转换率, 但其机制尚不明确, HBeAg阴转或血清转换是在有效抑制或清除HBV的基础上发生的, 而HBV的清除根本上取决于患者的免疫功能, 特别是细胞免疫功能, 树突状细胞在免疫功能调节中起关键性作用, DCs表面分子的表达, 辅助性CD4+ T细胞及CD4+/CD8+比例是反映机体细胞免疫功能的重要标志
陈治水, 主任医师, 解放军第211医院中医科; 靳雪源, 副主任医师, 解放军第302医院消化内科; 任浩, 副教授, 第二军医大学微生物学教研室
替比夫定治疗CHB, 高HBeAg血清阴转或转换率, 在辅助性T细胞, CD4+, CD8+亚群及其分泌的特异性细胞因子或细胞因子特异性受体方面研究的屡见报道, 例如, CD38, PD-1, CD8+CD127, 而替比夫定强效抑制HBV复制, 特异性细胞因子的变化, 是通过什么信号途径调节细胞免疫功能, 从而提高HBeAg血清阴转或转换率, 可能是需要进一步研究的问题.
Tavakoli等研究CHB患者外周血DCs的表型与功能, DCs功能存在缺陷, 与HBV的持续感染有关, 我们的研究结果与其一致, 吕国才等研究显示, LDT抗病毒治疗CHB患者, 高基线ALT水平, 与高HBeAg阴转或血清学转换密切相关; 记忆性CD8T表面IL-7受体α(CD127)分子表达水平与血清HBV DNA和HBeAg水平有明显负相关性. Evans等研究, 程序性死亡因子(PD-1)影响CHB患者HBeAg血清学转换, 是目前研究的一个热点.
本文动态观察LDT抗病毒治疗CHB, 不同时相DCs表面分子的表达,CD4+水平及CD4+/CD8+比值的变化, 从细胞免疫功能的变化, 探讨高HBeAg血清转换的免疫基础.
在临床实践中, 通过检测CHB患者CDs表面分子的表达或T细胞亚群变化, 预测LDT抗病毒治疗CHB患者的HBeAg血清转换, 判断LDT抗病毒疗效.
本文探讨了乙型肝炎患者应用替比夫定(LDT)抗病毒治疗前后外周血树突状细胞及淋巴细胞亚群变化, 寻求高HBeAg血清转换的原因, 为替比夫定的作用机制提供了新的线索, 对HBV的临床治疗具有较重要的参考价值.
编辑: 何基才 电编:何基才
| 1. | Banchereau J, Briere F, Caux C, Davoust J, Lebecque S, Liu YJ, Pulendran B, Palucka K. Immunobiology of dendritic cells. Annu Rev Immunol. 2000;18:767-811. [PubMed] [DOI] |
| 2. | Beckebaum S, Cicinnati VR, Dworacki G, Müller-Berghaus J, Stolz D, Harnaha J, Whiteside TL, Thomson AW, Lu L, Fung JJ. Reduction in the circulating pDC1/pDC2 ratio and impaired function of ex vivo-generated DC1 in chronic hepatitis B infection. Clin Immunol. 2002;104:138-150. [PubMed] [DOI] |
| 3. | van der Molen RG, Sprengers D, Biesta PJ, Kusters JG, Janssen HL. Favorable effect of adefovir on the number and functionality of myeloid dendritic cells of patients with chronic HBV. Hepatology. 2006;44:907-914. [PubMed] [DOI] |
| 5. | Bertoletti A, Maini M, Williams R. Role of hepatitis B virus specific cytotoxic T cells in liver damage and viral control. Antiviral Res. 2003;60:61-66. [PubMed] [DOI] |
| 6. | Lok AS, Lai CL, Leung N, Yao GB, Cui ZY, Schiff ER, Dienstag JL, Heathcote EJ, Little NR, Griffiths DA. Long-term safety of lamivudine treatment in patients with chronic hepatitis B. Gastroenterology. 2003;125:1714-1722. [PubMed] [DOI] |
| 7. | Tavakoli S, Mederacke I, Herzog-Hauff S, Glebe D, Grün S, Strand D, Urban S, Gehring A, Galle PR, Böcher WO. Peripheral blood dendritic cells are phenotypically and functionally intact in chronic hepatitis B virus (HBV) infection. Clin Exp Immunol. 2008;151:61-70. [PubMed] [DOI] |
| 8. | Op den Brouw ML, Binda RS, van Roosmalen MH, Protzer U, Janssen HL, van der Molen RG, Woltman AM. Hepatitis B virus surface antigen impairs myeloid dendritic cell function: a possible immune escape mechanism of hepatitis B virus. Immunology. 2009;126:280-289. [PubMed] [DOI] |
| 9. | Kadowaki N, Ho S, Antonenko S, Malefyt RW, Kastelein RA, Bazan F, Liu YJ. Subsets of human dendritic cell precursors express different toll-like receptors and respond to different microbial antigens. J Exp Med. 2001;194:863-869. [PubMed] [DOI] |
| 10. | Dudziak D, Kamphorst AO, Heidkamp GF, Buchholz VR, Trumpfheller C, Yamazaki S, Cheong C, Liu K, Lee HW, Park CG. Differential antigen processing by dendritic cell subsets in vivo. Science. 2007;315:107-111. [PubMed] [DOI] |
| 11. | Lv GC, Ma WJ, Ying LJ, Jin X, Zheng L, Yang YD. Efficacy of telbivudine in HBeAg-positive chronic hepatitis B patients with high baseline ALT levels. World J Gastroenterol. 2010;16:4095-4099. [PubMed] [DOI] |
| 12. | 潘 修成, 杨 帆, 陈 明, 傅 涓涓, 郭 忠胜, 张 言超, 孙 莉莉. 替比夫定对慢性乙型肝炎患者外周血CD4 CD25调节性T细胞动态变化的影响及临床意义. 中华肝脏病杂志. 2008;16:885-888. |
| 13. | Boettler T, Panther E, Bengsch B, Nazarova N, Spangenberg HC, Blum HE, Thimme R. Expression of the interleukin-7 receptor alpha chain (CD127) on virus-specific CD8+ T cells identifies functionally and phenotypically defined memory T cells during acute resolving hepatitis B virus infection. J Virol. 2006;80:3532-3540. [PubMed] [DOI] |
| 14. | Evans A, Riva A, Cooksley H, Phillips S, Puranik S, Nathwani A, Brett S, Chokshi S, Naoumov NV. Programmed death 1 expression during antiviral treatment of chronic hepatitis B: Impact of hepatitis B e-antigen seroconversion. Hepatology. 2008;48:759-769. [PubMed] [DOI] |