修回日期: 2011-08-25
接受日期: 2011-08-26
在线出版日期: 2011-08-28
目的: 研究肿瘤相关钙信号传导蛋白2(tumor-associated calcium signal transducer-2, Trop-2)表达下调对食管鳞癌EC9706细胞增殖和细胞迁移的影响, 并探讨其可能的分子机制.
方法: 将Trop-2 siRNA和对照siRNA转染食管鳞癌EC9706细胞, 利用实时荧光定量PCR和Western blotting检测转染Trop-2 siRNA后食管鳞癌EC9706细胞中Trop-2 mRNA和蛋白的表达. 利用CCK-8试剂分析转染Trop-2 siRNA后EC9706细胞的增殖变化, 接着采用Boyden小室研究下调Trop-2对EC9706细胞迁移的影响, 最后利用Western blotting技术分析与细胞迁移相关基因MMP-7表达的变化.
结果: 转染Trop-2 48 h, Trop-2 siRNA组中Trop-2 mRNA和蛋白的表达显著低于未处理组和对照siRNA组(P<0.05). Trop-2表达下调能明显抑制食管鳞癌EC9706细胞的增殖(P<0.05). 此外, Boyden小室结果表明, 与未处理组(119.27±4.63)及对照siRNA组(112.81±5.01)相比, Trop-2 siRNA组中EC9706细胞的穿膜数(65.29±4.33)明显降低. Western blotting结果表明, Trop-2 siRNA能明显降低食管鳞癌EC9706细胞中MMP-7的表达.
结论: Trop-2表达下调能抑制食管鳞癌细胞的增殖和迁移, 其介导的迁移能力的降低可能与MMP-7表达的下调密切相关, 操纵Trop-2有望成为食管鳞癌的分子治疗靶点.
引文著录: 李慎柯, 范天黎, 寇洁, 崔瑶. Trop-2表达下调对食管鳞癌EC9706细胞增殖和细胞迁移的影响. 世界华人消化杂志 2011; 19(24): 2562-2566
Revised: August 25, 2011
Accepted: August 26, 2011
Published online: August 28, 2011
AIM: To investigate the effect of down-regulation of tumor-associated calcium signal transducer-2 (Trop-2) expression on cell proliferation and migration in human esophageal squamous cell carcinoma (ESCC) cell line EC9706 and to explore possible molecular mechanisms involved.
METHODS: Trop-2-specific small interfering RNA (siRNA) and control siRNA were transfected into EC9706 cells, and expression of Trop-2 mRNA and protein was detected by real-time PCR and Western blotting. CCK-8 assay was used to measure cell proliferation, and Boyden chamber assay was utilized to determine cell migration. The expression of cell migration-related MMP-7 protein was detected by Western blotting.
RESULTS: The expression of Trop-2 mRNA and protein in the Trop siRNA group was significantly lower than that in the normal control group or control siRNA group 48 h after transfection. SiRNA-mediated down-regulation of Trop-2 expression obviously inhibited cell proliferation and migration compared to the normal control group and control siRNA group (65.29 ± 4.33 vs 119.27 ± 4.63, 112.81 ± 5.01, both P < 0.05). Transfection of Trop-2-specific siRNA markedly decreased the expression of MMP-7 protein in EC9706 cells.
CONCLUSION: Down-regulation of Trop-2 expression inhibits the proliferation and migration of EC9706 cells possibly by down-regulating MMP-7 expression. Trop-2 might be used as a molecular target for therapy of ESCC.
- Citation: Li SK, Fan TL, Kou J, Cui Y. Down-regulation of Trop-2 expression inhibits cell proliferation and migration in human esophageal squamous cell carcinoma cell line EC9706. Shijie Huaren Xiaohua Zazhi 2011; 19(24): 2562-2566
- URL: https://www.wjgnet.com/1009-3079/full/v19/i24/2562.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i24.2562
食管癌是一种十分常见的恶性程度极高的消化道肿瘤, 食管鳞癌作为食管癌的主要组织学类型, 占所有食管癌的90%以上[1], 而中国林州是全球范围内食管鳞癌发病率最高的地区[2]. 尽管目前外科手术和辅助的放化疗手段的不断发展, 食管鳞癌五年生存率仍然很低[3,4], 因此从分子水平探讨食管鳞癌发生发展的分子机制具有十分重要的意义. 肿瘤相关钙信号传导蛋白2(tumor-associated calcium signal transducer-2, Trop-2)基因, 又称为TACSTD2、GA733-1、M1S1或EGP-1, 是人类肿瘤中高度表达的细胞表面糖蛋白受体. 他定位于1号染色体短臂, 是一种单层的Ⅰ型跨膜磷酸化糖蛋白. 近来, 尽管Trop-2作为细胞表面受体, 但其功能还有待进一步阐明, 研究发现他可能在调控肿瘤细胞的增殖中发挥重要作用[5]. 最近, 有报道表明, Trop-2的过表达与多种不同类型的肿瘤的浸润型表型和较差的预后密切相关[6-9]. 然而其在食管鳞癌中的作用如何尚不得而知, 因此在研究中, 我们利用Trop-2 siRNA干扰食管鳞癌EC9706细胞中Trop-2 mRNA和蛋白的表达, 研究其对食管鳞癌增殖和细胞迁移的影响, 进一步探讨其可能的分子机制, 该研究有望为以Trop-2为靶点的食管鳞癌基因治疗提供理论依据.
RPMI-1640培养基和胰蛋白酶均购自美国Sigma公司; 胎牛血清和小牛血清均购自杭州四季青生物工程材料有限公司; 脂质体2000转染试剂购自美国Invitrogen公司; 兔抗人的Trop-2、MMP-7和β-actin抗体、Trop-2 siRNA和对照siRNA购自Santa Cruz公司; CCK-8试剂购自中国碧云天生物技术有限公司; Boyden小室购自江苏省海门市麒麟医用仪器厂; Quant一步法RT-PCR试剂盒购自天根生化科技(北京)有限公司; 蛋白裂解液购自宝生物工程(大连)有限公司.
1.2.1 引物设计: 根据GenBank登录号Trop-2(NM_002353)和β-actin(NM_001101), 利用Primer Premier 5.0软件设计引物如下: Trop-2F: 5'-GAAGTTCTCCATGAAGCGCCTCACC-3', Trop-2R: 5'-CAAGC TCGGTTCCTTTCTCAACTCCC-3', 产物大小: 172 bp; β-actinF: 5'- CACTGTGCCCATCTACGAGGGGTATG-3', β-actinR: 5'-TCTC CTTAATGTCACGCACGATTTCCC-3', 产物大小为: 161 bp. 上述引物由上海生工生物工程技术服务有限公司合成.
1.2.2 细胞培养及转染: 人食管鳞癌EC9706细胞株购自购自中国科学院上海细胞研究所细胞库. 将EC9706细胞置于含10%的胎牛血清的RPMI-1640培养基中培养, 当细胞融合度达80%-90%时, 按脂质体2000的说明书将Trop-2 siRNA和对照siRNA进行转染, 转染后的48 h进行后续的实验. 实验中的细胞分为三组: 未处理组(不作任何处理); 对照siRNA组(利用对照siRNA转染); Trop-2 siRNA组(利用Trop-2 siRNA转染).
1.2.3 细胞增殖分析: 分别收集转染后24 h、48 h、72 h及96 h的三组EC9706细胞, 在测定生长速率的时候, 加入含10% CCK-8的等量新鲜培养基于37 ℃培养1-4 h左右, 然后用酶标仪测450 nm的吸光度.
1.2.4 Boyden chamber: 将三组细胞(每组大约105个)分别悬浮在含有0.2%的小牛血清的800 µl的培养基中, 依次接种至Boyden chamber的上层, 培养6 h. 然后收集迁移到滤膜下层的细胞, 用甲醇固定, 并通过HE染色来观察下层细胞的数量, 最后通过计算滤膜下层的细胞数来评估其转移的细胞数(30个视野, ×200).
1.2.5 实时荧光定量PCR: 收集48 h转染和未转染的三组EC9706细胞, 用Trizol试剂从三组细胞中提取总RNA, 然后按Quant一步法RT-PCR试剂盒的操作说明书进行, 首先配制如下反应液: 10×RT-PCR Buffer 2.5 µL, dNTP Mixture 1 µL, 5×RT-PCR enhancer 5 µL, RNasin 0.25 µL, Hotmaster Taq聚合酶1.25 µL, Quant RTase 0.25 µL, 上下游特异引物各1.5 µL, 总RNA模板10 ng-1 µg, 然后补充水分至25 µl. PCR反应在ABI 7300仪器上进行, 反应程序为: 反转录反应50 ℃ 30 min, PCR初始变性94 ℃ 2 min, 然后35个循环94 ℃ 30 s, 58 ℃ 30 s, 65 ℃延伸30 s. 实验中每个样品重复三次, 基因的相对表达分析采用2-△△Ct方法进行计算[10].
1.2.6 Western blotting: 收集48 h转染和未转染的三组EC9706细胞, 用裂解法提取细胞的总蛋白进行Western blotting分析. 首先利用细胞裂解液提取总蛋白, 然后进行SDS-PAGE电泳. 电泳结束后, 取下凝胶电转移到硝酸纤维素膜上. 用含5%脱脂奶粉的TBST液封闭NC膜2 h, 加入一抗(Trop-2、MMP-7和β-actin)(1∶500), 4 ℃ 摇床孵育过夜. 加入二抗室温孵育1.5 h. 将NC膜置于ECL(增强化学发光试剂)中反应1-3 min, 暗室中经X线片曝光, 常规方法显影定影, 显示特异的蛋白信号. 蛋白表达的灰度值利用Image-Pro Plus 5.0软件进行分析, 蛋白相对表达量为目的基因与内参基因的比值, 其中β-actin作为内参.
统计学处理 应用SPSS13.0统计软件进行统计学处理, 统计学数据用mean±SD表示, 两样本均数比较采用t检验, 多个样本均数比较应用单因素方差分析(One-way ANOVA), P<0.05具有显著性.
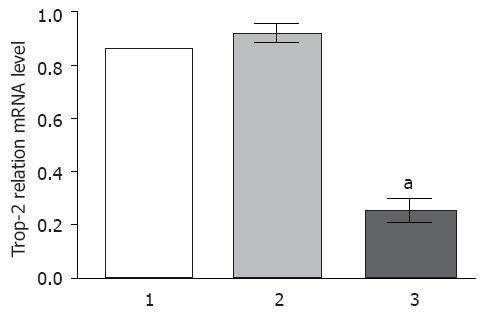
收集三组食管鳞癌EC9706细胞, 利用Quant一步法RT-PCR试剂盒检测三组细胞中Trop-2 mRNA的表达. 结果表明, 未处理组和对照siRNA组相比, EC9706细胞中Trop-2 mRNA的表达无差异(P>0.05), 然而, 与未处理组和对照siRNA组相比, Trop-2 siRNA组中Trop-2 mRNA的表达显著下降(P<0.05, 图1).
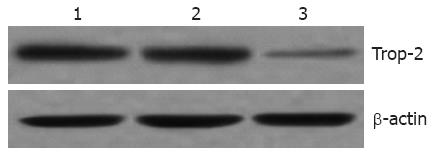
Western blotting结果显示, 转染Trop-2 siRNA后, 食管鳞癌EC9706细胞中Trop-2蛋白的表达显著下调, 明显低于未处理组和对照siRNA组(P<0.05), 然而未处理组和对照siRNA组中Trop-2蛋白的表达无差异(P>0.05, 图2).
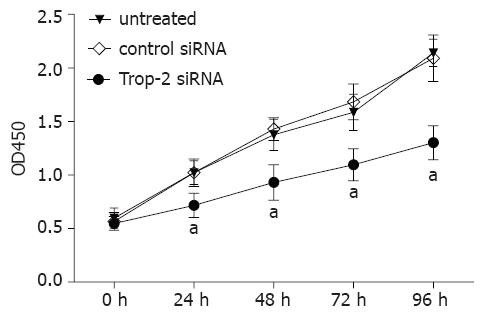
收集转染Trop-2 siRNA和对照siRNA后的24 h、48 h、72 h和96 h食管鳞癌EC9706细胞, 利用CCK-8试剂检测的增殖变化. 结果表明, 未处理组和对照siRNA组之间相比, EC9706细胞的增殖能力无差异(P<0.05), 然而与未处理组和对照siRNA组相比, 转染Trop-2 siRNA后的24 h、48 h、72 h和96 h, EC9706细胞的增殖在各个时间点均受到明显抑制(P<0.05, 图3).
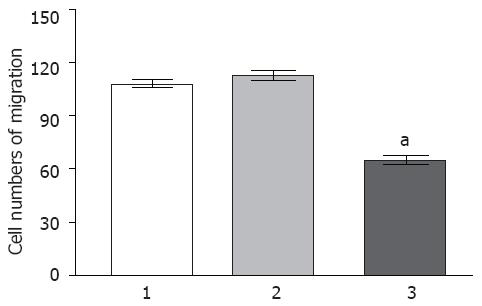
Boyden小室结果表明, 未处理组(细胞穿膜数为119.27±4.63)及对照siRNA组(细胞穿膜数为112.81±5.01)相比, EC9706细胞的穿膜数在统计学上无差异(P>0.05), 然而Trop-2 siRNA组中EC9706细胞的穿膜数(65.29±4.33)明显低于未处理组和对照siRNA组(P<0.05, 图4), 提示Trop-2表达下调能明显抑制食管鳞癌EC9706细胞的迁移.
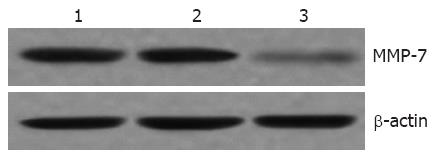
为了初步阐明Trop-2 siRNA介导的EC9706细胞迁移能力下降的可能的分子机制, 我们采用Western blotting检测与浸润转移密切相关的蛋白MMP-7表达的变化. 结果显示, 转染Trop-2 siRNA后, 食管鳞癌EC9706细胞中MMP-7蛋白的表达显著下调, 明显低于未处理组和对照siRNA组(P<0.05), 然而未处理组和对照siRNA组中MMP-7蛋白的表达无差异(P>0.05, 图5).
Trop-2基因主要定位于人类染色体上的1p32, 是一个单体的细胞表面糖蛋白, 在人类肿瘤中高表达, 但是在大多数正常组织中不表达或表达水平极低[5]. 目前发现, 其在结肠癌, 卵巢癌、食管癌等多种不同的肿瘤中呈现高表达[11-13]. 在食管鳞癌的研究中发现, Trop-2蛋白在一些食管癌细胞系(T.Tn、YES-1、YES-2、YES-4、YES-5、YES-6、TE-2和ECGI-10)和食管鳞癌组织标本中过表达[11]. 但是其详细的分子机制还不清楚, 为了进一步证实Trop-2在食管鳞癌中可能的作用, 因此本研究中我们利用RNA干扰技术研究下调食管鳞癌EC9706细胞中Trop-2 mRNA和蛋白的表达, 结果表明, 与未处理组和对照siRNA组相比, Trop-2 siRNA组中Trop-2 mRNA的表达显著下降(P<0.05), 提示Trop-2 siRNA能有效下调食管鳞癌EC9706细胞中Trop-2的表达, 这为后续进一步研究Trop-2在食管鳞癌中的作用提供新的实验证据.
已有研究表明, Trop-2的表达在一系列结肠癌细胞的增殖中发挥重要作用[13]. Trop-2在标准的组织培养条件下对于细胞的增殖不是必需的, 但是对于结肠癌细胞的锚定非依赖性的生长和肿瘤发生是必需的[13]. 为了研究是否Trop-2在食管鳞癌细胞增殖中的作用, 我们利用CCK-8试剂检测了三组EC9706细胞增殖的变化, 结果表明, Trop-2 siRNA能明显抑制食管鳞癌EC9706细胞的增殖, 提示Trop-2表达的下调能明显抑制食管鳞癌细胞的增殖, 因而可能为食管鳞癌的分子靶向治疗提供新的靶点.
最为显著的是, Trop-2的表达与一系列具有侵袭性的肿瘤的发生发展密切相关. Trop-2在原发性结肠癌中的表达与肝转移的发生密切相关, 并且在目前的医疗上尚不能治疗[14]. 在乳腺癌中, Trop-2的表达具有预测淋巴结转移的作用[15], 而且是低生存率中最为有效的预测因子[16]. 在肺癌中, Trop-2对生长因子受体抑制剂具有明显的拮抗作用[17]. 上述这些研究提示了Trop-2与肿瘤的浸润转移密切相关, 是一种很好的转移预测因子. 为了证实是否下调Trop-2的表达能影响食管鳞癌EC9706细胞的迁移能力, 我们采用Boyden小室分析了三组细胞转染48 h后的迁移能力的变化. 结果表明, Trop-2表达下调能明显降低EC9706细胞的迁移能力. 为了证实其可能的分子机制, 我们分析了基质金属蛋白酶7的表达, 该基因已经在食管鳞癌中被证实为与转移密切相关的因子[18]. 此外, MMP-7也已经被证实在结肠癌的肝转移中持续性的高表达[19]. 在本研究中, 我们检测了MMP-7蛋白的表达, 发现转染Trop-2 siRNA后MMP-7蛋白的表达显著下调, 提示Trop-2表达下调介导的食管鳞癌细胞迁移能力的下降可能与MMP-7表达的下调密切相关, 但其具体的分子作用机制还有待于进一步阐明.
总之, 我们的研究表明, Trop-2 siRNA能有效下调食管鳞癌EC9706细胞中Trop-2 mRNA的表达, 其表达下调能明显抑制食管鳞癌细胞的增殖和降低细胞的迁移能力, 其迁移能力降低的分子机制可能与MMP-7蛋白表达下调密切相关. 进一步研究Trop-2在食管鳞癌中的作用机制有望为以Trop-2为靶点的食管鳞癌基因治疗提供理论依据.
Trop-2基因是人类肿瘤中高度表达的细胞表面糖蛋白受体, 其在结肠癌、卵巢癌以及食管癌等多种不同的肿瘤中呈现高表达.
李淳, 副教授, 汕头大学医学院病理教研室.
近来研究显示, Trop-2的过表达与多种不同类型的肿瘤的浸润型表型和较差的预后密切相关. 然而, 其在食管鳞癌发生发展中的作用国内外尚未见报道. 关于Trop-2与恶性肿瘤关系的研究已成为热点.
研究显示, Trop-2在多种不同的恶性肿瘤的发生、发展中发挥重要的作用, 其异常表达可能与肿瘤的增殖分化及浸润转移关系密切.
本研究采用Trop -2 siRNA下调食管鳞癌EC9706细胞中Trop-2 mRNA和蛋白的表达, 研究其对食管鳞癌增殖和细胞迁移的影响, 进一步探讨其可能的分子机制.
肿瘤相关钙信号传导蛋白2(Trop-2)基因: 又称为TACSTD2、GA733-1、M1S1或EGP-1, 是人类肿瘤中高度表达的细胞表面糖蛋白受体.
本文设计合理, 为进一步研究Trop-2在食管鳞癌中的作用机制提供理论依据.
编辑: 李军亮 电编:何基才
| 1. | Parkin DM, Bray FI, Devesa SS. Cancer burden in the year 2000. The global picture. Eur J Cancer. 2001;37 Suppl 8:S4-66. [PubMed] [DOI] |
| 2. | Muñoz N, Buiatti E. Chemoprevention of oesophageal cancer. IARC Sci Publ. 1996;27-33. [PubMed] |
| 3. | Shimada H, Hoshino T, Okazumi S, Matsubara H, Funami Y, Nabeya Y, Hayashi H, Takeda A, Shiratori T, Uno T. Expression of angiogenic factors predicts response to chemoradiotherapy and prognosis of oesophageal squamous cell carcinoma. Br J Cancer. 2002;86:552-557. [PubMed] [DOI] |
| 4. | Shimada H, Nabeya Y, Okazumi S, Matsubara H, Shiratori T, Gunji Y, Kobayashi S, Hayashi H, Ochiai T. Prediction of survival with squamous cell carcinoma antigen in patients with resectable esophageal squamous cell carcinoma. Surgery. 2003;133:486-494. [PubMed] [DOI] |
| 5. | Fornaro M, Dell'Arciprete R, Stella M, Bucci C, Nutini M, Capri MG, Alberti S. Cloning of the gene encoding Trop-2, a cell-surface glycoprotein expressed by human carcinomas. Int J Cancer. 1995;62:610-618. [PubMed] [DOI] |
| 6. | Mühlmann G, Spizzo G, Gostner J, Zitt M, Maier H, Moser P, Gastl G, Zitt M, Müller HM, Margreiter R. TROP2 expression as prognostic marker for gastric carcinoma. J Clin Pathol. 2009;62:152-158. [PubMed] [DOI] |
| 7. | Fong D, Moser P, Krammel C, Gostner JM, Margreiter R, Mitterer M, Gastl G, Spizzo G. High expression of TROP2 correlates with poor prognosis in pancreatic cancer. Br J Cancer. 2008;99:1290-1295. [PubMed] [DOI] |
| 8. | Fong D, Spizzo G, Gostner JM, Gastl G, Moser P, Krammel C, Gerhard S, Rasse M, Laimer K. TROP2: a novel prognostic marker in squamous cell carcinoma of the oral cavity. Mod Pathol. 2008;21:186-191. [PubMed] |
| 9. | Fang YJ, Lu ZH, Wang GQ, Pan ZZ, Zhou ZW, Yun JP, Zhang MF, Wan DS. Elevated expressions of MMP7, TROP2, and survivin are associated with survival, disease recurrence, and liver metastasis of colon cancer. Int J Colorectal Dis. 2009;24:875-884. [PubMed] [DOI] |
| 10. | Livak KJ, Schmittgen TD. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) Method. Methods. 2001;25:402-408. [PubMed] |
| 11. | Nakashima K, Shimada H, Ochiai T, Kuboshima M, Kuroiwa N, Okazumi S, Matsubara H, Nomura F, Takiguchi M, Hiwasa T. Serological identification of TROP2 by recombinant cDNA expression cloning using sera of patients with esophageal squamous cell carcinoma. Int J Cancer. 2004;112:1029-1035. [PubMed] [DOI] |
| 12. | Bignotti E, Todeschini P, Calza S, Falchetti M, Ravanini M, Tassi RA, Ravaggi A, Bandiera E, Romani C, Zanotti L. Trop-2 overexpression as an independent marker for poor overall survival in ovarian carcinoma patients. Eur J Cancer. 2010;46:944-953. [PubMed] [DOI] |
| 13. | Wang J, Day R, Dong Y, Weintraub SJ, Michel L. Identification of Trop-2 as an oncogene and an attractive therapeutic target in colon cancers. Mol Cancer Ther. 2008;7:280-285. [PubMed] [DOI] |
| 14. | Ohmachi T, Tanaka F, Mimori K, Inoue H, Yanaga K, Mori M. Clinical significance of TROP2 expression in colorectal cancer. Clin Cancer Res. 2006;12:3057-3063. [PubMed] [DOI] |
| 15. | Huang E, Cheng SH, Dressman H, Pittman J, Tsou MH, Horng CF, Bild A, Iversen ES, Liao M, Chen CM. Gene expression predictors of breast cancer outcomes. Lancet. 2003;361:1590-1596. [PubMed] [DOI] |
| 16. | Fisher B, Bauer M, Wickerham DL, Redmond CK, Fisher ER, Cruz AB, Foster R, Gardner B, Lerner H, Margolese R. Relation of number of positive axillary nodes to the prognosis of patients with primary breast cancer. An NSABP update. Cancer. 1983;52:1551-1557. [PubMed] [DOI] |
| 17. | Coldren CD, Helfrich BA, Witta SE, Sugita M, Lapadat R, Zeng C, Barón A, Franklin WA, Hirsch FR, Geraci MW. Baseline gene expression predicts sensitivity to gefitinib in non-small cell lung cancer cell lines. Mol Cancer Res. 2006;4:521-528. [PubMed] [DOI] |
| 18. | Yoshinaga K, Mimori K, Inoue H, Kamohara Y, Yamashita K, Tanaka F, Mori M. Activin A enhances MMP-7 activity via the transcription factor AP-1 in an esophageal squamous cell carcinoma cell line. Int J Oncol. 2008;33:453-459. [PubMed] |