修回日期: 2011-08-12
接受日期: 2011-08-23
在线出版日期: 2011-08-28
目的: 针对PP2A内源性抑制剂SET基因的不同部位, 构建靶向SET的shRNA真核表达质粒, 鉴定并筛选出最佳抑制效率的表达质粒.
方法: 针对SET基因的不同部位设计4对短发卡RNA(shRNA)的寡核苷酸片段, 克隆到真核表达载体pGPU6中, 构建靶向SET的shRNA真核表达质粒pGPU6/GFP/Neo-SET-shRNA-1、2、3、4. 利用脂质体转染人胃癌细胞株BGC-823, Western blot法检测并筛选最佳抑制效率的shRNA表达质粒.
结果: 4个靶向SET的shRNA真核表达质粒pGPU6/GFP/Neo-SET-shRNA-1、2、3、4经限制性酶切和测序证实基因已正确插入, 荧光显示转染效率可达到80%以上. Western blot法证实pGPU6/GFP/Neo-SET-shRNA-3明显降低BGC-823细胞内SET蛋白的表达. pGPU6/GFP/Neo-SET-shRNA-3对SET蛋白表达的抑制效应在72h达到最强.
结论: 成功构建靶向SET的shRNA真核表达质粒pGPU6/GFP/Neo-SET-shRNA-1、2、3、4, 并筛选出最佳抑制效率的表达质粒, 为今后研究SET在胃癌中的作用机理奠定了基础.
引文著录: 师海蓉, 付政祺, 邓昊, 王绪明, 镇鸿燕, 陈莹, 刘丽江. 靶向SET的shRNA真核表达质粒的构建及鉴定. 世界华人消化杂志 2011; 19(24): 2521-2526
Revised: August 12, 2011
Accepted: August 23, 2011
Published online: August 28, 2011
AIM: To construct eukaryotic vectors expressing short hairpin RNAs (shRNAs) targeting the set gene which encodes an endogenous inhibitor of PP2A.
METHODS: Four oligonucleotides targeting the SET gene were synthesized and cloned into the eukaryotic expression plasmid pGPU6. The resulting four recombinant plasmids, pGPU6/GFP/Neo-SET-shRNA-1, 2, 3 and 4, were introduced into BGC-823 cells by lipofectamine-mediated transfection. The gene silencing efficiency was measured by Western blot
RESULTS: DNA sequencing and enzyme digestion analysis confirmed the identity of the four recombinant shRNA expression vectors. Immunofluorescsence demonstrated that transfection efficiency was above 80%. Transfection of pGPU6/GFP/Neo-SET-shRNA-3 significantly knocked down the expression of SET protein as revealed by Western blot. The silencing effect of pGPU6/GFP/Neo-SET-shRNA-3 on the expression of SET protein was most remarkable at 72 h after transfection.
CONCLUSION: Eukaryotic vectors expressing shRNAs targeting the set gene have been constructed successfully and can be used to study the role of SET in gastric cancer.
- Citation: Shi HR, Fu ZQ, Deng H, Wang XM, Zhen HY, Chen Y, Liu LJ. Construction of eukaryotic vectors expressing shRNAs targeting the set gene. Shijie Huaren Xiaohua Zazhi 2011; 19(24): 2521-2526
- URL: https://www.wjgnet.com/1009-3079/full/v19/i24/2521.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i24.2521
SET(patient SE translocation)基因, 1992年由von Lindern等[1]首次鉴定于1例急性未分化性白血病病例, 因为发现于患者SE的染色体畸变-9号染色体异位产生了SET-CAN融合蛋白, 被命名为SET基因(SE translocation, SET). SET基因定位于染色体9q34, 全长2 575 bp, 开放阅读框834 bp, 编码277个氨基酸, 蛋白相对分子质量约39 000 Da. 作为潜在的肿瘤抑制因子PP2A的特异性抑制剂, SET蛋白已被发现与多种生物活动相关, 因此有多个名称, 如模板活化因子-1(template activating factor 1β, TAF1β)[2]、蛋白磷酸酶2A抑制剂-2(inhibitor of protein phosphatase 2 A-2, I2PP2A)[1]、组织相容性白细胞抗原Ⅱ相关蛋白(putative histocompatibility leukocyte antigen class Ⅱ protein, PHAP-II)[3,4]、及inhibitor of histone acetyltransferase(INHAT)[5]等. 已有研究表明SET广泛表达于人类不同组织和细胞系, 其表达异常与多种疾病相关. 对胃癌组织mRNA进行SET cDNA表达分析发现肿瘤组织中SET表达是相应正常组织的2倍或更高[6]. 然而, 目前对于SET基因和蛋白表达、功能调控的机制研究尚不丰富. 为进一步阐明SET基因和蛋白表达在胃癌中的机制, 拟通过构建靶向SET的短发卡RNA(shRNA)真核表达质粒并转染人胃癌细胞株, 为深入研究奠定基础.
人胃癌BGC-823细胞株购自中国医学科学院, 为本实验室保存. pGPU6/GFP/Neo siRNA Expression Vector Kit购自上海吉玛制药技术有限公司. 实验中所用的各种工具酶、核酸标准分子量Marker以及蛋白预染Marker均为TaKaRa公司产品. 去内毒素质粒大量提取试剂盒为德国Qiagen公司产品. 质粒转染试剂LipofectamineTM 2000购自美国invitrogen公司. 兔多克隆抗体SET以及辣根过氧化物酶标记的羊抗兔IgG购自美国Santa Cruz公司, 鼠单克隆抗体GAPDH(BM1623)购自武汉博士德生物工程有限公司. 用于Western blot检测的增强化学发光试剂ECL和BCA蛋白定量试剂盒为美国Pierce公司产品. PVDF转印膜购自美国Millipore公司. 引物的合成及DNA序列测定均由上海英骏生物技术有限公司完成.
1.2.1 靶向SET的shRNA设计: 根据GenBank中SET的cDNA序列, 参考shRNA设计原则, 选择cDNA序列上的4个部位作为目标序列, 同时将选中的shRNA中的碱基序列随机打乱设计为阴性对照(shRNA. NC), 对照序列经BLAST检测证实与SET mRNA及其他基因编码序列无同源性. shRNA模板中的Loop结构选用了TTCAAGAGA以避免形成终止信号, shRNA的转录终止序列采用T6结构. 正义链模板的5'端添加了CACC, 与BbsⅠ酶切后形成的粘端互补; 反义链模板的5'端添加了GATC, 与BamHⅠ酶切后形成的粘端互补; 如果siRNA的第1个碱基不是G, 则在CACC后补加一个G. 序列见表1.
| shRNA | 序列 |
| shRNA. NC | 正义 5'-caccgttctccgaacgtgtcacgtcaagagattacgtgacacgttcggagaattttttg-3' |
| 反义 5'-gatccaaaaaattctccgaagctgtcacgtaatctcttgacgtgacacgttcggagaac-3' | |
| shRNA-1 | 正义 5'-caccgcggctccagtgcagatttaattcaagagattaaatctgcactggagccgcttttttg-3' |
| 反义 5'-gatccaaaaaagcggctccagtgcagatttaatctcttgaattaaatctgcactggagccgc-3' | |
| shRNA-2 | 正义 5'-caccgggataccagatagctcaatattcaagagatattgagctatctggtatcccttttttg-3' |
| 反义 5'-gatccaaaaaagggataccagatagctcaatatctcttgaatattgagctatctggtatccc-3' | |
| shRNA-3 | 正义 5'-caccgctctaatgccaagttatacattcaagagatgtataacttggcattagagcttttttg-3' |
| 反义 5'-gatccaaaaaagctctaatgccaagttatacatctcttgaatgtataacttggcattagagc-3' | |
| shRNA-4 | 正义 5'-caccgcatgtcttcattggctatatttcaagagaatatagccaatgaagacacatgcttttttg-3' |
| 反义 3'-gatccaaaaaagcatgtcttcattggctatattctcttgaaatatagccaatgaagacatgc-3' |
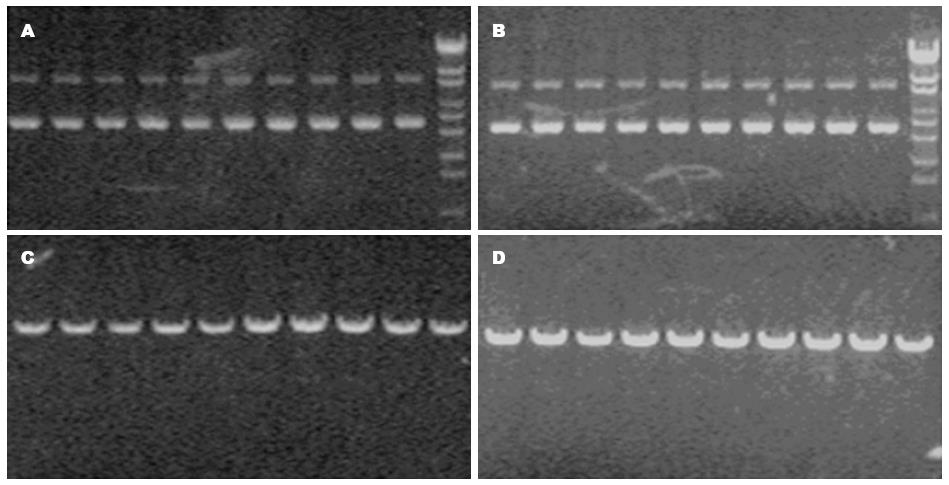
1.2.2 靶向SET shRNA表达质粒的构建和鉴定: 在PCR仪上按照如下程序进行退火处理: 将DNA Oligo分别用TE(pH8.0)溶解, 浓度为100 μmol/L取相应的正义链和反义链Oligo溶液, 按照如下配比配置退火反应体系. 10×shDNA Annealing Buffer 5 μL, sense strand(100 μmol/L)5 μL, antisense strand(100 μmol/L)5 μL, ddH2O 35 μL. 退火处理: 95 ℃ 5 min; 85 ℃ 5 min; 75 ℃ 5 min; 70 ℃ 5 min; 4 ℃保存. 退火处理后得到浓度为10 μmol/L的shRNA模板. 将所得模板溶液稀释500倍, 终浓度为20 nmol/L, 用于连接反应. 用T4 DNA连接酶将准备好的插入片段连接到纯化质粒载体pGPU6的BbsⅠ与BamHⅠ之间, 22 ℃ 1 h, 转化到JM 109感受态细胞. 每个连接反应挑取6个菌落, 接种到含50 mg/L Kanamycin的LB培养集中. 使用碱裂解法抽提质粒, 所得质粒用BamHⅠ, PstⅠ分别酶切鉴定. 阳性重组载体应该可以被BamHⅠ切开, 而不能被PstⅠ切开. 并将阳性克隆送上海英骏生物技术有限公司测序鉴定. 酶切原理基于如下机制:原始载体中有PstⅠ酶切位点, 当插入shRNA片段后此PstⅠ酶切位点就被替换掉, 因此在后续酶切鉴定过程中, 用PstⅠ酶切是切不开的, 呈现质粒带型. 而BamHⅠ酶切位点构建后依旧保留, 故可以用BamHⅠ将载体切成线性化.
1.2.3 SET shRNA转染人胃癌BGC-823细胞: 采用LipofectamineTM 2000脂质体转染试剂, 按使用说明书进行转染实验. 将SET shRNA表达质粒瞬时转染入BGC-823细胞, 同时以转染shRNA. NC质粒为对照.
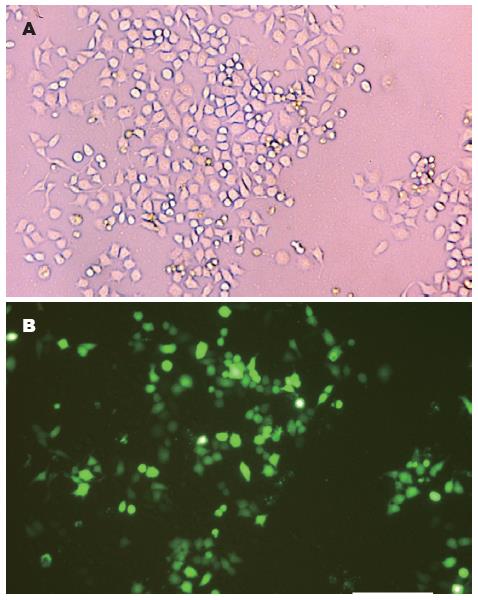
1.2.4 荧光显微镜检查转染效率: 细胞转染48 h后置于荧光显微镜下观察. 计算转染效率. 转染效率 = (发出绿色荧光的细胞数/可见光下的总细胞数)×100%.
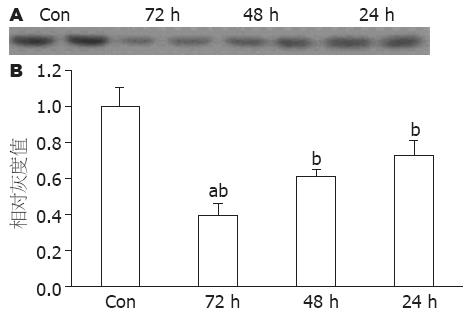
1.2.5 Western blot法检测重组质粒对SET蛋白表达的影响: 将转染shRNA-NC和SET-shRNA-1、2、3、4的细胞48 h后收取细胞总蛋白, 进行SDS-PAGE电泳, 电泳后湿转至PVDF膜, 含5%脱脂奶粉的TBS-T(含0.05% Tween-20的TBS)37 ℃封闭60 min, 加1∶1 000稀释的抗SET蛋白的多克隆抗体4 ℃孵育过夜. TBS-T漂洗5 min×3次, 加入1∶4 000稀释的辣根过氧化物酶标记的羊抗兔IgG 37 ℃孵育45 min. TBS-T漂洗5 min×3次, ECL化学发光试剂检测. 将转染shRNA-NC和SET shRNA-3分别转染BGC-823细胞, 于转染后24、48、72 h收取细胞总蛋白, 进行Western blot, 以检测其对SET蛋白表达的抑制效应.
统计学处理 采用SPSS13.0统计软件进行方差分析、t检验. P<0.05表示结果具有显著性差异.
每个连接反应挑取6个菌落. 接种到含50 mg/L Kanamycin的LB培养基中. 使用碱裂解法抽提质粒, 所得质粒用BamHⅠ, PstⅠ分别酶切鉴定, 阳性重组载体被BamHⅠ切开, 而不能被PstⅠ切开(图1). 将阳性克隆送测序. 测序结果证实设计序列正确插入载体且无突变. 酶切结果表明, 所有质粒均为阳性重组载体, 每组选择两个克隆进行测序鉴定(上海英骏生物技术有限公司). 测序结果正确.
BGC-823细胞转染重组质粒24 h后, 荧光显微镜观察显示细胞中均表达绿色荧光蛋白(GFP)(图2). 重组质粒24 h转染效率为80%以上.
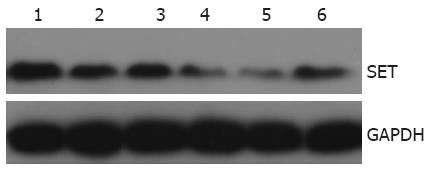
Western blot结果显示重组质粒SET shRNA-1、2、3、4对BGC-823细胞SET蛋白表达的抑制效果, 以SET shRNA-3明显(图3).
Western blot结果显示, SET shRNA-3持续稳定抑制SET蛋白表达. 与对照组比较24、48和72 h SET蛋白表达均下降, 以72 h最为显著(图4).
胃癌是我国最常见的恶性肿瘤之一, 死亡率居恶性肿瘤的第2位[7-9]. 尽管胃癌的综合治疗措施不断完善, 如手术切除、内镜下切除和化学治疗等, 但疗效仍不令人满意, 死亡率高, 预后不良. 因此, 探索胃癌发生、发展的分子机制并探寻新的防治靶点和干预策略, 具有重要意义[10,11].
蛋白磷酸酶2A(protein phosphatase 2A, PP2A)是真核生物体内的主要丝或苏氨酸蛋白磷酸酶, 参与细胞周期、DNA复制、信号转导、细胞分化和细胞恶性转化等多种细胞生物学事件[12]. 作为潜在的肿瘤抑制因子[13-18], PP2A活性的抑制被认为是细胞转化的前提条件[19,20]. 因此, 探寻抑制PP2A活性的分子靶标极具防治肿瘤意义.
PP2A活性除受磷酸化[21,22]和甲基化[3,23-25]修饰外还受内源性抑制剂SET的调节[24], SET是蛋白磷酸酶2A(protein phosphatase 2A, PP2A)的胞内抑制蛋白[3], 具有特异性、非竞争性和热稳定性[22]. 体外研究表明SET以非底物竞争方式抑制酶, 且抑制常数为纳摩尔水平[25,26]. SET和PP2A在哺乳动物的细胞和亚细胞水平分布的共定位及二者的活性变化也进一步支持了SET对PP2A的抑制作用[27]. 大量的研究表明SET广泛表达于人类不同组织和细胞系, 具有高度保守的结构特征和进化机制, 提示SET蛋白具有重要的功能. 因此下调在胃癌中过表达的SET可作为一个潜在的肿瘤治疗的靶点.
Cervoni等[6]报道, 在子宫、胃、结肠、直肠肿瘤组织, SET mRNA表达是相应正常组织的2倍以上. 本实验室前期研究也发现, 人胃癌组织中有PP2A抑制剂SET(蛋白及mRNA)的表达, 且其表达水平明显高于癌旁黏膜及正常组织. 虽然目前关于SET与PP2A、nm23-H1、beta-Catenin等[28-31]作用的机制不断出现, 然而其在肿瘤发生发展过程中的作用机制及临床相关性仍不清楚, 该蛋白能否成为诊断肿瘤的标志物以及癌症治疗的靶点仍需要进一步研究.
因此构建靶向SET的shRNA真核表达质粒pGPU6/GFP/Neo-SET, 是进一步深入研究SET基因的结构和功能的基础. 我们构建的载体其优势是选用人U6 RNA聚合酶Ⅲ启动子, 并利用相对单一的启动子和终止序列从而能够产生大量的shRNA达到有效的干扰效果. 另外在对急性未分化性白血病的研究中发现SET基因转录剪切产生TAF-Iα和SET/TAF-Iβ2个亚型, 对两个亚型的进一步研究表明:只发现SET/TAF-1β染色体异位; 在小鼠卵巢、睾丸、MA-10细胞和爪蟾卵, SET/TAF-1β为主要形式[32]; 而TAF-Iβ促进DNA复制、染色质转录和精子染色体解聚的活性均明显高于TAF-Iα, 提示SET/TAF-Iβ亚型可能发挥着SET蛋白的主要生物学作用. 因此本研究针对SET/TAF-Iβ亚型设计shRNA序列进一步探讨SET基因与相关疾病发生发展的关系.
针对目的基因我们共设计了4对shRNA序列, 构建了4个重组质粒, 将这些重组质粒分别转染人胃癌细胞株BGC-823和SGC-7901(结果未显示)后, 采用免疫荧光验证转染效率, Western blot法验证重组质粒对靶基因的抑制效率. 实验结果显示shRNA-2, 3均具有较高的抑制效率, 分别达到79%和90%, 而shRNA-1对靶基因无抑制作用, shRNA-4对靶基因抑制效率较低. 因此选择抑制效率高的shRNA-3进行后续研究, 为进一步研究SET在胃癌发生发展中的作用以及胃癌的分子生物学治疗奠定了基础.
人类恶性肿瘤细胞PP2A活性受抑制的分子机制尚不清楚, 且PP2A作为肿瘤抑制因子的证据多来自病毒抗原或化学抑制剂所致肿瘤, 尚缺乏人胃癌细胞中PP2A活性受内源性抑制剂抑制的实验和临床依据.
门秀丽, 教授, 河北联合大学病理生理学教研室; 于颖彦, 教授, 上海交通大学医学院附属瑞金医院器官移植中心病理室
PP2A内源型性抑制剂SET目前在胃癌发生发展中的机制尚不明确.
本研究拟从PP2A的内源性抑制剂SET入手, 构建针对SET的shRNA质粒, 为后续研究siRNA在胃癌防治中潜在的临床应用价值建立基础.
本文通过总结优化siRNA-SET质粒构建及鉴定, 为探讨SET在胃癌防治中的作用打下基础, 为其他相似研究提供参考与借鉴.
本研究通过构建靶向SET的短发卡RNA真核表达质粒并转染人胃癌细胞株, 对进一步阐明SET基因和蛋白表达在胃癌中的机制奠定了一定基础. 研究选题较新颖, 具有一定的科学意义.
编辑: 曹丽鸥 电编:何基才
| 1. | von Lindern M, van Baal S, Wiegant J, Raap A, Hagemeijer A, Grosveld G. Can, a putative oncogene associated with myeloid leukemogenesis, may be activated by fusion of its 3' half to different genes: characterization of the set gene. Mol Cell Biol. 1992;12:3346-3355. [PubMed] |
| 2. | Nagata K, Kawase H, Handa H, Yano K, Yamasaki M, Ishimi Y, Okuda A, Kikuchi A, Matsumoto K. Replication factor encoded by a putative oncogene, set, associated with myeloid leukemogenesis. Proc Natl Acad Sci USA. 1995;92:4279-4283. [PubMed] [DOI] |
| 3. | Li M, Makkinje A, Damuni Z. The myeloid leukemia-associated protein SET is a potent inhibitor of protein phosphatase 2A. J Biol Chem. 1996;271:11059-11062. [PubMed] [DOI] |
| 4. | Vaesen M, Barnikol-Watanabe S, Götz H, Awni LA, Cole T, Zimmermann B, Kratzin HD, Hilschmann N. Purification and characterization of two putative HLA class II associated proteins: PHAPI and PHAPII. Biol Chem Hoppe Seyler. 1994;375:113-126. [PubMed] [DOI] |
| 5. | Seo SB, McNamara P, Heo S, Turner A, Lane WS, Chakravarti D. Regulation of histone acetylation and transcription by INHAT, a human cellular complex containing the set oncoprotein. Cell. 2001;104:119-130. [PubMed] [DOI] |
| 6. | Cervoni N, Detich N, Seo SB, Chakravarti D, Szyf M. The oncoprotein Set/TAF-1beta, an inhibitor of histone acetyltransferase, inhibits active demethylation of DNA, integrating DNA methylation and transcriptional silencing. J Biol Chem. 2002;277:25026-25031. [PubMed] [DOI] |
| 7. | NCCN. National Comprehensive Cancer Network (NCCN) Clinical Practice Guidelines in Oncology. 2006-01; cited 2011-08. Available from: http://www.nccn.org. |
| 8. | Corley DA, Buffler PA. Oesophageal and gastric cardia adenocarcinomas: analysis of regional variation using the Cancer Incidence in Five Continents database. Int J Epidemiol. 2001;30:1415-1425. [PubMed] [DOI] |
| 12. | Sontag E. Protein phosphatase 2A: the Trojan Horse of cellular signaling. Cell Signal. 2001;13:7-16. [PubMed] [DOI] |
| 14. | Janssens V, Goris J, Van Hoof C. PP2A: the expected tumor suppressor. Curr Opin Genet Dev. 2005;15:34-41. [PubMed] [DOI] |
| 15. | Kalev P, Sablina AA. Protein phosphatase 2A as a potential target for anticancer therapy. Anticancer Agents Med Chem. 2011;11:38-46. [PubMed] |
| 16. | 李 天祝, 向 本琼. 蛋白磷酸酶PP2A的结构及其肿瘤抑制因子功能. 生物化学与生物物理进展. 2009;36:133-142. |
| 17. | Eichhorn PJ, Creyghton MP, Bernards R. Protein phosphatase 2A regulatory subunits and cancer. Biochim Biophys Acta. 2009;1795:1-15. [PubMed] |
| 18. | Westermarck J, Hahn WC. Multiple pathways regulated by the tumor suppressor PP2A in transformation. Trends Mol Med. 2008;14:152-160. [PubMed] [DOI] |
| 19. | Junttila MR, Puustinen P, Niemelä M, Ahola R, Arnold H, Böttzauw T, Ala-aho R, Nielsen C, Ivaska J, Taya Y. CIP2A inhibits PP2A in human malignancies. Cell. 2007;130:51-62. [PubMed] [DOI] |
| 21. | Guo H, Reddy SA, Damuni Z. Purification and characterization of an autophosphorylation-activated protein serine threonine kinase that phosphorylates and inactivates protein phosphatase 2A. J Biol Chem. 1993;268:11193-11198. [PubMed] |
| 22. | Brautigan DL. Flicking the switches: phosphorylation of serine/threonine protein phosphatases. Semin Cancer Biol. 1995;6:211-217. [PubMed] [DOI] |
| 23. | Favre B, Zolnierowicz S, Turowski P, Hemmings BA. The catalytic subunit of protein phosphatase 2A is carboxyl-methylated in vivo. J Biol Chem. 1994;269:16311-16317. [PubMed] |
| 24. | Li L, Sengupta A, Haque N, Grundke-Iqbal I, Iqbal K. Memantine inhibits and reverses the Alzheimer type abnormal hyperphosphorylation of tau and associated neurodegeneration. FEBS Lett. 2004;566:261-269. [PubMed] [DOI] |
| 25. | Li M, Makkinje A, Damuni Z. Molecular identification of I1PP2A, a novel potent heat-stable inhibitor protein of protein phosphatase 2A. Biochemistry. 1996;35:6998-7002. [PubMed] [DOI] |
| 26. | Gantier R, Gilbert D, Dumanchin C, Campion D, Davoust D, Toma F, Frébourg T. The pathogenic L392V mutation of presenilin 1 decreases the affinity to glycogen synthase kinase-3 beta. Neurosci Lett. 2000;283:217-220. [PubMed] [DOI] |
| 27. | Tanimukai H, Grundke-Iqbal I, Iqbal K. Inhibitors of protein phosphatase-2A: topography and subcellular localization. Brain Res Mol Brain Res. 2004;126:146-156. [PubMed] [DOI] |
| 28. | Switzer CH, Cheng RY, Vitek TM, Christensen DJ, Wink DA, Vitek MP. Targeting SET/I(2)PP2A oncoprotein functions as a multi-pathway strategy for cancer therapy. Oncogene. 2011;30:2504-2513. [PubMed] [DOI] |
| 29. | Ozbek U, Kandilci A, van Baal S, Bonten J, Boyd K, Franken P, Fodde R, Grosveld GC. SET-CAN, the product of the t(9; 9) in acute undifferentiated leukemia, causes expansion of early hematopoietic progenitors and hyperproliferation of stomach mucosa in transgenic mice. Am J Pathol. 2007;171:654-666. [PubMed] [DOI] |
| 30. | Fan Z, Beresford PJ, Oh DY, Zhang D, Lieberman J. Tumor suppressor NM23-H1 is a granzyme A-activated DNase during CTL-mediated apoptosis, and the nucleosome assembly protein SET is its inhibitor. Cell. 2003;112:659-672. [PubMed] [DOI] |
| 31. | Christensen DJ, Ohkubo N, Oddo J, Van Kanegan MJ, Neil J, Li F, Colton CA, Vitek MP. Apolipoprotein E and peptide mimetics modulate inflammation by binding the SET protein and activating protein phosphatase 2A. J Immunol. 2011;186:2535-2542. [PubMed] [DOI] |
| 32. | Zhang P, Compagnone NA, Fiore C, Vigne JL, Culp P, Musci TJ, Mellon SH. Developmental gonadal expression of the transcription factor SET and its target gene, P450c17 (17alpha-hydroxylase/c17,20 lyase). DNA Cell Biol. 2001;20:613-624. [PubMed] [DOI] |