修回日期: 2011-08-05
接受日期: 2011-08-12
在线出版日期: 2011-08-18
目的: 检测染色质重构复合物核心催化亚基(Brg1)及VEGF信号通路相关蛋白在Peutz-Jeghers综合征(PJS)中的表达, 探讨其与PJS息肉发生发展的关系.
方法: 应用免疫组织化学染色技术分析72枚PJS息肉、12例正常小肠黏膜及30例小肠癌中Brg1、VEGF、COX-2蛋白的表达和分布, 比较其在三种组织表达程度的差异.
结果: Brg1、VEGF、COX-2在小肠腺癌组织中的阳性表达率明显高于PJS息肉组织和正常小肠黏膜组织(Brg1: 76.67% vs 54.17%, 16.67%; VEGF: 80.00% vs 58.33%, 8.33%; COX-2: 83.33% vs 62.50%, 25.00%, 均P<0.01). PJS息肉组织中Brg1与VEGF蛋白表达率呈显著正相关(χ2 = 15.734, r = 0.467), 与COX-2蛋白表达率呈正相关(χ2 = 7.552, r = 0.324).
结论: 在PJS息肉中Brg1及VEGF信号通路可能参与了PJS的发生, 并且是其癌变的重要因素之一.
引文著录: 刘金霞, 周平, 胡志民, 毛高平. Brg1及VEGF信号通路相关蛋白在Peutz-Jeghers综合征中的表达及意义. 世界华人消化杂志 2011; 19(23): 2461-2466
Revised: August 5, 2011
Accepted: August 12, 2011
Published online: August 18, 2011
AIM: To detect the expression of brahma-related gene 1 (Brg1), vascular endothelial growth factor (VEGF) and cyclooxygenase 2 (COX-2) proteins in Peutz-Jeghers syndrome (PJS) and to analyze their clinical significance.
METHODS: Immunohistochemistry was used to detect the expression of Brg1, VEGF and COX-2 proteins in 72 PJS samples, 12 normal small intestinal mucosal tissue samples and 30 cancer tissue samples.
RESULTS: The positive rates of Brg1, VEGF and COX-2 expression were significantly higher in PJS than in normal mucosal tissue (54.17% vs 16.67%, 58.33% vs 8.33%, 62.50% vs 25.00%, all P < 0.01) and in cancer tissue than in PJS (76.67% vs 54.17%, 80.00% vs 58.33%, 83.33% vs 62.50% all P < 0.01). In PJS, positive correlations were found between Brg1 and VEGF expression and between Brg1 and COX-2 expression.
CONCLUSION: Brg1, VEGF and COX-2 may play a role in the occurrence of PJS.
- Citation: Liu JX, Zhou P, Hu ZM, Mao GP. Expression of Brg1, VEGF and COX-2 in Peutz-Jeghers syndrome. Shijie Huaren Xiaohua Zazhi 2011; 19(23): 2461-2466
- URL: https://www.wjgnet.com/1009-3079/full/v19/i23/2461.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i23.2461
Peutz-Jeghers综合征(Peutz-Jeghers syndrome, PJS)是一种常染色体显性遗传疾病, 以多发性胃肠道错构瘤性息肉和皮肤黏膜黑色素沉着为特征, 因此又称黑斑息肉综合征和色素沉着综合征[1]. PJS患者息肉多发生于小肠, 病理特征常以错构瘤为主合并其他病理类型, 是发生肠道和肠道外肿瘤的危险因素, 可合并多种恶性肿瘤[2]. PJS患者息肉多发、频发是困扰临床医生的主要问题, 同时为患者和家属带来了沉重的精神和经济负担, 所以PJS的致病因素成为我们研究的热点. 多数研究认为PJS的发生是由STK11基因突变所致, 其在PJS家系患者中的突变率为70%, 散发病例中为30%-67%[3]. 近年来, 关于PJS发病机制的研究中, 染色质重构复合物核心催化亚基(brahma-related gene 1, Brg1)有可能参与了PJS的发生发展[4], Brg1作为染色质重构复合物的重要成员之一, 他在基因调控、细胞因子应答、肿瘤发生、发育和分化过程中起重要作用[5], 但与PJS的关系尚不明确; 而血管内皮生长因子(vascular endothelial growth factor, VEGF)信号通路可能是PJS发展过程中的关键通路之一; 因此, 我们用免疫组织化学方法研究Brg1, VEGF和环氧合酶-2(cyclooxygenase-2, COX-2)在正常小肠黏膜组织、PJS息肉组织和小肠癌组织中的表达情况, 阐明其与PJS发生发展及其癌变的关系, 为PJS的治疗和预防提供一定的参考依据.
收集中国人民解放军空军总医院60例PJS患者2005-02/2010-09归档的病理蜡块标本72枚, 所有切片标本均经组织病理学证实. 男35例, 女25例, 年龄10-49(平均24.1±7.9)岁. 同时选取小肠腺癌组织30例和正常小肠黏膜组织12例作为实验对照组. 试剂采用兔抗人Brg1多克隆抗体(工作浓度1∶100)购自北京博奥森生物公司, 兔抗人VEGF、COX-2多克隆抗体购自福州迈新生物公司为工作液. 免疫组织化学试剂盒为北京中杉生物制剂有限公司.
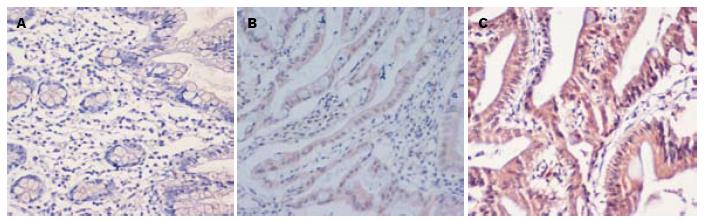
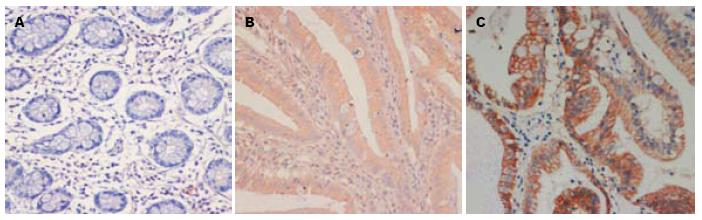
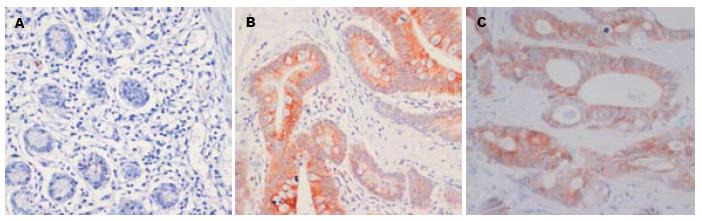
所有标本均经40 g/L甲醛固定, 常规脱水、透明、渗蜡、包埋, 4 μm厚连续切片. 常规脱蜡、水化, 采用免疫组织化学染色法(SP法), DAB显色, 苏木素复染, 吹干, 具体实验步骤按试剂盒说明书进行. 阴性对照采用生理盐水磷酸盐缓冲液(PBS)代替一抗, 以博奥森公司提供的大鼠心肌细胞阳性片作阳性对照. 操作严格按照产品说明书进行. 评判标准: (1)Brg1: 染色阳性细胞为细胞核呈棕黄色至深褐色, 部分细胞质同时为µ黄色和/或黄色, 若只有细胞质着色, 可视为阴性; (2)VEGF: 染色阳性细胞为细胞质或细胞核着色呈黄色或棕黄色; (3)COX-2染色阳性细胞为细胞质着色呈棕黄色或褐色. 其中Brg1阳性细胞<25%为阴性; 25%-50%为弱阳性(+), 51%-75%为中等阳性(++), >75%为强阳性(+++); COX-2、VEGF以阳性细胞数超过10%作为阳性表达诊断标准, 再根据阳性反应强度分为弱阳性(+)、中度阳性(++)和强阳性(+++); 每个指标均有两位以上病理医师进行双盲阅片.
统计学处理 应用SPSS17.0软件进行统计分析, 组间差别采用四格表χ2检验. P<0.05为差异有统计学意义.
Brg1在正常小肠黏膜组织、PJS息肉组织和小肠腺癌组织中阳性表达率分别为16.67%, 54.17%和76.67%, 3组间两两比较, 差异均有统计学意义(P<0.01); VEGF在正常小肠黏膜组织、PJS息肉组织和小肠癌组织中阳性表达率分别为80.00%, 58.33%和8.33%, 3组间两两比较, 差异均有统计学意义(P<0.01); COX-2在正常小肠黏膜组织、PJS息肉组织和小肠癌组织中阳性表达率分别为83.33%, 62.50%和25.00%, 3组间两两比较, 差异均有统计学意义(P<0.01).
在PJS息肉组织中Brg1、VEGF、COX-2蛋白的阳性表达率分别为54.17%, 58.33%, 62.50%, 经相关性分析, Brg1的表达与VEGF表达呈显著正相关(χ2 = 15.734, ρ = 0.467); 与COX-2的表达亦呈正相关(χ2 = 7.552, ρ = 0.324).
PJS患者在临床上常以腹痛、腹胀和消化道出血为主要表现, 主要因肠道息肉多发导致肠套叠所致, 本综合征是胃肠道、前列腺、乳腺、子宫和其他器官恶性肿瘤发生的高危因素[6]. 因此, PJS的发病机制和发病原因成为我们研究的热点之一.
目前研究认为PJS主要致病基因为STK11/LKB1基因, 位于19p13.3, 由Jenne等[7]和Hemminki等[8]于1998年分别报道. 随后国内外学者对其致病基因进行不断的探索, 赵喜荣等[9]研究发现FHIT基因突变和丢失可能在PJS的发生和癌变中起到一定的作用. Hearle等[10]对一PJS女婴小肠息肉提取DNA并分析, 发现了t(11; 19)(q13; q13.4)染色体易位. Mehenni等[11]通过对6个家系进行多基因位点连锁分析发现, 其中1个家系的19q13.4区带可能存在PJS致病基因; Marneros等[12]的研究亦在1个PJS家系中检测到定位于19q13.4区带的PJS致病基因, 但具体基因还有待进一步研究明确. 夏欧东等[13]发现随着肿瘤恶性程度的增高Axin蛋白表达逐渐降低, 与组织病理改变呈负相关. 说明Axin表达降低可能是PJS息肉发生的原因, 并可能参与了PJS息肉演变为腺瘤以及进一步癌变的过程. 马娅梅等[14]发现IFITM1有可能成为判断PJS恶变风险的良好标记物. 戴益琛等[15]采用基因芯片技术筛选PJS特异的差异表达基因谱, 发现EPHB4、EPHB3、EPHB1、EFNB2、EFNA1、COL4A1、COL4A2、COL6A3和COL6A2基因可能是PJS特异性相关基因. 蒋建国等[16]对STK13基因进行突变分析发现STK13基因并不是我国PJS患者新的致病基因. 基于上述研究有关PJS的具体发病基因尚不是很明确.
随着研究更进一步的深入, 我们得知在正常机体内Brg1和VEGF信号通路可控制染色体的复制速度和血管的迅速生成, 抑制上皮细胞过度生长, 其信号通路又参与促进血管生成, 促进生成核转移的恶性机制[17]. 而在PJS的息肉发生发展中LKB1和Brg1有关[18], Brg1是20世纪90年代初在酿酒酵母中被发现的一种抑癌基因, 是SWI/SNF家族的重要组成成分, 定位于人类染色体19p13上[19], 其mRNA长约5 247 bp, 基因编码的蛋白质相对分子质量为2.05×105 Da. Brg1具有ATP依赖的解螺旋酶活性, 在SWI1-SNF2的核染色质改造功能中发挥着重要作用, 同时也是许多基因复制所必需的蛋白之一[20], 在肺癌的发生中位于19p上的抑癌基因Brg1和LKB1基因起着同样的作用[21]. 国内外研究还发现Brg1基因在前列腺癌、宫颈癌及胃癌组织中存在高表达, 而在肺癌组织、喉鳞状细胞癌及多种肿瘤细胞系中表达下调或缺失[22-28]. 证明Brg1在肿瘤的发生发展过程中起着非常重要的作用, 本实验通过对不同组织中蛋白表达的检测发现Brg1随着肿瘤恶性程度的高低呈逐渐下降趋势, 即表明Brg1在PJS息肉组织中存在高表达, 且可能是PJS息肉发生发展及恶变的关键蛋白.
VEGF是1989年从牛垂体滤泡星状细胞培养液首先纯化出来[29], 并发现具有促进血管内皮细胞有丝分裂的活性, 被认为是最强的血管形成诱导因子. 对于实体肿瘤的研究证实, 瘤体需要有新生血管供氧及营养支持才能继续生长[30], 而肿瘤细胞却能够产生高水平的VEGF, 与内皮细胞膜受体结合, 激活内皮细胞受体型酪氨酸激酶, 促进内皮细胞的增生和转移,形成新生血管, 肿瘤细胞的无限制生长、繁殖和转移依赖于新生血管的不断支持. PJS息肉的无限制生长与肿瘤细胞的血液供应有关, 其血管新生是肿瘤生长的关键环节.
COX-2是前列腺素合成过程中的一个关键限速酶, 其过度表达可导致前列腺素产物增加, 而前列腺素是许多肿瘤形成的早期共同特点. 此外, 前列腺素合成过程中产生的毒性物质如自由基、活性氧等, 也可使肿瘤细胞的遗传产生不稳定性, 进一步促使其恶变的转化. COX-2在肠道肿瘤、胃癌、乳腺癌、头颈部癌等多种肿瘤组织中高表达, 其通过合成致癌物质、促进肿瘤血管新生、抑制肿瘤细胞凋亡、促进肿瘤黏附和转移等促进肿瘤的发生、发展[31]. McGarrity等[32]的研究证实COX-2在PJS患者错构瘤性息肉中过表达. Rossi等[33]亦发现COX-2在PJS裸鼠模型和PJS患者错构瘤性息肉中的表达增高, 而我们的研究与其报道相符. 亦有报道显示长期大量服用非甾体类消炎药, 其结肠发病率到50%-60%[34], 但尚未在PJS患者中进行评估. 由此可见, COX-2可能成为PJS息肉的治疗靶点, COX-2抑制剂可能成为减小肿瘤体积以及降低PJS患者手术率的有效方法, 但有待于临床进一步证实. 我们的研究结果显示, COX-2主要表达在新生的血管内皮细胞和形成血管的细胞中, 并且COX-2和VEGF表达基本一致, 其增高幅度与肿瘤恶性程度相关. 同时表明COX-2通过影响VEGF参与了肿瘤新生血管的形成.
在我们的研究组PJS息肉组织中Brg1与VEGF、COX-2蛋白阳性表达率分别成正相关(χ2 = 15.734, ρ = 0.467和χ2 = 7.552, ρ = 0.324), 研究证实了Brg1蛋白表达率升高, VEGF信号通路的相关蛋白表达率也相应升高, 信号传递破坏上皮细胞的正常生长, 出现黏膜过度生长, 息肉形成, 提示在PJS息肉形成中, 间质-上皮相互作用能够维持上皮细胞生长.
Brg1作为一种抑癌基因, 其蛋白或mRNA却在小肠癌组织和PJS息肉组织中高表达, 且表达强度以肿瘤恶性程度增加而增强, 分析其原因, 可能与其启动子异常甲基化、基因突变及其转录激活功能异常等因素有关. 此时, 异常表达的基因产物可能已经失去了原有抑癌基因的生物学特性, 即抑癌基因功能丢失或者产生了转录激活的作用.
在本实验中VEGF、COX-2的高表达很可能会促进Brg1蛋白表达的上调, 促进抑癌基因的非正常表达, 使其在PJS息肉组织和小肠癌组织中发生了功能丢失或转录激活作用, 从而失去了原本的抑癌作用, 进而在PJS息肉的发生发展及息肉癌变的过程中起着一定的作用, 为我们判断PJS息肉癌变提供了一个参考; 并且3种因子很可能是PJS息肉发生发展及息肉恶变的关键蛋白, 需进一步实验证实(有关Brg1基因在PJS患者中的突变情况我们将另有文献报道), 同时王石林等对COX-2抑制剂和雷帕霉素预防PJS作为以后研究的新动向对我们亦有一定的启发[35].
Peutz-Jeghers综合征患者息肉易多发生于小肠, 以往因为诊断困难, 报道较少. 近几年随着双气囊小肠镜的临床应用, 解决了小肠疾病诊断和治疗的盲区, 该病报道亦不断增加, 虽然在诊断和治疗上取得了积极的进展, 但PJS的具体发病机制仍未完全明确, 有待进一步研究探索.
颜宏利, 教授, 中国人民解放军第二军医大学遗传学教研室
目前PJS的治疗以发现息肉并摘除为主, 但息肉易复发, 所以研究探索抑制息肉再生长的治疗方法是本文研究的新动向.
赵喜荣等研究发现FHIT基因突变和丢失可能在PJS的发生和癌变中起到一定的作用. Hearle等对一PJS女婴小肠息肉提取DNA并分析, 发现了t(11; 19)(q13; q13.4)染色体易位.
作者利用免疫组织化学检测Peutz-Jeghers综合征Brg1和VEGF等蛋白的表达, 探讨该病的发病机制, 有一定的研究意义.
编辑 李薇 电编 何基才
| 1. | Kopacova M, Tacheci I, Rejchrt S, Bures J. Peutz-Jeghers syndrome: diagnostic and therapeutic approach. World J Gastroenterol. 2009;15:5397-5408. [PubMed] [DOI] |
| 2. | Clements A, Robison K, Granai C, Steinhoff MM, Scalia-Wilbur J, Moore RG. A case of Peutz-Jeghers syndrome with breast cancer, bilateral sex cord tumor with annular tubules, and adenoma malignum caused by STK11 gene mutation. Int J Gynecol Cancer. 2009;19:1591-1594. [PubMed] [DOI] |
| 3. | Kopácová M, Bures J, Ferko A, Tachecí I, Rejchrt S. Comparison of intraoperative enteroscopy and double-balloon enteroscopy for the diagnosis and treatment of Peutz-Jeghers syndrome. Surg Endosc. 2010;24:1904-1910. [PubMed] [DOI] |
| 4. | Alhopuro P, Katajisto P, Lehtonen R, Ylisaukko-Oja SK, Näätsaari L, Karhu A, Westerman AM, Wilson JH, de Rooij FW, Vogel T. Mutation analysis of three genes encoding novel LKB1-interacting proteins, BRG1, STRADalpha, and MO25alpha, in Peutz-Jeghers syndrome. Br J Cancer. 2005;92:1126-1129. [PubMed] [DOI] |
| 5. | Bourgo RJ, Siddiqui H, Fox S, Solomon D, Sansam CG, Yaniv M, Muchardt C, Metzger D, Chambon P, Roberts CW. SWI/SNF deficiency results in aberrant chromatin organization, mitotic failure, and diminished proliferative capacity. Mol Biol Cell. 2009;20:3192-3199. [PubMed] [DOI] |
| 6. | Jenne DE, Reimann H, Nezu J, Friedel W, Loff S, Jeschke R, Müller O, Back W, Zimmer M. Peutz-Jeghers syndrome is caused by mutations in a novel serine threonine kinase. Nat Genet. 1998;18:38-43. [PubMed] [DOI] |
| 7. | Hemminki A, Markie D, Tomlinson I, Avizienyte E, Roth S, Loukola A, Bignell G, Warren W, Aminoff M, Höglund P. A serine/threonine kinase gene defective in Peutz-Jeghers syndrome. Nature. 1998;391:184-187. [PubMed] [DOI] |
| 8. | 赵 喜荣, 康 连春, 周 永双, 贾 义星, 陈 竹, 康 素海, 李 文梅, 赵 敏, 崔 建涛, 孙 安乐. Peutz-Jeghers综合征脆性组氨酸三连体基因突变与癌变的关系. 癌症. 2003;22:50-54. |
| 9. | Hearle N, Lucassen A, Wang R, Lim W, Ross F, Wheeler R, Moore I, Shipley J, Houlston R. Mapping of a translocation breakpoint in a Peutz-Jeghers hamartoma to the putative PJS locus at 19q13.4 and mutation analysis of candidate genes in polyp and STK11-negative PJS cases. Genes Chromosomes Cancer. 2004;41:163-169. [DOI] |
| 10. | Mehenni H, Blouin JL, Radhakrishna U, Bhardwaj SS, Bhardwaj K, Dixit VB, Richards KF, Bermejo-Fenoll A, Leal AS, Raval RC. Peutz-Jeghers syndrome: confirmation of linkage to chromosome 19p13.3 and identification of a potential second locus, on 19q13.4. Am J Hum Genet. 1997;61:1327-1334. [PubMed] [DOI] |
| 11. | Marneros AG, Mehenni H, Reichenberger E, Antonarakis SE, Krieg T, Olsen BR. Gene for the human transmembrane-type protein tyrosine phosphatase H (PTPRH): genomic structure, fine-mapping and its exclusion as a candidate for Peutz-Jeghers syndrome. Cytogenet Cell Genet. 2001;92:213-216. [PubMed] [DOI] |
| 16. | Derynck R, Akhurst RJ, Balmain A. TGF-beta signaling in tumor suppression and cancer progression. Nat Genet. 2001;29:117-129. [PubMed] [DOI] |
| 17. | Marignani PA, Kanai F, Carpenter CL. LKB1 associates with Brg1 and is necessary for Brg1-induced growth arrest. J Biol Chem. 2001;276:32415-32418. [PubMed] [DOI] |
| 18. | Wong AK, Shanahan F, Chen Y, Lian L, Ha P, Hendricks K, Ghaffari S, Iliev D, Penn B, Woodland AM. BRG1, a component of the SWI-SNF complex, is mutated in multiple human tumor cell lines. Cancer Res. 2000;60:6171-6177. [PubMed] |
| 19. | Baas AF, Smit L, Clevers H. LKB1 tumor suppressor protein: PARtaker in cell polarity. Trends Cell Biol. 2004;14:312-319. [PubMed] [DOI] |
| 20. | Rodriguez-Nieto S, Sanchez-Cespedes M. BRG1 and LKB1: tales of two tumor suppressor genes on chromosome 19p and lung cancer. Carcinogenesis. 2009;30:547-554. [PubMed] [DOI] |
| 25. | 崔 香艳, 汪 欣, 陈 玮伦, 于 红, 黄 可新, 祝 威. Brg1在喉鳞状细胞癌组织中的表达及意义. 吉林大学学报(医学版). 2010;36:546-549. |
| 26. | Sentani K, Oue N, Kondo H, Kuraoka K, Motoshita J, Ito R, Yokozaki H, Yasui W. Increased expression but not genetic alteration of BRG1, a component of the SWI/SNF complex, is associated with the advanced stage of human gastric carcinomas. Pathobiology. 2001;69:315-320. [DOI] |
| 27. | Reisman DN, Sciarrotta J, Wang W, Funkhouser WK, Weissman BE. Loss of BRG1/BRM in human lung cancer cell lines and primary lung cancers: correlation with poor prognosis. Cancer Res. 2003;63:560-566. [PubMed] |
| 30. | Cao Y, Prescott SM. Many actions of cyclooxygenase-2 in cellular dynamics and in cancer. J Cell Physiol. 2002;190:279-286. [PubMed] [DOI] |
| 31. | McGarrity TJ, Peiffer LP, Amos CI, Frazier ML, Ward MG, Howett MK. Overexpression of cyclooxygenase 2 in hamartomatous polyps of Peutz-Jeghers syndrome. Am J Gastroenterol. 2003;98:671-678. [PubMed] [DOI] |
| 32. | Rossi DJ, Ylikorkala A, Korsisaari N, Salovaara R, Luukko K, Launonen V, Henkemeyer M, Ristimaki A, Aaltonen LA, Makela TP. Induction of cyclooxygenase-2 in a mouse model of Peutz-Jeghers polyposis. Proc Natl Acad Sci U S A. 2002;99:12327-12332. [PubMed] [DOI] |