修回日期: 2011-08-16
接受日期: 2011-08-17
在线出版日期: 2011-08-18
目的: 探讨醋酸铅对人肝细胞系L-02细胞凋亡与caspase-3表达的关系.
方法: 不同浓度(0、2.5、40、100、200、400 μmol/L)的醋酸铅处理的L-02细胞24 h及(或)48 h后, MTT法观察L-02细胞生长的影响, Hoechest33258染色法观察细胞凋亡形态学变化, RT-PCR和Western blot法观察caspase-3的表达.
结果: 24 h及48 h后与对照组比较, 醋酸铅能明显抑制细胞的增殖(24 h: 0.4678±0.0438, 0.4686±0.0733, 0.4500±0.0712, 0.4244±0.0407, 0.3998±0.0499 vs 0.5234±0.0589; 48 h: 0.4290±0.0607, 0.4184±0.0296, 0.4032±0.0499, 0.3856±0.0386, 0.3750±0.0149 vs 0.5300±0.0397, P<0.05或0.01). 48 h后各实验组Hoechest33258染色, 细胞呈凋亡形态学改变; 与对照组比较, caspase-3 mRNA的表达明显升高, 呈明显的剂量-效应关系(1.0912±0.0769, 1.2874±0.144, 1.4536±0.1046, 1.6986±0.1371, 1.9882±0.0925 vs 0.8438±0.0933, P<0.01), caspase-3蛋白质水平表达升高.
结论: 醋酸铅能有效抑制L-02细胞的增殖, 并诱导其凋亡, 其机制可能与caspase-3活化有关.
引文著录: 邢伟, 李胜联, 陈兆夷. 醋酸铅诱导人肝细胞系L-02细胞凋亡与caspase-3表达关系的影响. 世界华人消化杂志 2011; 19(23): 2426-2431
Revised: August 16, 2011
Accepted: August 17, 2011
Published online: August 18, 2011
AIM: To investigate the impact of lead acetate on cell apoptosis and caspase-3 expression in human liver cell line L-02.
METHODS: After L-02 cells were treated with different concentrations (0, 2.5, 40, 100, 200, 400 μmol/L) of lead acetate for 24 or 48 h, the proliferation of L-02 cells was assayed by MTT assay; cell morphological changes were observed after Hoechest33258 staining; and the expression of caspase-3 mRNA and protein was determined by RT-PCR and Western blot.
RESULTS: Compared to the normal control group, the proliferation of L-02 cells was significantly inhibited after treatment with different concentrations of lead acetate for 24 or 48 h (24 h: 0.4678 ± 0.0438, 0.4686 ± 0.0733, 0.4500 ± 0.0712, 0.4244 ± 0.0407, 0.3998 ± 0.0499 vs 0.5234 ± 0.0589; 48 h: 0.4290 ± 0.0607, 0.4184 ± 0.0296, 0.4032 ± 0.0499, 0.3856 ± 0.0386, 0.3750 ± 0.0149 vs 0.5300 ± 0.0397, all P < 0.05 or 0.01). Significant morphological changes were noted in cells treated with lead acetate for 48 h. Compared to the normal control group, the levels of caspase-3 mRNA increased significantly in a dose-dependent manner in L-02 cells treated with lead acetate (1.0912 ± 0.0769, 1.2874 ± 0.144, 1.4536 ± 0.1046, 1.6986 ± 0.1371, 1.9882 ± 0.0925 vs 0.8438 ± 0.0933, all P < 0.01). Additionally, the expression levels of caspase-3 protein also significantly increased after treatment with lead acetate.
CONCLUSION: Lead acetate inhibits proliferation and induces apoptosis of L-02 cells possibly via a mechanism associated with the activation of caspase-3.
- Citation: Xing W, Li SL, Chen ZY. Lead acetate induces cell apoptosis and promotes caspase-3 expression in human liver cell line L-02. Shijie Huaren Xiaohua Zazhi 2011; 19(23): 2426-2431
- URL: https://www.wjgnet.com/1009-3079/full/v19/i23/2426.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i23.2426
随着现代工业的发展, 铅的使用越来越广泛, 对环境和人群健康的危害也越来越大, 慢性铅暴露已成为一个全球性的公共卫生问题[1]. 流行病学调查显示, 在职业人群中慢性铅中毒居职业中毒的首位. 凋亡(apoptosis)是指细胞在基因控制和酶促反应下的一种程序性死亡, 是机体维持自身稳定的一种基本生理机制[2-5]. caspase-3是细胞凋亡的蛋白酶级联反应的必经之路[6]. 研究表明, 铅可通过活化caspase-3诱导肾小管上皮细胞凋亡[7]. 而铅所诱导的肝细胞凋亡与caspase-3表达的关系, 未见报道. 为此, 我们进行了研究, 现将结果报道如下.
醋酸铅(天津凯通); 正常人肝细胞系(L-02)(南方医科大学细胞库); 胎牛血清(杭州四季青); DMEM高糖培养基(美国Gibcol); 胰蛋白酶、噻唑蓝(美国Sigma); 二甲基亚砜(DMSO)(杭州双林); Hoechest33258染色试剂盒(德国Merck); TRIzol试剂(美国Gibcol); 达辉RT-PCR反应体系(广州达晖); 达安基因实验伴侣(广州达安); 低熔点琼脂糖(西班牙); caspase-3及硝酸甘油醛脱氢酶(GAPDH)引物序列及目的基因长度(上海英骏); Rabbit Anti-caspase-3(P11, 武汉博士德); 二抗(北京中杉); 蛋白酶抑制剂(美国Amresco); Western blot发光剂(武汉博士德); 硝酸纤维素膜(上海闪晶); 其余试剂均为市售分析纯. 倒置相差光学显微镜、倒置荧光显微镜(日本Olympus); 低温高速离心机(德国Eppendorf); 电泳仪(北京六一); 捷达801凝胶成像分析系统(广州达辉); ABI9700扩增仪(美国).
1.2.1 细胞培养及形态学观察: L-02细胞用含15 mL/L胎牛血清的DMEM高糖培养基在37 ℃、50 mL/L CO2的湿化培养箱中培养, 每2 d换液1次, 每3 d传代1次. 实验所用细胞均处于对数生长期. 细胞传代过夜后, 进行醋酸铅干预, 参照醋酸铅研究文献[7], 使其终浓度(0、2.5、40、100、200、400 μmol/L), 对照组加入相应体积的PBS. 处理24 h及48 h后, 倒置相差显微镜下观察细胞生长情况.
1.2.2 MTT比色试验法: 取对数生长期细胞, 胰酶消化后收集细胞悬液, 按4×103/孔接种于两块96孔的培养板中, 补足培养基至200 μL/孔. 在37 ℃、50 mL/L CO2条件下过夜后, 醋酸铅干预后使其终浓度为(2.5、40、100、200、400 μmol/L), 对照组加入相应体积的磷酸盐缓冲液(PBS), 每组设5个复孔. 染毒后两块板分别继续培养24及48 h后, 每孔加入20 μL MTT(5 g/L)后继续培养4 h, 弃去培养基, 每孔加入150 μL DMSO溶剂, 在酶标仪于490 nm处读取吸光度(A)值. 计算抑制率(%) = (对照组A值-醋酸铅组A值)/对照组A值×100%.
1.2.3 Hoechst33258荧光染色法: 收集细胞按1×106/mL浓度接种于6孔板中, 每孔3 mL, 待细胞基本铺满孔底后, 分别加入醋酸铅, 使其终浓度为(2.5、40、100、200、400 μmol/L), 对照组加入相应体积的PBS. 干预48 h后, 弃培养液, 加入1 mL多聚甲醛固定30 min, 用PBS洗3遍, 取5 μL染色浓缩液和0.5 mL的染色稀释液混合后加入染色, 37 ℃避光15 min, 荧光显微镜下观察、照相.
1.2.4 RT-PCR检测caspase-3 mRNA的表达: 醋酸铅干预48 h后, 弃去培养基, 每瓶细胞加入1 mL TRIzol冰上孵育10 min, 将消化液转移至灭菌的1.5 mL的EP管中, 再加入200 μL的氯仿, 混匀冰上孵育10 min, 4 ℃ 12 000 r/min离心10 min, 取上清液转移至新的EP管中, 加入等体积的异丙醇, 颠倒混匀冰上孵育10 min, 4 ℃ 12 000 r/min离心5 min, 弃上清, 加入1 mL 750 mL/L乙醇洗涤RNA沉淀, 4 ℃ 8 500 r/min离心5 min, 弃上清, 待沉淀干燥后溶于40 μL焦碳酸二乙酯(DEPC)水中. 按以下比例配制逆转录体系: 5×逆转录Buffer 4 μL, dNTP(10 mmol/μL)0.2 μL, 逆转录酶(200 U/μL)1 μL, F(10 pm/μL) 0.4 μL, R(10 pm/μL)0.4 μL, DEPC水9 μL, RNA模板5 μL, 总体积20 μL, 37 ℃恒温1 h, 然后95 ℃, 3 min灭活, 将逆转录产物放-20 ℃冰箱备用. caspase-3的cDNA序列设计特异性引物上游为5'-ACATCTCCCGGCGGCGGGCCCGGA-3', 下游为5'-TCCGCGGCCCGCCGCCGGGAGATGT-3', 产物大小为437 bp. 内参GAPDH引物序列上游为5'-AACGTGTCAGTGGTGGACCT-3', 下游为5'-AGGGGAGATTCAGTGTGGTG-3', 产物大小为400 bp. PCR扩增按以下比例配制PCR反应体系: 5×定性Buffer 10 μL, dNTP(10 mmol/μL)1 μL, Taq酶(5 U/μL)1 μL, F(10 pm/μL)1 μL, R(10 pm/μL)1 μL, 纯水31 μL, 模板5 μL, 总体积50 μL, 94 ℃ 4 min预变性, 然后95 ℃ 30 s, 54 ℃ 45 s, 72 ℃ 45 s运行35个Ñ环, 最后72 ℃延伸8 min, 4 ℃保存. 用2%琼脂糖凝胶100 V×30 min电泳, 扫描存盘. 用捷达801凝胶成像分析系统中进行灰度扫描, 目的基因mRNA表达量 = 每例标本目的基因的平均灰度值/同一标本GAPDH的平均灰度值.
1.2.5 Western blot检测caspase-3蛋白质的表达: 醋酸铅干预48 h后收集细胞, 用冷PBS洗涤2次后, 加入细胞裂解液, 冰上裂解45 min, 4 ℃ 12 000 r/min离心20 min, 取上清于新的EP管中, 用考马斯亮蓝染色法测定蛋白浓度. 每孔蛋白定量为50 μg, 加入2×SDS凝胶加样缓冲液混合均匀, 沸水水浴5 min, 配置12%的SDS-聚丙烯酰胺(PAGE)分离胶和5%的浓缩胶, 样品加入上样孔底, 60 V, 电泳30 min, 至样品进入分离胶后, 120 V, 电泳1 h后转移至磷酸纤维素膜上, 丽春红染色观察转移效果. 置膜于5%脱脂奶粉的TBST[10 mmol/L Tris(pH7.4), 150 mmol/L NaCl, 0.1% Tween 20]封闭缓冲液1 h, 室温缓慢摇动. 按1∶500加入一抗, 室温孵育1 h, 缓慢摇动, TBST洗膜3次, 按 1∶2 000加入辣根过氧化物酶标记的二抗, 室温孵育1 h, 缓慢摇动, TBST洗膜3次, 在暗室中与化学发光剂ECL 反应, X线胶片曝光显影.
统计学处理 运用SPSS17.0统计软件进行统计学分析, 多组间比较采用单因素方差分析(One-way ANOVA), 组间比较采用q检验.
对照组细胞, 24及48 h后形态上均无明显变化, 呈贴壁生长, 细胞呈梭形或多边形; 实验组细胞, 24 h后黄染、突起、皱缩、变圆, 细胞轮廓不清, 少数细胞漂浮于培养基中, 48 h后, 较多细胞漂浮, 并已开始崩解.
各组细胞A值及抑制率见表1. 24及48 h后, 各实验组间A值均有统计学差异, 并呈现明显的剂量-效应关系.
| 分组 | 24 h | 48 h | ||
| A值 | 抑制率(%) | A值 | 抑制率(%) | |
| 对照组 | 0.5234±0.0589 | 0.00 | 0.5300±0.0397 | 0.00 |
| 2.5 μmol/L组 | 0.4678±0.0438 | 9.97 | 0.4290±0.0607a | 11.81 |
| 40 μmol/L组 | 0.4686±0.0733 | 10.47 | 0.4184±0.0296b | 21.06 |
| 100 μmol/L组 | 0.4500±0.0712 | 14.02 | 0.4032±0.0499b | 23.92 |
| 200 μmol/L组 | 0.4244±0.0407a | 18.91 | 0.3856±0.0386b | 27.25 |
| 400 μmol/L组 | 0.3998±0.0499b | 23.61 | 0.3750±0.0149b | 29.24 |
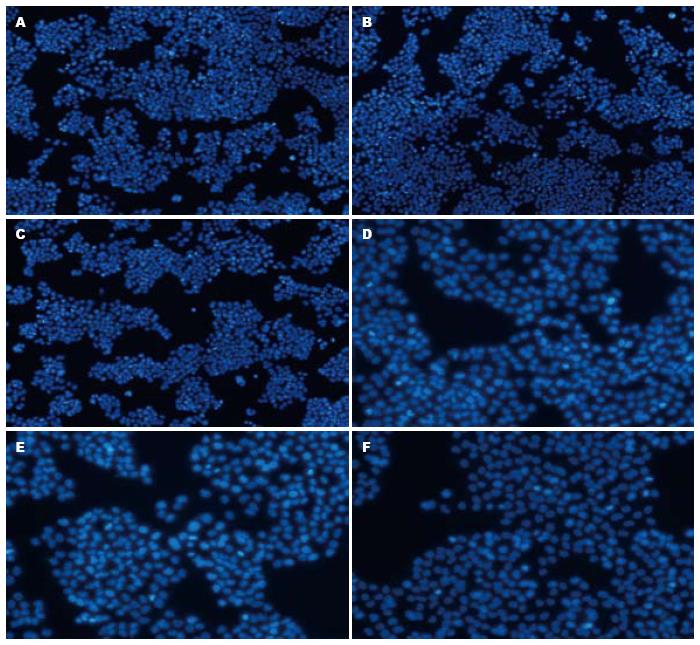
对照组细胞核完整、染色均匀一致. 48 h后, 2.5、40 μmol/L组部分细胞核染色加深呈高亮蓝色、模糊、核明显固缩, 100、200、400 μmol/L组细胞有大量细胞核浓染、固缩、核碎裂(图1).
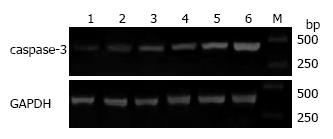
RT-PCR结果显示不同浓度的实验组caspase-3 mRNA的转录水平较对照组明显升高, 且呈剂量-效应关系(图2). 灰度扫描结果表明, caspase-3 mRNA 的相对表达量增加, 差异有统计学意义(F = 69.687, P<0.01). caspase-3 mRNA与GAPDH mRNA灰度比值: 2.5 μmol/L: 1.0912±0.0769; 40 μmol/L: 1.2874±0.144; 100 μmol/L: 1.4536±0.1046; 200 μmol/L: 1.6986±0.1371; 400 μmol/L: 1.9882±0.0925; 对照组: 0.8438±0.0933, n = 5. 与对照组比较, 各实验组明显增高(P<0.01).
蛋白免疫印迹胶片扫描图(图3), 从图中可以看到不同浓度醋酸铅作用L-02细胞48 h后caspase-3及内参GAPDH表达的改变. 结果显示实验组caspase-3蛋白水平较对照组明显升高.
铅是一种广泛存在于自然界的人体非必需元素, 可对多个系统造成损伤, 主要累及神经、造血、心血管、消化、泌尿和免疫系统[8]. 王涤新等[9]报道了职业性接触铅烟尘, 可导致铅中毒. 临床上职业性铅中毒多为慢性中毒, 肝脏作为铅的主要蓄积部位, 是铅毒性的主要靶器官之一.
细胞凋亡[10,11]作为细胞死亡的方式之一, 是通过一系列死亡信号分子活化而导致的主动性死亡过程. 其发生机制与细胞内信号转导系统所引起的基因调控有关. 细胞凋亡的机制尚不完全清楚, 认为细胞内所发生的与凋亡有关的一系列有序的级联反应, 关键是激活了一组被称为caspase的蛋白酶[12]. caspase是一组天冬氨酸特异性半胱氨酸蛋白酶, 目前已发现14个成员, 在细胞凋亡过程中根据caspase的作用不同, 研究者将caspase分为始动caspase和执行caspase, 前者包括caspase-8、caspase-9、caspase-10, 后者包括caspase-3、caspase-6、caspase-7. 其中caspase-3是最关键的蛋白酶, 不仅是凋亡的关键执行者[13], 也是细胞凋亡过程中的主要效应因子, 其表达量的上调可能与铅诱导凋亡有关. 在正常情况下, caspase-3以无活性的caspase-3酶原形式存在, 只有当细胞发生凋亡时才变成有活性的caspase-3. 而活化的caspase-3能裂解大量底物, 是凋亡机制的核心成分[14]. 因此许多学者将活化的caspase-3的出现作为细胞凋亡的标志[15]. 大多数凋亡途径均需要通过caspase-3介导, 所有caspase-3又被称为死亡蛋白[16].
近年来, 在铅毒性的研究过程中发现, 细胞凋亡可能起着十分重要的作用. 研究表明, 铅可引起大鼠肾小管上皮细胞凋亡, 机制可能与氧化应激有关[17], 也有学者认为可能与NF-κB、p53基因的激活及bcl-2基因的抑制有关[18], 还有学者认为可能主要通过激活p53而引起DNA损伤, 同时与Bax/Bcl-2表达的不平衡而导致线粒体功能障°有关, 最终引起caspase-3的活化, 导致细胞凋亡[19]. 铅可诱导星形胶质细胞[20]、海马细胞[21]、大鼠脑细胞[22]凋亡, 其机制可能与Bax/Bcl-2比例增高和caspase-3蛋白的表达有关. 有研究表明铅暴露可诱导原代成骨细胞[23]凋亡, 机制可能是通过增加细胞内的钙离子的浓度导致凋亡的发生. 有报道称醋酸铅可引起间质干细胞(mesenchymal stem cells, MSCs)[24]和大鼠肝脏干细胞[16]的凋亡, 认为与caspase的级联反应和细胞外信号调节蛋白激酶的磷酸化直接相关. 铅也可诱导生殖细胞凋亡[25], 机制可能与激活Fas/FasL、Bcl-2水平升高有关. 综上所述, 目前铅可以通过以下5种途径诱导细胞凋亡: (1)氧化应激[26]; (2)Bcl-2/Bax值的改变[27]; (3)依赖P53介导[28]; (4)依赖Fas/FasL途径[25]; (5)经caspase-3蛋白介导[29].
本实验研究发现: 24及48 h后, 与对照组比较, 醋酸铅能明显抑制细胞的增殖(P<0.05或0.01). 细胞凋亡时细胞核染色质浓缩, 细胞膜包裹细胞质和核碎片, 形成大小不一的凋亡小体[30]. 我们应用Hoechest33258染色, 48 h后各实验组细胞形态学呈凋亡改变. PT-PCR结果显示: 实验组caspase-3 mRNA的表达较对照组明显升高, 呈明显的剂量-效应关系(1.0912±0.0769, 1.2874±0.144, 1.4536±0.1046, 1.6986±0.1371, 1.9882±0.0925 vs 0.8438±0.0933, P<0.01). 为验证醋酸铅诱导L-02细胞凋亡机制, 我们检测caspase-3蛋白表达, 结果显示实验组caspase-3蛋白水平明显升高. 因此, 我们推测醋酸铅通过激活caspase-3诱导L-02细胞凋亡.
caspase-3抑制剂可以抑制caspase-3活性, 并抑制铅诱导HK-2细胞凋亡[31]. 铅通过影响caspase-3的活性诱导神经母细胞的凋亡, 而17-β-雌二醇可有效阻断caspase-3活性, 对神经有保护作用[32]. 硫胺素和抗坏血酸能拮抗醋酸铅引起小鼠睾丸的凋亡作用[33], 主要是通过拮抗TGFP和caspase-3表达的提高, 最终引起睾丸细胞凋亡率明显降低. 氧化应激被认为是导致铅的神经毒性的可能机制之一. 铅暴露后, 为防止细胞损伤的有效方法之一是使用抗氧化剂[34]. 有研究发现铅可能通过竞争性结合巯基和钙来影响其改变. 通过组合一种抗氧化剂(如卡托普利)和巯基螯合剂可以为治疗提供新思路[35]. 因此, 临床上可以通过使用caspase-3抑制剂, 拮抗醋酸铅对肝细胞的凋亡作用, 达到治疗铅中毒的目的. 本实验有待于深入研究具体凋亡信号通路, 用于指导临床治疗.
总之, 铅可诱导L-02细胞凋亡, 从而导致肝损伤. 本实验为进一步研究铅引起的肝细胞凋亡作用机制及其对凋亡相关蛋白的影响提供了实验基础, 同时为临床上治疗铅引起的慢性肝损害, 提供了理论依据.
铅是一种广泛存在于自然界的人体非必需元素, 可对多个系统造成损伤. 肝脏作为体内新陈代谢的中心站和重要的解毒器官, 是许多药物、外源性化学物质和氧化性毒物的重要靶点. 慢性铅暴露已成为一个全球性的公共卫生问题.
张志坚, 教授, 福州总医院消化内科; 吴君, 主任医师, 贵州省贵阳市贵阳医学院附属医院感染科
从细胞凋亡角度探讨外来化合物的毒性作用机制是目前分子毒理学研究中的一个热点. 研究表明醋酸铅可诱导星形胶质细胞、成骨细胞、肾小管上皮细胞凋亡. 如能深入研究醋酸铅诱导人肝细胞凋亡及其机制, 将会为治疗提供新的途径和方法.
国内外有关报道提示醋酸铅对多种细胞具有显著的毒性作用. 国内已有的研究证明,铅可通过活化caspase-3, 诱导PC12细胞凋亡.
本研究表明, 醋酸铅可能通过诱导人肝细胞凋亡,导致肝损害. 通过caspase-3途径诱导凋亡可能为其凋亡机制之一.
本文研究了醋酸铅诱导人肝细胞凋亡的有效浓度和剂量关系, 探讨了其毒性作用的分子机制, 为醋酸铅诱导肝细胞凋亡提供了实验基础, 同时为临床上寻找治疗途径提供理论依据.
本文选题有一定的新颖性, 实验数据可靠, 结果客观, 有一定的学术和实际应用价值.
编辑 何基才 电编 何基才
| 1. | van Wijngaarden E, Dosemeci M. Brain cancer mortality and potential occupational exposure to lead: findings from the National Longitudinal Mortality Study, 1979-1989. Int J Cancer. 2006;119:1136-1144. [PubMed] [DOI] |
| 2. | Ji Y, Lu G, Chen G, Huang B, Zhang X, Shen K, Wu S. Microcystin-LR induces apoptosis via NF-κB/iNOS pathway in INS-1 cells. Int J Mol Sci. 2011;12:4722-4734. [PubMed] [DOI] |
| 3. | Shannan B, Seifert M, Leskov K, Willis J, Boothman D, Tilgen W, Reichrath J. Challenge and promise: roles for clusterin in pathogenesis, progression and therapy of cancer. Cell Death Differ. 2006;13:12-19. [PubMed] [DOI] |
| 4. | Hossain MZ, Kleve MG. Nickel nanowires induced and reactive oxygen species mediated apoptosis in human pancreatic adenocarcinoma cells. Int J Nanomedicine. 2011;6:1475-1485. [PubMed] [DOI] |
| 5. | Tamura R, Kanda T, Imazeki F, Wu S, Nakamoto S, Tanaka T, Arai M, Fujiwara K, Saito K, Roger T. Hepatitis C Virus nonstructural 5A protein inhibits lipopolysaccharide-mediated apoptosis of hepatocytes by decreasing expression of Toll-like receptor 4. J Infect Dis. 2011;204:793-801. [PubMed] [DOI] |
| 6. | 姜 子瑜, 华 海清, 杨 爱珍, 秦 叔逵. 复方苦参、奥沙利铂及重组人血管内皮抑素联合对人肝癌细胞株SMMC-7721凋亡的影响. 世界华人消化杂志. 2010;18:3396-3401. [DOI] |
| 9. | 王 涤新, 张 薇. 铅中毒致视神经损害二例. 中华劳动卫生职业病杂志. 2006;24:621-622. |
| 10. | Silva KL, Vasconcellos DV, Castro ED, Vasconcelos FC, Bigni R, Maia RC. Bisphosphonates induce apoptosis in CLL cells independently of MDR phenotype. Cancer Chemother Pharmacol. 2008;62:165-171. [PubMed] [DOI] |
| 11. | Sun W, Wang W, Kim J, Keng P, Yang S, Zhang H, Liu C, Okunieff P, Zhang L. Anti-cancer effect of resveratrol is associated with induction of apoptosis via a mitochondrial pathway alignment. Adv Exp Med Biol. 2008;614:179-186. [PubMed] [DOI] |
| 12. | Gao C, Tsuchida N. Activation of caspases in p53-induced transactivation-independent apoptosis. Jpn J Cancer Res. 1999;90:180-187. [PubMed] [DOI] |
| 16. | Agarwal S, Roy S, Ray A, Mazumder S, Bhattacharya S. Arsenic trioxide and lead acetate induce apoptosis in adult rat hepatic stem cells. Cell Biol Toxicol. 2009;25:403-413. [PubMed] [DOI] |
| 17. | Wang L, Wang H, Hu M, Cao J, Chen D, Liu Z. Oxidative stress and apoptotic changes in primary cultures of rat proximal tubular cells exposed to lead. Arch Toxicol. 2009;83:417-427. [PubMed] [DOI] |
| 18. | Rong J, Chang W, Lv L, Chen J. [Study on the roles of nuclear factor-kappaB, p53 and Bcl-2 gene in lead acetate induced apoptosis in PC12 cells]. Wei Sheng Yan Jiu. 2008;37:262-23, 268. [PubMed] |
| 19. | Xu J, Ji LD, Xu LH. Lead-induced apoptosis in PC 12 cells: involvement of p53, Bcl-2 family and caspase-3. Toxicol Lett. 2006;166:160-167. [PubMed] [DOI] |
| 20. | Rai A, Maurya SK, Khare P, Srivastava A, Bandyopadhyay S. Characterization of developmental neurotoxicity of As, Cd, and Pb mixture: synergistic action of metal mixture in glial and neuronal functions. Toxicol Sci. 2010;118:586-601. [PubMed] [DOI] |
| 21. | Sharifi AM, Mousavi SH, Jorjani M. Effect of chronic lead exposure on pro-apoptotic Bax and anti-apoptotic Bcl-2 protein expression in rat hippocampus in vivo. Cell Mol Neurobiol. 2010;30:769-774. [PubMed] [DOI] |
| 22. | Kiran Kumar B, Prabhakara Rao Y, Noble T, Weddington K, McDowell VP, Rajanna S, Bettaiya R. Lead-induced alteration of apoptotic proteins in different regions of adult rat brain. Toxicol Lett. 2009;184:56-60. [PubMed] [DOI] |
| 23. | Ma Y, Fu D, Liu Z. Effect of lead on apoptosis in cultured rat primary osteoblasts. Toxicol Ind Health. 2012;28:136-146. [PubMed] |
| 24. | Sharifi AM, Ghazanfari R, Tekiyehmaroof N, Sharifi MA. Investigating the effect of lead acetate on rat bone marrow-derived mesenchymal stem cells toxicity: role of apoptosis. Toxicol Mech Methods. 2011;21:225-230. [PubMed] [DOI] |
| 25. | Shan G, Tang T, Zhang X. The protective effect of ascorbic acid and thiamine supplementation against damage caused by lead in the testes of mice. J Huazhong Univ Sci Technolog Med Sci. 2009;29:68-72. [PubMed] [DOI] |
| 26. | Du H, Zhu X, Fan C, Xu S, Wang Y, Zhou Y. Oxidative damage and OGG1 expression induced by a combined effect of titanium dioxide nanoparticles and lead acetate in human hepatocytes. Environ Toxicol. 2012;27:590-597. [PubMed] |
| 27. | Sharifi AM, Mousavi SH. Studying the effects of lead on DNA fragmentation and proapoptotic bax and antiapoptotic bcl-2 protein expression in PC12 cells. Toxicol Mech Methods. 2008;18:75-79. [PubMed] [DOI] |
| 28. | Tousson E, Rafat BM, Hessien M, El Barbary AA, Sami A. P53 and Bcl2 apoptosis proteins in meso-2,3-dimercaptosuccinic acid treated lead-intoxicated rabbits. Toxicol Ind Health. 2011;27:271-278. [PubMed] [DOI] |
| 29. | Liu J, Han D, Li Y, Zheng L, Gu C, Piao Z, Au WW, Xu X, Huo X. Lead affects apoptosis and related gene XIAP and Smac expression in the hippocampus of developing rats. Neurochem Res. 2010;35:473-479. [PubMed] [DOI] |
| 32. | Chetty CS, Vemuri MC, Reddy GR, Suresh C. Protective effect of 17-beta-estradiol in human neurocellular models of lead exposure. Neurotoxicology. 2007;28:396-401. [PubMed] [DOI] |
| 33. | Zhang Y, Wang CH, Liang JC, Zhang C, Wang CQ. [Impacts of combined supplementation with ascorbic acid and thiamine on certain biochemical and morphologic indexes of testes in mice treated by lead]. Wei Sheng Yan Jiu. 2006;35:731-734. [PubMed] |
| 34. | Chen T, Li YY, Zhang JL, Xu B, Lin Y, Wang CX, Guan WC, Wang YJ, Xu SQ. Protective effect of C(60) -methionine derivate on lead-exposed human SH-SY5Y neuroblastoma cells. J Appl Toxicol. 2011;31:255-261. [PubMed] [DOI] |
| 35. | Pachauri V, Saxena G, Mehta A, Mishra D, Flora SJ. Combinational chelation therapy abrogates lead-induced neurodegeneration in rats. Toxicol Appl Pharmacol. 2009;240:255-264. [PubMed] [DOI] |