修回日期: 2011-07-21
接受日期: 2011-08-01
在线出版日期: 2011-08-08
目的: 研究血清胰蛋白酶原-2与胰腺癌的相关性.
方法: 选取中国人民解放军北京军区总医院内、外科诊断为胰腺癌未经治疗的患者23例; 发病<12 h、未经生长抑素治疗的胰腺炎患者30例, 对照组随机选取体检中心健康体检者35人. 入组者留取血清标本, 采用ELISA法定量检测血清胰蛋白酶原-2的含量.
结果: 胰腺癌组患者血清胰蛋白酶原-2中位数为13.8 μg/L, 四分位间距为2.3-60.7 μg/L, 胰腺炎组中位数为82.7 μg/L, 四分位间距为21.45-201.5 μg/L, 对照组中位数为0.8 μg/L, 四分位间距为0.6-1.2 μg/L. 三组间两两比较差异均有统计学意义(P<0.01), 其中胰腺炎组血清胰蛋白酶原最高, 胰腺癌组次之, 均明显高于正常对照组. 以44.05 μg/L为临界值, 此时血清胰蛋白酶原-2鉴别胰腺癌与胰腺炎的敏感度和特异度分别为63.3%和73.9%, ROC曲线下的面积为0.725. 以1.85 μg/L为临界值, 鉴别诊断胰腺癌与健康人的敏感度为91.4%, 特异度为95.7%, ROC曲线下的面积为0.989.
结论: 血清胰蛋白酶原-2与胰腺癌相关, 其含量检测作为一种非侵入性筛选试验, 为临床早期胰腺癌筛查提供了手段.
引文著录: 崔婷婷, 郭汉斌, 李浩然, 马丽, 李冰, 杜囚鹏, 曹建彪. 血清胰蛋白酶原-2对胰腺癌的诊断价值. 世界华人消化杂志 2011; 19(22): 2386-2390
Revised: July 21, 2011
Accepted: August 1, 2011
Published online: August 8, 2011
AIM: To evaluate the significance of serum trypsinogen-2 in the detection of pancreatic cancer.
METHODS: Fresh serum samples were collected from 23 patients with pancreatic cancer, 30 patients with pancreatitis who received no prior treatment with somatostatin, and 35 normal controls. Serum levels of trypsinogen-2 were measured by ELISA.
RESULTS: The median level of serum trypsinogen-2 was significantly higher in patients with pancreatitis and those with pancreatic cancer than in normal controls (82.7 μg/L, 13.8 μg/L vs 0.8 μg/L both P < 0.01). The sensitivity and specificity of detection of serum trypsinogen-2 for differentiation between patients with pancreatic cancer and normal controls were 91.4% and 95.7%, respectively, and the area under the ROC curve was 0.989. The sensitivity and specificity for differentiation between pancreatic cancer and pancreatitis were 63.3% and 73.9%, respectively, and the area under the ROC curve was 0.725.
CONCLUSION: Detection of serum trypsinogen-2 can be used to screen early pancreatic cancer.
- Citation: Cui TT, Guo HB, Li HR, Ma L, Li B, Du QP, Cao JB. Diagnostic value of serum trypsinogen-2 in patients with pancreatic cancer. Shijie Huaren Xiaohua Zazhi 2011; 19(22): 2386-2390
- URL: https://www.wjgnet.com/1009-3079/full/v19/i22/2386.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i22.2386
胰腺癌是一种恶性程度很高的消化系肿瘤, 其发病率在全球范围内逐年升高. 在美国消化系癌症死亡病例居第2位, 癌症总死亡病例中居第4位[1]. 胰腺癌对放化疗敏感度不高, 早期根治性手术切除仍是目前唯一有希望治愈胰腺癌的手段. 但由于大部分胰腺癌确诊时已至中晚期, 尤其是胰体、尾部癌肿, 缺乏胰头部常见的梗阻性黄疸, 直至侵及四周而局部疼痛加重时方能发现, 预后很差(1999-2005年美国胰腺癌病变局限者5年相对生存率约22%, 而伴有远处转移者5年相对生存率仅2%[1]). 因此, 早期诊断是改善预后的关键, 但目前临床仍缺少有效的非侵袭性筛查方法. 此外, 胰头癌和胰头部肿块型慢性胰腺炎不容易鉴别[2], 尚有少数胰腺癌病例以急性胰腺炎为首发表现[3,4], 从而导致了胰腺癌的延误诊治和部分胰腺炎的扩大治疗. 因此, 胰腺癌的早期诊断及其与胰腺炎的鉴别, 均为当前胰腺疾病研究重要课题. 胰蛋白酶原-2, 属于丝氨酸蛋白酶类, 由T-8氨基酸编码, 绝大部分由胰腺腺泡分泌, 以酶原的形式分泌到胰液中. 少数研究报道[5], 胰蛋白酶原(包括胰蛋白酶原-1和胰蛋白酶原-2)表达于胰腺癌癌细胞中, 而有关血清胰蛋白酶原-2与胰腺癌相关性研究鲜有报道. 本研究用ELISA法定量检测胰腺癌、胰腺炎及对照组血清中胰蛋白酶原-2含量, 研究胰蛋白酶原-2与胰腺癌的相关性, 旨在为胰腺癌的筛查及早期诊断提供新的敏感性及特异性较高的无创指标.
收集中国人民解放军北京军区总医院2009-12/2010-06内、外科23例诊断为胰腺癌治疗前的住院患者的血清, 以上患者均有术后病理证实, 未行放化疗. 此外, 收集同时期该院发病<12 h、未经生长抑素治疗的胰腺炎患者血清30例. 随机选取在该院门诊行健康体检的就诊人员35名为正常对照, 入组者均无明显上消化道症状及胰腺疾病病史; 无高血压、糖尿病、高脂血症; 无严重心、肺、肝、肾和神经、精神疾病等; 并排除孕妇、酗酒者、药瘾者. 胰蛋白酶原-2检测试剂盒(由北京永瀚星港生物技术有限公司惠赠), 酶标仪为全自动多功能酶标仪(OLYMUS5421全自动生化分析仪). 本研究经中国解放军北京军区总医院伦理委员会伦理审查批准, 所有受试者均签署知情同意书.
1.2.1 标本收集: 所有入组患者留取空腹静脉全血, 全血标本在采集后于2 ℃-8 ℃冷藏保存<2 d, 离心后取上清液分装后在-70 ℃冻存, 统一检测.
1.2.2 血清胰蛋白酶原-2定量检测: 试验严格按照试剂盒说明书进行. (1)离心: 全血标本经1 000 g离心10 min分离后取血清分装至-70 ℃冻存备用; (2)ELISA检测: 检测前将冻存标本放置于4 ℃冷藏室解冻, 检测当日取出至室温, 常规ELISA操作流程(双抗体夹心法)检测; (3)测定: 标准品包括5个标准品浓度(0、3、10、30、100、300 μg/L),采用全自动多功能酶标仪(OLYMUS5421全自动生化分析仪)及检测统计软件, 分别记录标准品、样品、阳性对照、阴性对照和空白孔的A值, 取平均值进行结果计算和判断.
1.2.3 血清胰蛋白酶原-2鉴别胰腺癌的敏感度和特异度: 应用SPSS16.0软件, 计算鉴别胰腺癌的敏感度和特异度, 绘制受试者工作特征曲线(receiver operating characteristic curve, ROC曲线), 确定诊断找出最佳截断点, 一般取ROC曲线上最左上方的点. 并计算ROC曲线下面积(area under curve, AUC). AUC介于0.5-0.7诊断价值较低, AUC介于0.7-0.9时诊断价值中等, AUC介于0.9-1.0则诊断价值高.
统计学处理 试验数据采用SPSS16.0统计软件进行统计学分析. 计算中位数、四分位数间距、全距, 采用非参数检验Kruskal-Wallis H检验从总体上分析3组间有无差别, 组间多重比较采用Bonferroni法检验校正, P<0.0167具有统计学意义. 计算检测指标的敏感度、特异度, 应用ROC曲线对这些检测指标进行综合评价.
本试验根据影像学及临床表现分为胰腺癌组、胰腺炎组、正常对照组, 3组的性别组成通过卡方检验, 差异无统计学意义(P = 0.62>0.05). 3组实验的年龄组成通过单因素方差分析, 差异无统计学意义(F = 1.93, P = 0.11>0.05). 两组患者组与对照组的年龄, 性别分布差异不明显(表1).
| 分组 | n | 性别(男/女) | 年龄(岁) |
| 胰腺癌 | 23 | 13/10 | 60.39±18.4 |
| 胰腺炎 | 30 | 20/10 | 47.60±19.8 |
| 对照组 | 35 | 19/16 | 44.00±17.4 |
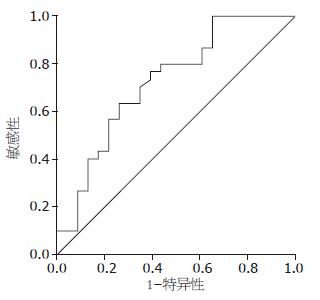
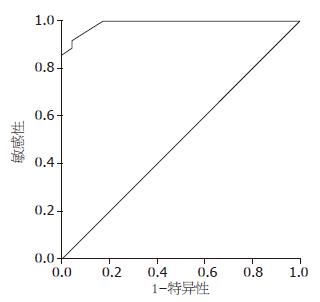
胰腺癌组、胰腺炎组及正常对照组血清胰蛋白酶原-2的浓度差异有统计学意义(P<0.001). 胰腺炎组血清胰蛋白酶原最高, 胰腺癌组次之, 均明显高于正常对照组. 胰腺癌组患者血清明显高于对照组, 差异有统计学意义(P<0.001), 胰腺炎组与胰腺癌组比较差异亦有统计学意义(P<0.01, 表2).
以点SEN 0.943(1-SPE0.087), 为最佳临界点, 其对应的临界值为1.85 μg/L, 曲线下的面积为0.989(95%CI: 0.971-1.007; P<0.001)此时血清胰蛋白酶原-2鉴别胰腺癌与正常人的敏感度和特异度分别为91.4%和95.7%(图1).
以点SEN 0.633(1-SPE0.261), 为最佳临界点, 其对应的临界值为44.05 μg/L, 曲线下的面积为0.725(95%CI: 0.585-0.866; P = 0.005)此时血清胰蛋白酶原-2鉴别胰腺癌与胰腺炎的敏感度和特异度分别为63.3%和73.9%(图2).
胰腺癌是消化系中预后极差的恶性肿瘤, 病死率逾90%, 是发达国家癌症死亡的主要原因之一[6], 发病率近年来逐渐升高, 1999年韩国胰腺癌年龄标准化发病率为5.6/100 000, 2008年上升至6.3/100 000, 年变化百分率为1.7[7]. 我国胰腺癌发病率亦明显上升, 也已经成为我国消化系统肿瘤的主要死亡原因之一. 目前手术治疗是唯一有望治愈胰腺癌的手段, 但术后5年生存率仍然处于很低的水平. 胰腺癌半数以上位于胰头, 约90%起源于腺管上皮, 由于受胰腺解剖学和胰腺癌生物学特征等因素的影响, 胰腺癌早期容易侵犯周围组织器官并发生远处转移, 加之胰腺癌早期无明显、特异的症状和体征, 缺乏简便、可靠的诊断方法, 确诊时多已失去行根治手术的机会. 因此, 进行深入的胰腺癌基础和临床研究, 提高胰腺癌早期诊断、治疗水平和改善患者预后, 是当前胰腺癌研究的重要课题. 通常胰腺癌和急性胰腺炎在临床表现上各有不同, 鉴别较容易. 但是, 有少数特殊类型的胰腺癌以急性胰腺炎为首发表现, 诊断较难, 疗效欠佳. 1996-2006年部分国内期刊报道21例以急性胰腺炎为首发表现的胰腺癌[8], 其中仅1例得到及时诊断, 行胰十二指肠切除术, 术后18 mo, 一般情况正常, 1例明确诊断后失去根治机会, 19例未能及时诊断, 未能完成胰十二指肠切除术, 随访中位生存期为半年. Griñó等[9]认为胰腺癌可以导致胰腺实质的急性炎症, 究其原因在于: (1)肿瘤堵塞主胰管导致胰液排出受阻; (2)肿瘤细胞生长引起局部血管缺血所致胰腺组织坏死; (3)肿瘤组织直接激活胰酶导致炎症. 正因为如此, 在临床诊断急性胰腺炎时也需考虑到胰腺癌的可能.
胰腺癌发生时由于胰腺组织受损, 肿瘤分泌的一些细胞因子或致癌物质可释放至血液中, 理论上检测这些标志物有助于胰腺癌的诊断或筛查, 目前已成为全球研究热点. 胰蛋白酶原-2是一种25 000 Da的蛋白酶, 绝大部分由胰腺腺泡以酶原的形式分泌到胰液中, 并在肠内被肠激酶激活, 变成高活性的其他消化酶的激活剂. 近年来发现, 胰蛋白酶原-2广泛分布在人类的皮肤、消化道、肺、肾、肝和胆道的上皮细胞中[10], 在一些肿瘤细胞或组织中, 胰蛋白酶原-2也有高表达, 如胃癌[11]、结直肠癌[12]、卵巢癌[13]、肺癌[14]、前列腺癌[15]等. 胰蛋白酶原-2可以被自发激活或肿瘤组织分泌的内源性激活物所激活, 如肠激酶等. 胰蛋白酶原-2活化后不仅在细胞外基质的降解上发挥重要作用, 还能作为一种生长刺激因子, 活化蛋白酶激活受体-2(PAR-2), 促进细胞增殖转移, 另外, 在侵袭性生长、重度纤维化的胰腺癌较扩张性生长、轻中度纤维化的胰腺癌细胞中, PAR-2表达更高, 提示PAR-2的活化可能参与人胰腺癌细胞的侵袭和纤维化, 进而促进胰腺癌进展[16]. 胰蛋白酶原-2及蛋白酶激活受体-2在实体肿瘤增殖侵袭转移上发挥重要作用.
胰腺中的胰蛋白酶原-2浓度很高, 正常情况下, 仅有比例很小的一部分漏到血循环中去, 急性胰腺炎时胰腺组织受损, 胰蛋白酶原-2大量入血, 血中胰蛋白酶原-2含量明显升高[17], 胰腺组织受损越严重, 胰蛋白酶原-2含量越高[18]. 我们的试验结果示正常对照组血清中存在少量的胰蛋白酶原-2, 胰腺炎组胰蛋白酶原-2含量明显高于正常对照组, 差异有统计学意义, 该结果与上述理论相符合. 本试验中正常对照组血清胰蛋白酶原-2中位数为: 0.8 μg/L, 该数值与国外文献报道并不一致: Itkonen等[19]采用放射免疫法检测正常组血清胰蛋白酶原-2含量均值为17(2-60) μg/L, 由于检测方法及试剂盒的不同, 同时不能排除血清保存方法、时间、人种等因素的影响, 目前此类文献关于胰蛋白酶原-2的正常值尚不统一, 因此我们并不能直接比较上述结果. 胰腺癌组胰蛋白酶原-2含量明显高于正常组, 差异均有统计学意义(P<0.001, P<0.01), 因此, 我们可以推断胰腺癌时血中胰蛋白酶原-2含量明显升高, 同样是由于胰腺组织的损伤, 胰腺中的胰蛋白酶原-2释放入血所致.
本实验中根据ROC曲线结果, 当其正常临界值>1.85 μg/L时, 95.7%的患者如无明显胰腺炎症状, 应高度警惕胰腺癌, 该类患者可安排下一步检查如腹部超声、CT或核磁等检查明确诊断, 提高胰腺癌的早期诊断率, 改善预后. 以44.05 μg/L为临界值, 此时血清胰蛋白酶原-2鉴别胰腺癌与胰腺炎的敏感度和特异度分别为63.3%和73.9%, 据我们前文所述, 胰蛋白酶原-2的含量与胰腺组织受损相关, 在急性胰腺炎中, 如经禁食、补液、生长抑素等治疗后血清胰蛋白酶原-2降低及腹痛缓解不明显, 或短期改善后反复, 应高度不除外胰腺癌, 此时应及时完善或复查腹部CT, 仍不能明确诊断者, 建议进一步行PET-CT检查.
因此, 血清胰蛋白酶原-2与胰腺癌关系密切, 其ELISA检测可作为一种非侵入性的初筛试验, 其检测方法简便、经济, 对胰腺癌具有较好的敏感性、特异性, 对临床初筛胰腺癌有一定的临床应用价值.
胰腺癌是消化系中预后极差的恶性肿瘤之一, 每年新发病例与死亡例数几乎一致. 目前手术治疗是有望治愈胰腺癌的唯一手段, 而80%-90%的病例确诊时已为晚期, 失去手术根治的机会, 因此, 早期诊断是改善胰腺癌预后的关键, 但目前临床仍缺少有效的非侵袭性筛查方法.
沈柏用, 副教授, 上海交通大学医学院附属瑞金医院肝胆胰外科中心; 李胜, 研究员, 山东省肿瘤防治研究院肝胆外科
胰腺癌发生时胰腺组织受损, 肿瘤分泌的一些细胞因子或致癌物质可释放至血液中, 这些标志物可能成为敏感度和特异度较高的筛检指标. 相关研究已成为全球的研究热点.
有研究报道, 胰蛋白酶原(包括胰蛋白酶原-1和胰蛋白酶原-2)表达于胰腺癌癌细胞系中(CFPAC-1及CAPAN-1).
本文采用ELISA方法检测了急性胰腺炎与胰腺癌患者、健康人血清中胰蛋白酶原-2的含量, 并采用ROC曲线分析得出相应的cut-off值.
本文选题恰当, 结论可靠, 具有一定的临床参考价值.
编辑: 曹丽鸥 电编:何基才
| 1. | Jemal A, Siegel R, Xu J, Ward E. Cancer statistics, 2010. CA Cancer J Clin. 2010;60:277-300. [PubMed] [DOI] |
| 3. | Perera D, Kandavar R, Palacios E. Pancreatic adenocarcinoma presenting as acute pancreatitis during pregnancy: clinical and radiologic manifestations. J La State Med Soc. 2011;163:114-117. [PubMed] |
| 4. | Tsai MJ, Liao KS, Shih PM, Lee KT, Chuang WL, Chiu YJ, Lin ZY. Relapsed acute pancreatitis as the initial presentation of pancreatic cancer in a young man: a case report. Kaohsiung J Med Sci. 2010;26:448-455. [PubMed] [DOI] |
| 5. | Ohta T, Terada T, Nagakawa T, Tajima H, Itoh H, Fonseca L, Miyazaki I. Pancreatic trypsinogen and cathepsin B in human pancreatic carcinomas and associated metastatic lesions. Br J Cancer. 1994;69:152-156. [PubMed] [DOI] |
| 6. | Jemal A, Bray F, Center MM, Ferlay J, Ward E, Forman D. Global cancer statistics. CA Cancer J Clin. 2011;61:69-90. [PubMed] [DOI] |
| 7. | Jung KW, Park S, Kong HJ, Won YJ, Lee JY, Park EC, Lee JS. Cancer statistics in Korea: incidence, mortality, survival, and prevalence in 2008. Cancer Res Treat. 2011;43:1-11. [PubMed] [DOI] |
| 9. | Griñó P, Martínez J, Griñó E, Carnicer F, Alonso S, Pérez-Berenguer H, Pérez-Mateo M. Acute pancreatitis secondary to pancreatic neuroendocrine tumours. JOP. 2003;4:104-110. [PubMed] |
| 10. | Koshikawa N, Hasegawa S, Nagashima Y, Mitsuhashi K, Tsubota Y, Miyata S, Miyagi Y, Yasumitsu H, Miyazaki K. Expression of trypsin by epithelial cells of various tissues, leukocytes, and neurons in human and mouse. Am J Pathol. 1998;153:937-944. [PubMed] [DOI] |
| 11. | Miyata S, Miyagi Y, Koshikawa N, Nagashima Y, Kato Y, Yasumitsu H, Hirahara F, Misugi K, Miyazaki K. Stimulation of cellular growth and adhesion to fibronectin and vitronectin in culture and tumorigenicity in nude mice by overexpression of trypsinogen in human gastric cancer cells. Clin Exp Metastasis. 1998;16:613-622. [PubMed] [DOI] |
| 12. | Williams SJ, Gotley DC, Antalis TM. Human trypsinogen in colorectal cancer. Int J Cancer. 2001;93:67-73. [PubMed] [DOI] |
| 13. | Paju A, Vartiainen J, Haglund C, Itkonen O, von Boguslawski K, Leminen A, Wahlström T, Stenman UH. Expression of trypsinogen-1, trypsinogen-2, and tumor-associated trypsin inhibitor in ovarian cancer: prognostic study on tissue and serum. Clin Cancer Res. 2004;10:4761-4768. [PubMed] [DOI] |
| 14. | Diederichs S, Bulk E, Steffen B, Ji P, Tickenbrock L, Lang K, Zänker KS, Metzger R, Schneider PM, Gerke V. S100 family members and trypsinogens are predictors of distant metastasis and survival in early-stage non-small cell lung cancer. Cancer Res. 2004;64:5564-5569. [PubMed] [DOI] |
| 16. | Ikeda O, Egami H, Ishiko T, Ishikawa S, Kamohara H, Hidaka H, Mita S, Ogawa M. Expression of proteinase-activated receptor-2 in human pancreatic cancer: a possible relation to cancer invasion and induction of fibrosis. Int J Oncol. 2003;22:295-300. [PubMed] |
| 17. | Sainio V, Puolakkainen P, Kemppainen E, Hedström J, Haapiainen R, Kivisaari L, Stenman UH, Schröder T, Kivilaakso E. Serum trypsinogen-2 in the prediction of outcome in acute necrotizing pancreatitis. Scand J Gastroenterol. 1996;31:818-824. [PubMed] [DOI] |
| 19. | Itkonen O. Human trypsinogens in the pancreas and in cancer. Scand J Clin Lab Invest. 2010;70:136-143. [PubMed] [DOI] |