修回日期: 2011-07-26
接受日期: 2011-08-01
在线出版日期: 2011-08-08
目的: 探讨大蒜新素、双黄连在整体水平抗鼠肝炎病毒3型(MHV-3)感染效应.
方法: 将小鼠分为: 大蒜新素、双黄连治疗组, 大蒜新素、双黄连预防组, 大蒜新素、双黄连预防+治疗组, 感染模型对照组, 每组18只, 及正常对照组, 6只. 建立MHV-3诱导的小鼠暴发型病毒性肝炎模型, 通过观察模型小鼠存活时间、血浆ALT水平、肝脏病理改变和肝组织MHV-3病毒滴度变化, 综合评估两种中药制剂的预防和治疗效应.
结果: 各组存活时间, 血浆ALT水平、肝脏病理改变和肝组织MHV-3病毒滴度差异明显. 大蒜新素预防组、双黄连预防组较模型组的病毒滴度(PFU/mg)明显减少(4.20±0.60, 3.63±0.15 vs 6.07±0.25, 均P<0.05); 预防+治疗组较治疗组的病毒滴度(PFU/mg)也明显减少(3.70±0.44 vs 4.53±0.55, P<0.05); 预防+治疗组较治疗组的病毒滴度(PFU/mg)明显减少(2.67±0.59 vs 3.77±0.31, P<0.05), 预防组与预防+治疗组之间比较无明显差异.
结论: 大蒜新素、双黄连预防效应优于其治疗作用, 可能作为冠状病毒流行期间人群预防的候选药物.
引文著录: 易文龙, 方峰, 宁琴, 舒赛男, 李革. 大蒜新素、双黄连对小鼠MHV-3性暴发型肝炎模型的作用. 世界华人消化杂志 2011; 19(22): 2316-2321
Revised: July 26, 2011
Accepted: August 1, 2011
Published online: August 8, 2011
AIM: To study the preventive and therapeutic effects of Shuanghuanglian and allitride against hepatitis virus strain 3 (MHV-3) infection in a murine model.
METHODS: BALB/c mice were divided into eight groups: Shuanghuanglian pretreatment group, allitride pretreatment group, Shuanghuanglian treatment group, allitride treatment group, Shuanghuanglian pretreatment and treatment group, allitride pretreatment and treatment group, model control group, and normal control group. Mice were injected intraperitoneally with MHV-3 (100 PFU/mouse) to induce MHV-3 infection. The survival time of tested mice and plasma ALT levels were recorded. Viral titers in liver tissue specimens were measured by plaque formation assay, and pathological changes were assessed by the Rezkalla method.
RESULTS: Both drugs showed inhibitory activities against MHV-3 infection by significantly decreasing the viral load within liver tissue. The anti-MHV-3 effect of Shuanghuanglian was more significant in vivo. Pretreatment with the two drugs could improve the outcome of mice with fulminant hepatitis (4.20 PFU/mg ± 0.60 PFU/mg, 3.63 PFU/mg ± 0.15 PFU/mg vs 6.07 PFU/mg ± 0.25 PFU/mg; 3.70 PFU/mg ± 0.44 PFU/mg vs 4.53 PFU/mg ± 0.55 PFU/mg; 2.67 PFU/mg ± 0.59 PFU/mg vs 3.77 PFU/mg ± 0.31 PFU/mg, all P < 0.05).
CONCLUSION: Shuanghuanglian and allitride might be candidate preventive agents for community control during the epidemic period of SARS.
- Citation: Yi WL, Fang F, Ning Q, Shu SN, Li G. Preventive and therapeutic effects of Shuanghuanglian and allitride against experimental murine hepatitis virus type 3 infection in vivo. Shijie Huaren Xiaohua Zazhi 2011; 19(22): 2316-2321
- URL: https://www.wjgnet.com/1009-3079/full/v19/i22/2316.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i22.2316
小鼠肝炎病毒3型(murine hepatitis virus type 3, MHV-3)属冠状病毒科, 是一组单股正链RNA病毒, 基因组长为32 kb[1], 与SARS-Cov的同源性较高[2]. MHV-3病毒感染不同种系近亲繁殖小鼠后产生类似人类各种不同临床类型的肝炎模型[3]. BALB/c小鼠感染MHV-3后发生暴发型病毒性肝炎. 本实验旨在进一步探讨这几种中药在体内预防和治疗冠状病毒的效应.
MHV-3由华中科技大学同济医学院附属同济医院感染免疫研究室提供. 双黄连粉针剂由哈尔滨医药股份有限公司中药二厂生产, 卫药准字Z-73号. 大蒜新素注射液由上海禾丰制药有限公司生产, 沪卫药准字第010005号. 甲基纤维素(Sigma公司TC501). 健康纯系BALB/c小鼠, ♀, 8周龄, 体质量18-20 g, 购于湖北省纯种动物实验室, 饲养在同济医院感染免疫研究室隔离封闭式动物饲养柜内.
1.2.1 MHV-3毒性的测定: 应用培养的L2细胞进行病毒滴定, 采用蚀斑形成实验测定MHV-3毒力.
1.2.2 MHV-3性暴发型肝炎模型的建立: 健康纯系BALB/c小鼠腹腔接种MHV-3病毒悬液, 100 PFU/只(0.1 mL)[4]; 于腹腔接种后48 h, 用眼球摘除法处死; 分离小鼠肝脏, 将肝脏组织剪成2 mm×5 mm大小的组织块, 置40 g/L甲醛溶液内固定; 肝组织进行组织病理学检查, 以确定造模是否成功.
1.2.3 动物用药剂量的计算: 根据Meeh-Rubner公式进行计算小鼠给药剂量[5,6]. 根据人体用药的中效剂量计算出小鼠的用药量分别为: 大蒜新素75 mg/kg、双黄连750 mg/kg.
1.2.4 实验分组和用药方案: (1)治疗组: 取36只BALB/c小鼠, 腹腔接种0.1 mL MHV-3病毒悬液, 100 PFU/只. 随机分成2组: 大蒜新素治疗组(18只)、双黄连治疗组(18只). 30 min后每组18只小鼠分别注射已配制好浓度的大蒜新素、双黄连0.1 mL, 大蒜新素75 mg/kg, 双黄连750 mg/kg. 1次/日, 疗程最长1 wk. 72 h后每组分别随机处死6只活鼠, 取血液约1 mL, 抗凝处理, 离心后留取血浆, 及时送检测定ALT; 用上述方法留取肝组织, 用于组织病理学检查和病毒滴度测定. 其余小鼠继续药物治疗, 观察存活时间; (2)预防组: 36只BALB/c小鼠随机分成2组, 各18只, 分别作为大蒜新素、双黄连预防组. 每组小鼠分别注射0.1 mL大蒜新素、双黄连, 剂量同上, 1次/d, 共3 d. 然后腹腔接种0.1 mL MHV-3病毒悬液, 100 PFU/只, 此后不再给药. 自接种病毒时间算起至72 h, 每组分别随机处死6只活鼠, 按上述方法留取血浆和肝组织样本, 其余小鼠继续观察存活时间; (3)预防+治疗组: 36只BALB/c小鼠随机分成2组, 各18只, 分别作为大蒜新素、双黄连预防+治疗组. 每组小鼠按预防组方案预防性用药3 d后腹腔接种0.1 mL MHV-3病毒, 100 PFU/只, 其后继续相同剂量给药, 1次/d, 疗程最长1 wk. 自接种病毒时间算起至72 h, 每组分别随机处死6只活鼠, 按上述方法留取血浆和肝组织样本, 其余小鼠继续观察存活时间; (4)感染模型对照组: 18只BALB/c小鼠按上述方法造模, 感染后72 h随机处死6只活鼠按上述方法留取血浆和肝组织样本, 其余小鼠继续观察存活时间; (5)正常对照组: 6只BALB/c小鼠腹腔注射0.1 mL生理盐水, 上述方法留取血浆和肝组织样本, 用于肝组织病理指数评估(Rezkalla半定量分析法).
1.2.5 观察指标及检测方法: (1)小鼠生存情况: 每天观察, 记录各组小鼠存活数和死亡数; (2)肝组织MHV-3病毒定量测定(蚀斑形成实验): 在病毒感染后72 h取活鼠肝组织0.1 g, 离心, 取上清; 检测小鼠肝组织MHV-3病毒量; (3)肝组织病理学检查: 采用Rezkalla半定量分析法[7]计量肝脏炎症和坏死面积, 即每张切片取5个视野, 计算每个视野中炎性细胞浸润及坏死区域面积与整个视野的面积之比, 无病变计0分, <25%计1分, 25%-50%计2分, 50%-75%计3分, >75%计4分; (4)血浆ALT浓度检测: 病毒感染后72 h取活鼠外周血, 标本抗凝处理, 2 000 r/min, 离心10 min, 留取血浆, 送同济医院检验科经AU100自动生化分析仪测定ALT值, 另取6只正常小鼠血浆作为正常对照.
统计学处理 采用SPSS12.0软件包进行生存分析, 绘制累计生存率曲线, 分析比较各处理组之间生存率曲线分布的差异, P<0.05认为有统计学差异. 各组血浆ALT、肝组织病理评分和病毒蚀斑数的比较采用方差分析和t检验.
计算测得MHV-3感染性病毒量为5.4×109 PFU/L.
在无药物干预情况下, 本模型小鼠在感染后5 d内全部死亡.
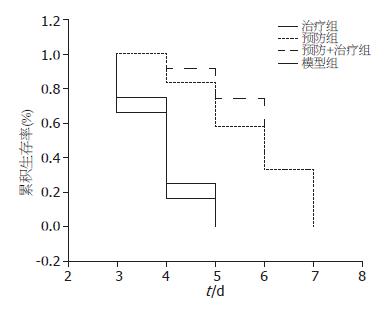
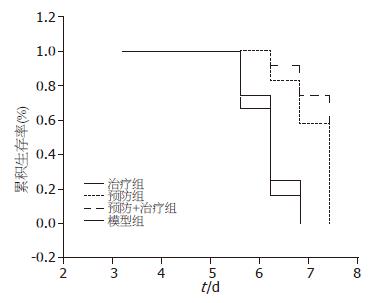
2.2.1 大蒜新素处理对MHV-3性爆发型肝炎模型鼠存活时间的影响: 治疗组12只小鼠均在5 d内死亡; 预防组和预防+治疗组小鼠5 d内死亡数分别为5只和3只. 经统计学生存分析, 治疗组与模型对照组无明显差异(P>0.05), 预防组和预防+治疗组与模型组和治疗组比较差异明显(P<0.05), 预防组与预防+治疗组之间比较无明显差异(P>0.05, 表1, 图1).
2.2.2 双黄连处理对MHV-3性爆发型肝炎模型鼠存活时间的影响: 双黄连治疗组、预防组和预防+治疗组5 d内死亡数分别为8只、5只和4只, 3组与模型组比较均有明显差异(P<0.05); 预防+治疗组与预防组比较无明显差异(P>0.05), 但与治疗组比较差异明显(P<0.05, 表2, 图2).
两种药物治疗组、预防组和预防+治疗组小鼠的肝组织病毒滴度均较模型组明显减少; 双黄连预防组和治疗组的病毒滴度与预防+治疗组比较有明显差异(P<0.05, 表3).
模型鼠肉眼可见肝脏体积明显肿大, 呈酱紫色; 光镜下肝结构严重破坏, 大片肝细胞破坏, 肝小叶结构紊乱, 肝索消失, 肝窦内可见出血并有血栓形成, 在肝细胞坏死区可见单核细胞和中性粒细胞浸润. 药物处理组中以大蒜新素治疗组病变最为严重, 其他各组肝脏体积较模型对照组小, 色泽呈暗红, 光镜下肝细胞坏死面积较模型组小, 肝小叶结构无明显紊乱, 但仍然可见大量肝细胞坏死, 呈点片状, 肝窦内未见血栓形成, 炎性细胞浸润较模型组轻. 双黄连的治疗组和预防+治疗组的肝病变指数明显低于模型对照组, 其余各组肝病变指数虽有所下降, 但与模型鼠比较无统计学差异(表4).
大蒜新素处理对MHV-3性爆发型肝炎模型鼠肝功能的影响. MHV-3感染后引起血浆ALT显著升高, 但各处理组ALT明显低于模型组(P<0.01), 且预防组和预防+治疗组的ALT还明显低于治疗组(P<0.01, 表5).
我国重症肝炎发病率高, 临床治疗方法有限, 其致病机制极其复杂[8,9], BALB/c小鼠感染MHV-3后发生暴发型病毒性肝炎, 其临床特征和肝脏病理特征与人类急性重症型病毒性肝炎极其相似[10], 本实验表明, 在没有治疗或预防措施干预时, 造模后3-5 d内全部死亡, 结果与以前文献提供的证据符合[11].
大蒜新素、双黄连注射液体外抗MHV-3作用本课题已有研究, 对MHV-3病毒致细胞病变有明显的抑制作用[12,13]. 本次实验是进一步研究在整体水平研究是否对MHV感染小鼠的存活时间、血浆ALT水平、肝脏病理改变和肝组织MHV-3病毒滴度变化有否影响, 综合评估两种中药制剂的预防和治疗效应.
结果显示, (1)两种中药制剂的3种处理方案都能使模型鼠肝脏病毒滴度明显减少, 除双黄连的预防组和预防+治疗组比治疗组的肝脏病毒载量明显减少外, 大蒜新素各处理方案组之间无明显差别; (2)各用药组的血浆ALT变化比较一致, 均明显低于模型组; 3种用药方案之间进行比较, 可见预防组和预防+治疗组的ALT水平明显低于治疗组; (3)存活时间的观察结果: 治疗组中, 大蒜新素治疗组小鼠感染后5 d内死亡12只(100%), 与模型组比较无明显差异. 但双黄连治疗组仅死亡8只(66.6%), 与模型组间有明显差异. 而两种药物的预防组和预防+治疗组5 d内死亡率(每组死亡3-5只, 25.0%-41.7%)均明显低于模型组; (4)肝组织病理改变: 模型鼠发生暴发型病毒性肝炎的典型肝脏病理改变. 各药物处理组中以大蒜新素治疗组肝病变最为严重, 但其他各组肝脏病变较模型鼠轻. Rezkalla半定量分析结果显示只有双黄连预防组和预防+治疗组的肝病变指数明显低于模型组, 其余各组虽肝病变指数有所降低, 但与模型鼠相比无统计学差异.
综合分析上述结果, 我们可以看出, 两种中药在不同程度上都能延长模型鼠的生命, 模型鼠在感染后3-5 d内全部死亡, 用药后部分小鼠的生命可延长到7 d, 但未能提高存活率. 两种用药方案之间比较发现, 预防性用药和预防+治疗用药能够有意义地提高5 d以上存活率, 而单纯在造模后治疗性用药却不能, 预防组与预防+治疗组之间也无明显区别, 提示预防性用药是提高5 d以上存活率的主要因素, 本研究中造模用的MHV-3的N蛋白具有促进前凝血质活性提高、诱导mfgl2凝血酶原酶基因转录活性的机制[3,10], 通过预防和预防+治疗的方式使用抗MHV-3的药物可以减少MHV-3对肝细胞的损害作用, 从而起到抑制或者阻碍病毒激发相关的免疫损害机制, 保护肝细胞. 而病毒诱导的暴发型肝炎一旦发生, 再予以药物治疗则已乏回天之力. 药物处理后肝脏病变半定量分析结果与小鼠存活时间的改变基本一致, 虽然从肉眼观到光镜检查均见到肝病变较模型鼠轻, 但病变仍然严重, 难以存活.
进一步分析肝组织病毒载量变化, 两种药物各处理组肝组织病毒含量都较模型鼠有明显降低, 提示在本组MHV-3暴发型肝炎模型上, 大蒜新素、双黄连都有明显整体抗病毒效应. 这与我们在细胞模型上所观察到的结果基本相符合[12,13]. 比较两种用药方案, 可见预防+治疗组的肝病毒载量最低, 预防组其次, 治疗组最高的变化特点, 但只有双黄连的预防+治疗组肝病毒载量的降低有统计学意义, 提示药物在整体水平也能抑制细胞内病毒增殖过程或能阻止病毒的细胞间扩散和蔓延; 并进一步说明药物对MHV-3感染的预防效应优于其治疗作用. 由于整体实验采用人体中效剂量换算小鼠用药剂量, 除外细胞模型研究中所选用药物剂量上的差异, 故在整体水平证实, 双黄连的抗MHV-3作用确实强于大蒜新素.
肝细胞功能ALT的变化结果显示, 3种用药模式都能明显降低感染鼠ALT水平, 但其水平仍然平均高达2 716-4 453 U/L, 提示肝细胞功能损害严重, 难逃死亡的命运, 与感染鼠严重的肝脏组织学病变和最终结局相一致, 这与我们所选用的暴发型肝炎模型有直接关系. 比较而言, 药物预防组和预防+治疗组的ALT水平都明显低于治疗组, 与5 d存活率的变化一致, 进一步说明整体水平预防性用药可减轻MHV-3暴发型肝炎模型鼠的肝损害.
累及全球20多个国家和地区的SARS相关冠状病毒经测序核实其序列与包括MHV在内的Ⅱ型冠状病毒基因序列同源性最大[14-16], 在MHV-3暴发型肝炎模型上, 双黄连、大蒜新素都具有明显直接抗MHV-3效应, 双黄连的整体抗MHV-3作用最强; 大蒜新素、双黄连预防性用药可明显改善模型鼠的预后, 有意义地延长模型鼠生存时间和减轻肝功能损害, 提示这些药物的预防效应优于其治疗作用, 可能作为冠状病毒流行期间人群预防的候选药物; 同时提示, 这些药物可能还可通过调节机体免疫功能、抑制免疫炎症反应或其他途径如抑制病毒诱导的凋亡而发挥整体保护性效应, 其机制有待进一步深入研究.
MHV-3病毒感染不同种系近亲繁殖小鼠后产生类似人类各种不同临床类型的肝炎模型. BALB/c小鼠感染MHV-3后发生暴发型病毒性肝炎.
赵桂鸣, 主任医师, 天津市肝病研究所天津市传染病医院慢性肝炎科; 范学工, 教授, 中南大学湘雅医院感染病科
大蒜新素、双黄连注射液体外抗MHV-3作用本课题已有研究, 对MHV-3病毒致细胞病变有明显的抑制作用.
大蒜新素、双黄连预防效应优于其治疗作用, 可能作为冠状病毒流行期间人群预防的候选药物.
本文选题新颖, 设计合理, 有较好的应用前景.
编辑: 李薇 电编:何基才
| 1. | Wieland SF, Vega RG, Müller R, Evans CF, Hilbush B, Guidotti LG, Sutcliffe JG, Schultz PG, Chisari FV. Searching for interferon-induced genes that inhibit hepatitis B virus replication in transgenic mouse hepatocytes. J Virol. 2003;77:1227-1236. [PubMed] [DOI] |
| 3. | 宁琴, 罗小平, 汪之沫, 韩梅芳, 严伟明, 刘铭锋, Gary Levy. mfgl2凝血酶原酶/纤维介素基因转录调控元件肝细胞核因子的研究. 中华医学杂志. 2003;83:678-683. |
| 4. | 宁 琴, 罗 小平, 雷 延昌. 鼠病毒性肝炎信号转录传导激活因子的研究. 中华微生物学和免役学杂志. 2002;22:666-669. |
| 5. | Spiers DE, Candas V. Relationship of skin surface area to body mass in the immature rat: a reexamination. J Appl Physiol. 1984;56:240-243. [PubMed] |
| 6. | 重庆医科大学实验动物中心. 实验动物实用手册. 2004;17-19. |
| 7. | Rezkalla S, Kloner RA, Khatib G, Khatib R. Beneficial effects of captopril in acute coxsackievirus B3 murine myocarditis. Circulation. 1990;81:1039-1046. [PubMed] [DOI] |
| 8. | 冯 志华, 聂 青和, 白 宪光, 白 雪帆, 周 永兴, 贾 战生, 郝 春秋. 膜式血浆置换治疗慢性重症肝炎肝功能衰竭疗效. 世界华人消化杂志. 2002;10:638-641. [DOI] |
| 11. | Spaan W, Cavanagh D, Horzinek C. The Basis for Serodiagnosis and Vaccines. In: Van Regenmortal MV. Neurath AR, Eds. Immunochemistry of Viruses II. Elsevier Science Publishers, Amsterdam, Netherlands 1990; 358-379. |
| 12. | 易 文龙, 方 峰, 宁 琴, 严 伟明, 甄 宏, 周 玉峰, 李 革. 大蒜新素注射液抗鼠肝炎病毒3型的体外实验研究. 南京医科大学学报(自然科学版). 2006;26:400-406. |
| 13. | 易 文龙, 方 峰, 宁 琴, 严 伟明, 甄 宏, 舒 赛男, 周 玉峰, 李 革. 双黄连、鱼腥草注射液抗鼠肝炎病毒3型的体外实验研究. 东南大学学报(医学版). 2006;25:228-231. |
| 14. | Poutanen SM, Low DE, Henry B, Finkelstein S, Rose D, Green K, Tellier R, Draker R, Adachi D, Ayers M. Identification of severe acute respiratory syndrome in Canada. N Engl J Med. 2003;348:1995-2005. [PubMed] [DOI] |
| 15. | Ksiazek TG, Erdman D, Goldsmith CS, Zaki SR, Peret T, Emery S, Tong S, Urbani C, Comer JA, Lim W. A novel coronavirus associated with severe acute respiratory syndrome. N Engl J Med. 2003;348:1953-1966. [PubMed] [DOI] |
| 16. | Drosten C, Günther S, Preiser W, van der Werf S, Brodt HR, Becker S, Rabenau H, Panning M, Kolesnikova L, Fouchier RA. Identification of a novel coronavirus in patients with severe acute respiratory syndrome. N Engl J Med. 2003;348:1967-1976. [PubMed] [DOI] |