修回日期: 2011-07-11
接受日期: 2011-07-15
在线出版日期: 2011-07-28
目的: 探讨AKT、p27Kip1与Cyclin E表达在胃癌发生发展中的意义.
方法: 收集2008-01/2010-01湘潭市第一人民医院和南华大学附属南华医院的活检标本和胃癌手术切除标本, 包括正常胃黏膜组织14例(胃镜活检标本)、非典型增生胃组织10例(胃镜活检标本)、胃癌组织94例、癌旁组织49例, 淋巴结转移胃癌组织35例, 制作成组织芯片, 每个蜡块设计5×10点阵, 阵列的最后一排的最后一孔为空白标记, 确定方位顺序. 采用免疫组织化学染色, 检测胃组织芯片中AKT蛋白、p27Kip1蛋白磷酸化及Cyclin E蛋白表达. 方向.
结果: 与正常胃黏膜、癌旁和非典型增生组织相比, AKT蛋白磷酸化和Cyclin E蛋白在原发癌、淋巴结转移癌中表达升高(AKT: 85.1%, 85.7% vs 14.3%, 26.5%, 30.0%; Cyclin E: 85.1%, 82.9% vs 14.3%, 34.7%, 20.0%, 均P<0.01), 而p27Kip1蛋白磷酸化水平降低(22.3%, 17.1% vs 71.4%, 44.9%, 40.0%, P<0.01); 与正常胃黏膜组织比较, AKT蛋白磷酸化在非典型增生组织中表达上调(P = 0.26).
结论: AKT、p27Kip1蛋白磷酸化及Cyclin E蛋白表达与胃癌的发生发展有关, 随着AKT蛋白磷酸化及Cyclin E蛋白表达水平的升高, p27Kip1蛋白磷酸化水平降低.
引文著录: 张志伟, 汤国辉, 赵强, 刘重元, 吴勇军, 贺修胜. AKT-p27Kip1-Cyclin E在胃癌组织中的表达及意义. 世界华人消化杂志 2011; 19(21): 2233-2240
Revised: July 11, 2011
Accepted: July 15, 2011
Published online: July 28, 2011
AIM: To investigate the expression of AKT, p27Kip1 and cyclin E proteins in gastric carcinoma and to explore their significance in tumor development and progression.
METHODS: Biopsy and surgical specimens were collected in the Xiangtan City First People's Hospital and Affiliated Nanhua Hospital of University of South China from January 2008 to January 2010, including 14 cases of normal gastric mucosa, 10 cases of atypical hyperplasia, 94 cases of gastric cancer, 49 cases of cancer-adjacent tissue and 35 cases of metastatic cancer. Tissue array technology was used to detect the phosphorylation of AKT and p27Kip1 proteins and the expression of cyclin E by immunohistochemistry.
RESULTS: Compared to normal gastric mucosa, cancer-adjacent tissue and atypical hyperplasia, the positive rates of AKT phosphorylation and cyclin E overexpression were significantly higher (AKT: 85.1%, 85.7% vs 14.3%, 26.5%, 30.0%; Cyclin E: 85.1%, 82.9% vs 14.3%, 34.7%, 20.0%, all P < 0.01) and that of p27Kip1 phosphorylation was significantly lower (22.3%, 17.1% vs 71.4%, 44.9%, 40.0%, all P < 0.01) in primary cancer and metastatic carcinoma. Compared to normal gastric mucosa, the positive rate of AKT phosphorylation was significantly higher in atypical hyperplasia (P = 0.26).
CONCLUSION: The phosphorylation of AKT and p27Kip1 and expression of cyclin E protein are possibly related to the development and progression of gastric carcinoma.
- Citation: Zhang ZW, Tang GH, Zhao Q, Liu CY, Wu YJ, He XS. Significance of expression of AKT, p27Kip1 and cyclin E in gastric carcinoma. Shijie Huaren Xiaohua Zazhi 2011; 19(21): 2233-2240
- URL: https://www.wjgnet.com/1009-3079/full/v19/i21/2233.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i21.2233
胃癌是全世界和我国最常见的恶性肿瘤之一, 其年发病率仅次于肺癌居第2位[1,2]. 新近资料显示, 我国胃癌死亡率呈逐年上升趋势, 严重威胁着人们的健康与生命, 是当前危害人民身体健康的重大疾病[3]. 许多研究显示, 胃癌中不同基因的表达与其组织学类型、分化程度、转移和耐药等密切相关, 对评估和预测胃癌患者预后具有很大价值, 已引起了肿瘤研究领域的普遍关注[4,5]. 本研究旨在分析AKT蛋白、p27Kip蛋白和Cyclin E蛋白在胃癌中表达的意义, 为临床早期发现与防治胃癌及评估患者预后提供有价值的资料.
本研究收集2008-01/2010-01湘潭市第一人民医院和南华大学附属南华医院的活检标本和胃癌手术切除标本, 包括正常胃黏膜组织14例(胃镜活检标本)、非典型增生胃组织10例(胃镜活检标本)、胃癌组织94例、癌旁组织49例, 淋巴结转移胃癌组织35例, 制作成组织芯片每个蜡块设计5×10点阵, 阵列的最后一排的最后一孔为空白标记, 确定方位顺序. 其中, 男65例, 女53例; 年龄36-78(平均40.5)岁. 所有患者术前均未进行放疗或化疗. 鼠抗人AKT磷酸化抗体、鼠抗人p27Kip1磷酸化抗体、鼠抗人Cyclin E单克隆抗体及SP免疫组织化学检测试剂盒购自福建迈新公司.
1.2.1 免疫组织化学检测AKT、p27Kip1及Cyclin E的表达: 操作按照超敏SP试剂盒所附说明书进行, 用已知阳性片作阳性对照(福建迈新生物有限公司提供), 同时用PBS替代第一抗体作阴性对照, 实验步骤如下: (1)将制备好的石蜡切片58 ℃隔水式恒温培养箱中过夜; (2)二甲苯脱蜡2次后水化; (3)PBS洗片3次, 每次3 min; (4)将切片浸入盛有枸橼酸盐缓冲液容器中微波炉加热进行抗原修复; (5)加3%过氧化物酶阻断液, 37 ℃, 15 min; (6)PBS洗片3次, 每次3 min; (7)加足量非免疫性动物血清, 37 ℃, 10 min, 阻断非特异性结合位点; (8)分别滴加一抗(AKT、p27Kip1和Cyclin E), 置湿盒中4 ℃冰箱过夜; (9)滴加生物素标记的二抗, 37 ℃, 15 min; (10)滴加链霉菌抗生物素蛋白-过氧化物酶溶液, 37 ℃, 15 min; (11)DAB显色、苏木素复染、反蓝、脱水、透明, 封片, 显微镜观察、照相(结果阳性部位呈棕黄色).
1.2.2 免疫组织化学染色结果判定: AKT磷酸化蛋白定位于细胞质内, p27Kip1磷酸化蛋白和Cyclin E蛋白均在细胞核与细胞质中表达, 以黄色、棕色、棕褐色颗粒沉淀为阳性表达. 结果判定标准, 选取不重复的5个视野, 按染色强度及阳性细胞所占的百分比综合计分, 染色强度: 无色计为1分, 黄色为2分, 棕褐色为3分; 阳性细胞数: 小于等于总数的10%计为1分; 在11%-50%计为2分; >50%计为3分. 染色强度得分与阳性细胞数得分相乘, 1分计为阴性-; 2-4分计为阳性+, ≥6分计为强阳性+++, 阳性细胞数>10%为阳性表达.
统计学处理 采用SPSS13.0统计进行数据处理和分析. AKT磷酸化蛋白、p27Kip1磷酸化蛋白和Cyclin E蛋白的表达采用χ2检验和方差分析, 组间的相关性分析采用Spearman等级相关进行比较, 以P<0.05表示差异有统计学意义.
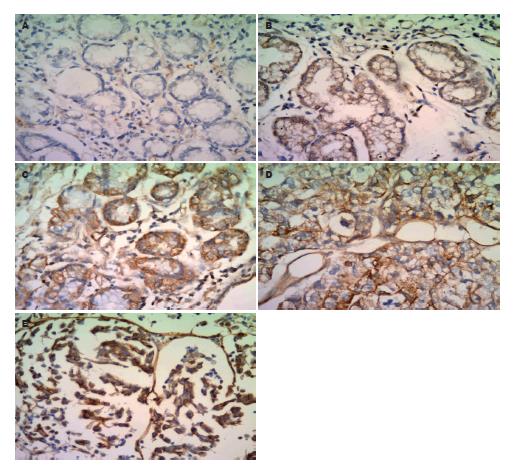
磷酸化AKT蛋白位于胞质与胞膜, 正常胃黏膜(阳性率14.3%)大部分组织均为阴性, 非典型增生(阳性率30%)和癌旁(阳性率26.5%)表达呈弱阳性, 而原发癌(阳性率85.1%)及淋巴结转移癌(阳性率85.7%)表达呈强阳性, 原发癌、淋巴结转移癌组织中表达明显高于正常胃黏膜、癌旁和非典型增生组织(P<0.01); 且非典型增生组织中磷酸化AKT蛋白表达高于正常胃黏膜组织(P = 0.26, 图1, 表1).
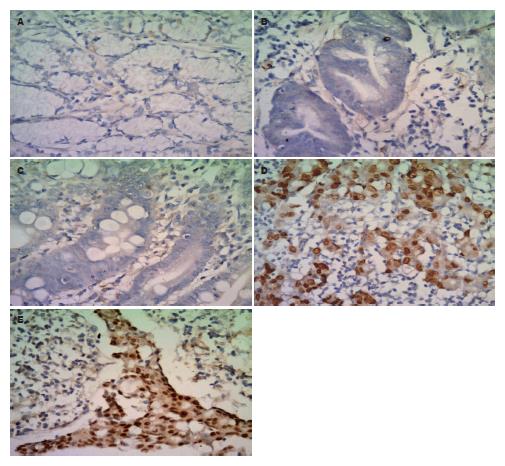
磷酸化p27Kip1蛋白阳性染色位于胞质与胞核. 正常胃黏膜(阳性率71.4%)大部分组织呈强阳性或阳性表达, 非典型增生(阳性率40%)和癌旁(阳性率44.9%)呈阳性或弱阳性, 原发癌(阳性率22.3%)及淋巴结转移癌(阳性率17.1%)呈阴性或弱阳性表达, 正常胃黏膜、非典型增生和癌旁组织中表达高于原发癌和淋巴结转移癌组织(P<0.01, 图2, 表2).
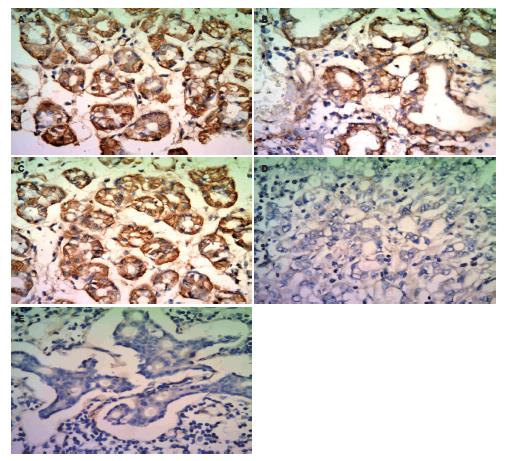
Cyclin E蛋白主要在胞核中表达. 正常胃黏膜(阳性率14.3%)大部分组织均为弱阳性或阴性, 非典型增生(阳性率20%)和癌旁(阳性率34.7%)呈阳性或弱阳性, 原发癌(阳性率85.1%)及淋巴结转移癌(阳性率82.9%)中呈强阳性表达, 原发癌、淋巴结转移癌组织中Cyclin E蛋白表达明显高于正常胃黏膜、癌旁和非典型增生组织(P<0.01, 图3, 表3).
AKT蛋白磷酸化后可直接调节细胞内P27蛋白的磷酸化, 然后参与调节细胞内Cyclin E蛋白的表达与其活性[6,7]. 为了解AKT蛋白、p27Kip1蛋白磷酸化和Cyclin E蛋白在胃癌中表达的临床意义. 我们检测组织芯片中三者蛋白在正常胃黏膜与非典型增生组织、癌旁组织、原发癌及淋巴结转移胃癌组织中的表达, 分析不同胃组织中阳性表达率. 结果显示原发胃癌和淋巴结转移癌中AKT蛋白磷酸化水平较正常胃黏膜、癌旁和非典型增生组织明显升高, 与以往在胃肠道肿瘤研究结果相似[8,9]. 有研究发现AKT的活化程度与肿瘤的侵袭范围、浸润深度、淋巴结转移及病理分期有关, 提示其高表达者患者预后不良[10,11]. Zhou等[12]发现, AKT磷酸化水平从正常乳腺上皮组织、不典型增生到浸润性乳腺癌逐渐增加, 且与ErbB-2的高表达正相关. 结合我们的结果, 磷酸化AKT蛋白正常胃黏膜组织中低表达, 非典型增生胃组织中表达升高, 胃癌组织中高表达, 这与以往在多种恶性肿瘤中发现AKT蛋白磷酸化水平增高情况基本一致[13-15]. 胃组织中磷酸化AKT蛋白表达可以早期监测胃组织的阶段性病变, 随着胃黏膜上皮细胞的恶性度增加, 磷酸化AKT蛋白表达及阳性率逐渐升高. AKT蛋白磷酸化与恶性肿瘤的发生密切相关, 因此, 我们初步推测胃组织中AKT蛋白磷酸化水平升高, 对早期发现与诊断胃癌具有一定的临床意义.
P27蛋白低表达或缺失, 与许多肿瘤的发生、发展及预后密切相关, 干预P27蛋白的表达, 或改变p27基因型可起到抑制肿瘤的作用[16-18]. P27蛋白低表达或缺失在多种肿瘤, 如乳腺癌、胃癌、脑胶质瘤及非小细胞性肺癌中提示不良预后[19-21]. P27蛋白的异常表达不仅可以反映肿瘤的恶性程度, 而且可以作为判断肿瘤预后的独立预测指标[22-24]. 结果显示, 原发癌、淋巴结转移癌中P27蛋白明显低于正常胃黏膜和癌旁组织, 提示P27蛋白的异常表达与胃癌发生有关, 可为临床早期预防胃癌的发生提供一定的线索.
目前已发现在多种肿瘤组织中存在Cyclin E蛋白的高表达, 并且与肿瘤的病理分型、侵袭与转移、辅助治疗的敏感性以及预后密切相关[25,26]. Cyclin E蛋白在胃癌的恶性转化中起重要作用[27,28]. Sakaguchi等[29]发现Cyclin E蛋白在胃癌中的表达改变与胃癌的分期、浸润深度和淋巴结转移密切相关. Cyclin E蛋白的高表达与宫颈癌的病理分化程度、淋巴结转移以及不良预后有关[30-32]. Cyclin E蛋白高表达的胃肠肿瘤生物学行为更具浸润性, 且与肿瘤淋巴结转移以及预后相关, 提示Cyclin E蛋白高可以作为肿瘤预后的标志及免疫治疗的靶点[33-35]. 为了解Cyclin E蛋白在不同胃组织的表达意义, 我们采用组织芯片检测正常胃黏膜、癌旁、非典型增生、原发癌及淋巴结转移癌中表达, 结果发现随着胃黏膜上皮细胞的恶性度增加, Cyclin E蛋白的表达逐渐升高. 提示Cyclin E蛋白表达与组织的分化程度密切相关, 也可为早期发现与诊断胃癌具有一定的临床意义.
总之, 正常胃黏膜中AKT蛋白磷酸化和Cyclin E蛋白表达低, 而p27Kip1蛋白磷酸化水平高; 胃癌组织中AKT蛋白磷酸化和Cyclin E蛋白表达高, 而p27Kip1蛋白磷酸化水平低, 推测他们与胃癌癌变过程密切相关, 因此联合检测三者在胃组织中的表达, 可为判断不同胃组织学的特点提供临床指导, 有望成为早期发现、预防与诊断胃癌的预警分子指标, 但基于样本样有限, 临床的运用前有待大样本的进一步证实.
胃癌中不同基因的表达与组织学类型、分化程度、转移和耐药等密切相关.
陈国忠, 副主任医师, 广西中医学院第一附属医院消化内科
许多研究显示, 胃癌中不同基因的表达与其组织学类型、分化程度、转移和耐药等密切相关, 对评估和预测胃癌患者预后具有很大价值, 已引起了肿瘤研究领域的普遍关注.
Zhou等发现, AKT磷酸化水平从正常乳腺上皮组织、不典型增生到浸润性乳腺癌逐渐增加, 且与ErbB-2的高表达正相关.
本文通过串联同一信号通路相关蛋白, 观察胃癌发生不同阶段的表达情况, 结合组织芯片技术的优点, 可以客观反应信号通路中蛋白间的相互作用.
联合检测AKT-p27-Cyclin E在胃组织中的表达, 可为判断不同胃组织学的特点提供临床指导, 有望成为早期发现、预防与诊断胃癌的预警分子指标.
本文科学性和创新性较好, 对临床有较好的指导意义.
编辑: 曹丽鸥 电编:何基才
| 1. | Saif MW, Makrilia N, Zalonis A, Merikas M, Syrigos K. Gastric cancer in the elderly: an overview. Eur J Surg Oncol. 2010;36:709-717. [PubMed] [DOI] |
| 2. | Wang BB, Liu CG, Lu P, Latengbaolide A, Lu Y. Log-normal censored regression model detecting prognostic factors in gastric cancer: A study of 3018 cases. World J Gastroenterol. 2011;17:2867-2872. [PubMed] |
| 3. | Moy KA, Fan Y, Wang R, Gao YT, Yu MC, Yuan JM. Alcohol and tobacco use in relation to gastric cancer: a prospective study of men in Shanghai, China. Cancer Epidemiol Biomarkers Prev. 2010;19:2287-2297. [PubMed] [DOI] |
| 4. | El-Zimaity H. Gastritis and gastric atrophy. Curr Opin Gastroenterol. 2008;24:682-686. [PubMed] [DOI] |
| 5. | Vasas P, Bijendra P. [Genetic background and clinical features of the hereditary diffuse gastric cancer]. Orv Hetil. 2011;152:1105-1109. [PubMed] [DOI] |
| 6. | Guirouilh-Barbat JK, Wilhelm T, Lopez BS. AKT1/BRCA1 in the control of homologous recombination and genetic stability: the missing link between hereditary and sporadic breast cancers. Oncotarget. 2010;1:691-699. [PubMed] |
| 7. | Sacco A, Roccaro A, Ghobrial IM. Role of dual PI3/Akt and mTOR inhibition in Waldenstrom's Macroglobulinemia. Oncotarget. 2010;1:578-582. [PubMed] |
| 8. | Tovar C, Rosinski J, Filipovic Z, Higgins B, Kolinsky K, Hilton H, Zhao X, Vu BT, Qing W, Packman K. Small-molecule MDM2 antagonists reveal aberrant p53 signaling in cancer: implications for therapy. Proc Natl Acad Sci U S A. 2006;103:1888-1893. [PubMed] [DOI] |
| 9. | Kang MH, Oh SC, Lee HJ, Kang HN, Kim JL, Kim JS, Yoo YA. Metastatic function of BMP-2 in gastric cancer cells: The role of PI3K/AKT, MAPK, the NF-κB pathway, and MMP-9 expression. Exp Cell Res. 2011;317:1746-1762. [PubMed] [DOI] |
| 10. | Liu J, Fu XQ, Zhou W, Yu HG, Yu JP, Luo HS. LY294002 potentiates the anti-cancer effect of oxaliplatin for gastric cancer via death receptor pathway. World J Gastroenterol. 2011;17:181-190. [PubMed] [DOI] |
| 11. | Nicholson KM, Anderson NG. The protein kinase B/Akt signalling pathway in human malignancy. Cell Signal. 2002;14:381-395. [PubMed] [DOI] |
| 12. | Zhou X, Tan M, Stone Hawthorne V, Klos KS, Lan KH, Yang Y, Yang W, Smith TL, Shi D, Yu D. Activation of the Akt/mammalian target of rapamycin/4E-BP1 pathway by ErbB2 overexpression predicts tumor progression in breast cancers. Clin Cancer Res. 2004;10:6779-6788. [PubMed] [DOI] |
| 13. | Chao X, Zao J, Xiao-Yi G, Li-Jun M, Tao S. Blocking of PI3K/AKT induces apoptosis by its effect on NF-κB activity in gastric carcinoma cell line SGC7901. Biomed Pharmacother. 2010;64:600-604. [PubMed] [DOI] |
| 14. | Li SP, Chen XJ, Sun AH, Zhao JF, Yan J. CagA(+) H. pylori induces Akt1 phosphorylation and inhibits transcription of p21(WAF1/CIP1) and p27(KIP1) via PI3K/Akt1 pathway. Biomed Environ Sci. 2010;23:273-278. [PubMed] [DOI] |
| 15. | Zhao XC, Tian L, Cao JG, Liu F. Induction of apoptosis by 5,7-dihydroxy-8-nitrochrysin in breast cancer cells: the role of reactive oxygen species and Akt. Int J Oncol. 2010;37:1345-1352. [PubMed] |
| 16. | Besson A, Hwang HC, Cicero S, Donovan SL, Gurian-West M, Johnson D, Clurman BE, Dyer MA, Roberts JM. Discovery of an oncogenic activity in p27Kip1 that causes stem cell expansion and a multiple tumor phenotype. Genes Dev. 2007;21:1731-1746. [PubMed] [DOI] |
| 17. | Guo SL, Peng Z, Yang X, Fan KJ, Ye H, Li ZH, Wang Y, Xu XL, Li J, Wang YL. miR-148a promoted cell proliferation by targeting p27 in gastric cancer cells. Int J Biol Sci. 2011;7:567-574. [PubMed] |
| 18. | Chen W, Gao N, Shen Y, Cen JN. Hypermethylation downregulates Runx3 gene expression and its restoration suppresses gastric epithelial cell growth by inducing p27 and caspase3 in human gastric cancer. J Gastroenterol Hepatol. 2010;25:823-831. [PubMed] [DOI] |
| 19. | Batsi C, Markopoulou S, Kontargiris E, Charalambous C, Thomas C, Christoforidis S, Kanavaros P, Constantinou AI, Marcu KB, Kolettas E. Bcl-2 blocks 2-methoxyestradiol induced leukemia cell apoptosis by a p27(Kip1)-dependent G1/S cell cycle arrest in conjunction with NF-kappaB activation. Biochem Pharmacol. 2009;78:33-44. [PubMed] [DOI] |
| 20. | Sion-Vardy N, Freedman J, Lazarov I, Bolotin A, Ariad S. p27kip1 Expression in non-small cell lung cancer is not an independent prognostic factor. Anticancer Res. 2010;30:3699-3704. [PubMed] |
| 21. | Nabika S, Kiya K, Satoh H, Mizoue T, Kondo H, Katagiri M, Nishisaka T, Sugiyama K, Kurisu K. Prognostic significance of expression patterns of EGFR family, p21 and p27 in high-grade astrocytoma. Hiroshima J Med Sci. 2010;59:65-70. [PubMed] |
| 22. | Georgitsi M. MEN-4 and other multiple endocrine neoplasias due to cyclin-dependent kinase inhibitors (p27(Kip1) and p18(INK4C)) mutations. Best Pract Res Clin Endocrinol Metab. 2010;24:425-437. [PubMed] [DOI] |
| 23. | Zolota V, Sirinian C, Melachrinou M, Symeonidis A, Bonikos DS. Expression of the regulatory cell cycle proteins p21, p27, p14, p16, p53, mdm2, and cyclin E in bone marrow biopsies with acute myeloid leukemia. Correlation with patients' survival. Pathol Res Pract. 2007;203:199-207. [PubMed] [DOI] |
| 24. | Bhatia B, Malik A, Fernandez-L A, Kenney AM. p27(Kip1), a double-edged sword in Shh-mediated medulloblastoma: Tumor accelerator and suppressor. Cell Cycle. 2010;9:4307-4314. [PubMed] [DOI] |
| 25. | Payton M, Scully S, Chung G, Coats S. Deregulation of cyclin E2 expression and associated kinase activity in primary breast tumors. Oncogene. 2002;21:8529-8534. [PubMed] [DOI] |
| 26. | Gutsch R, Kandemir JD, Pietsch D, Cappello C, Meyer J, Simanowski K, Huber R, Brand K. CCAAT/Enhancer-binding Protein {beta} Inhibits Proliferation in Monocytic Cells by Affecting the Retinoblastoma Protein/E2F/Cyclin E Pathway but Is Not Directly Required for Macrophage Morphology. J Biol Chem. 2011;286:22716-22729. [PubMed] [DOI] |
| 27. | Kang MA, Kim JT, Kim JH, Kim SY, Kim YH, Yeom YI, Lee Y, Lee HG. Upregulation of the cycline kinase subunit CKS2 increases cell proliferation rate in gastric cancer. J Cancer Res Clin Oncol. 2009;135:761-769. [PubMed] [DOI] |
| 28. | Brandt Y, Mitchell T, Wu Y, Hartley RS. Developmental downregulation of Xenopus cyclin E is phosphorylation and nuclear import dependent and is mediated by ubiquitination. Dev Biol. 2011;355:65-76. [PubMed] [DOI] |
| 29. | Sakaguchi A, Steward R. Aberrant monomethylation of histone H4 lysine 20 activates the DNA damage checkpoint in Drosophila melanogaster. J Cell Biol. 2007;176:155-162. [PubMed] [DOI] |
| 30. | Kosacka M, Piesiak P, Porebska I, Korzeniewska A, Dyla T, Jankowska R. Cyclin A and Cyclin E expression in resected non-small cell lung cancer stage I-IIIA. In Vivo. 2009;23:519-525. [PubMed] [DOI] |
| 31. | Bahnassy AA, Zekri AR, Alam El-Din HM, Aboubakr AA, Kamel K, El-Sabah MT, Mokhtar NM. The role of cyclins and cyclins inhibitors in the multistep process of HPV-associated cervical carcinoma. J Egypt Natl Canc Inst. 2006;18:292-302. [PubMed] |
| 32. | Erlandsson F, Martinsson-Ahlzén HS, Wallin KL, Hellström AC, Andersson S, Zetterberg A. Parallel cyclin E and cyclin A expression in neoplastic lesions of the uterine cervix. Br J Cancer. 2006;94:1045-1050. [PubMed] [DOI] |
| 33. | Ohgi T, Masaki T, Nakai S, Morishita A, Yukimasa S, Nagai M, Miyauchi Y, Funaki T, Kurokohchi K, Watanabe S. Expression of p33(ING1) in hepatocellular carcinoma: relationships to tumour differentiation and cyclin E kinase activity. Scand J Gastroenterol. 2002;37:1440-1448. [PubMed] [DOI] |
| 34. | Qiao X, Bhuiya TA, Spitzer M. Differentiating high-grade cervical intraepithelial lesion from atrophy in postmenopausal women using Ki-67, cyclin E, and p16 immunohistochemical analysis. J Low Genit Tract Dis. 2005;9:100-107. [PubMed] [DOI] |
| 35. | Keating JT, Cviko A, Riethdorf S, Riethdorf L, Quade BJ, Sun D, Duensing S, Sheets EE, Munger K, Crum CP. Ki-67, cyclin E, and p16INK4 are complimentary surrogate biomarkers for human papilloma virus-related cervical neoplasia. Am J Surg Pathol. 2001;25:884-891. [PubMed] [DOI] |