修回日期: 2011-05-28
接受日期: 2011-06-10
在线出版日期: 2011-06-28
本例患者肝囊肿位于肝左叶, 我们采用经胃镜胃壁切开、腹腔内超声内镜明确诊断和解剖关系、肝囊肿开窗引流、缝合胃壁切口, 最终获得预期效果. 应用自然腔道内镜下手术(NOTES)处理肝囊肿, 为肝囊肿处理提供了新的可供选择的手段, 为NOTES处理诸多争议积累了一份证据.
引文著录: 陈世耀, 曾晓清, 马丽黎, 高虹, 王剑, 周平红, 徐美东, 王萍, 王红美, 姚礼庆. 经胃内镜肝囊肿开窗术治疗肝囊肿1例. 世界华人消化杂志 2011; 19(20): 2190-2193
Revised: May 28, 2011
Accepted: June 10, 2011
Published online: June 28, 2011
We present a case of transgastric endoscopic fenestration of a symptomatic simple hepatic cyst in the left lobe. After per-oral intubation, the anterior wall of the stomach was punctured with a needle. After the anatomic location was defined by intraperitoneal endoscopic ultrasound, fenestration was performed by gastric endoscopy. The procedure was successfully performed without any difficulties. The patient had an uncomplicated postoperative course. This method is technically feasible and represents a potential new approach to the treatment of simple hepatic cysts.
- Citation: Chen SY, Zeng XQ, Ma LL, Gao H, Wang J, Zhou PH, Xu MD, Wang P, Wang HM, Yao LQ. Transgastric endoscopic fenestration of a hepatic cyst: a report of one case. Shijie Huaren Xiaohua Zazhi 2011; 19(20): 2190-2193
- URL: https://www.wjgnet.com/1009-3079/full/v19/i20/2190.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i20.2190
炎经自然腔道内镜下手术(natural orifice translumenal endoscopic surgery, NOTES)是一项内镜技术的突破. 目前已经在动物实验取得广泛成功. 本文报道1例经胃内镜肝囊肿开窗术, 为肝囊肿提供一种新的治疗方式.
女, 46岁. 因"反复中上腹隐痛3 wk"入院. 患者3 wk前出现中山腹痛, 至当地医院就诊, 查胃镜提示: 胃黏膜下肿瘤. 复旦大学附属中山医院查超声胃镜见胃底胃壁外无回声占位, 考虑肝脏左叶囊肿. 查体T: 36.9 ℃, BP: 118/80 mmHg. 全身皮肤无黄染. 腹部平软, 肝脾肋下未及, 无包块. 辅助检查: 血常规、凝血功能、肝功能、血AFP均正常. B超: 肝囊肿(肝右叶膈顶见14 mm×14 mm无回声区, 肝左外叶后缘见29 mm×24 mm无回声区). CT: 肝囊肿(肝脏左叶外侧段及右后上叶低密度灶, 直径分别为3.6 cm, 1.4 cm), 增强未见明显强化.
经伦理委员会讨论通过同意行经胃内镜肝囊肿开窗术. 向患者详细叙述手术步骤, 充分解释各项可能意外与并发症, 同时说明可供选择的其他治疗方法. 患者与家属慎重考虑, 签署知情同意书, 决定行经胃镜肝囊肿开窗术. 术前常规胸片、心电图、血常规、血生化及凝血功能等检查, 明确无手术及麻醉禁忌. 术前12 h禁食水. 术前30 min予罗氏芬、奥硝唑预防感染治疗.
手术内镜为Olympus GIF-2TQ260M型, 内镜主机为Olympus 260主机, 超声内镜为EUS2000型, 采用带球囊小探头. 操作配件包括透明帽、注射针、钩刀、热活检钳、金属铗等配件. 非一次性器械均经戊二醛10 h或环氧乙烷严格灭菌处理. 使用器械均为有SDA批号的现有内镜器械.
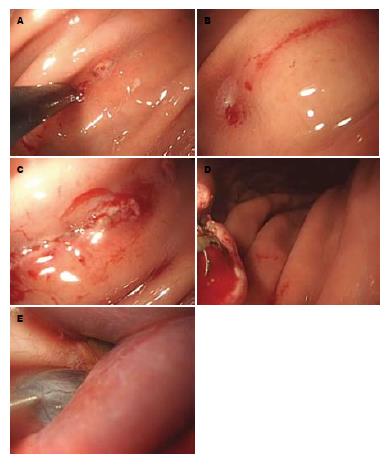
手术在腹腔镜检查室进行, 术前腹腔镜检查室紫外灯照射消毒. 患者取仰卧位, 常规气管插管全身麻醉, 给予阿托品减少分泌物和胃腔蠕动, 先行胃镜常规检查, 吸尽食管胃残留液体和分泌物, 应用生理盐水充分清洗食管与胃腔. 更换内镜, 进入胃腔后选择胃体大弯偏前壁作为切开点(图1A), 相距2 cm予氩气刀标志, 钩刀切开标志点之间1.5 cm(图1B), 黏膜切开后直接全程切开(图1C), 热活检钳处理渗血(图1D). 切开足够后通过插入和旋转将内镜推入腹腔, 充分注气后直接观察肝脏表面和周围结果, 发现肝左外叶圆形囊性隆起, 大小约3.5 cm. 置入带球囊超声小探头(频率20 MHz)置于隆起表面, 可探及无回声占位, 与肝脏组织分界处囊壁清晰. 采用注射针抽取囊液(图1E), 呈清亮状. 更换钩刀切开表面囊肿壁, 清亮液体流出, 引流通畅, 囊肿萎缩. 吸尽腹腔内残留血液和液体, 检查无出血, 吸尽腹腔内气体, 将胃镜退出胃壁至胃腔内, 以金属铗完全缝合切口, 注气检查创面无渗血和漏气, 吸尽胃腔气体退出内镜, 置入鼻胃管, 手术结束. 操作全程耗时40 min, 术中无明显出血, 未输血制品.
术后患者安返消化科病房, 胃肠减压48 h拔除, 罗氏芬、奥硝唑预防感染, 奥美拉唑抑酸治疗、营养支持治疗3 d. 术后第3天停静脉补液, 改口服抑酸治疗.
术后疼痛评估1分(0-10分主观疼痛评分系统), 未使用止痛药. 术后3 d进食流质, 7 d出院. 术后生化检查: 术后第2、3、4天随访白细胞、血沉、CRP无明显改变. 术后7 d复查CT示肝左叶囊肿消失. 术后随访至今(60 d), 无中上腹痛, 生活质量佳, 复查B超肝左叶囊肿消失.
肝囊肿是一种较常见的肝脏良性疾病, 分为寄生虫性和非寄生虫性, 前者肝棘球蚴病较为多见, 后者又可以分为先天性、创伤性、炎症性和肿瘤性. 临床常见的是先天性肝囊肿, 其发生可能是肝内迷走胆管与淋巴管在胚胎期的发育障碍或局部淋巴管因炎性上皮增生阻塞, 导致管腔内分泌物潴留所致. 可分为单发性和多发性两种. 肝囊肿可发生于任何年龄, 多见于20-50岁. 男女发生率为1:4, 多数发生于肝右叶. 囊肿大小不等, 囊壁一般较薄, 囊壁内层上皮细胞为柱状、立方形、扁平或缺如, 外层为胶原样组织. 囊液一般澄清透明, 不含胆汁. 先天性肝囊肿在正常人群中检出率为2.5%-5.0%, 生长缓慢, 大多数肝囊肿患者没有症状, 多通过超声、CT等影像学或手术中发现. 然而, 15%的患者当囊肿逐渐增大, 压迫肝脏及邻近脏器时出现症状, 包括腹部不适、腹痛、腹部肿块、黄疸、门脉高压等.
一般认为直径≤4.5 cm的单发性肝囊肿可暂不予治疗, 因单发性肝囊肿恶变可能性很小, 可采用B超随访. 直径≥4.5 cm或有症状患者可予治疗. 临床上治疗非寄生虫性肝囊肿目前的主要治疗方法有两种: 一种是在B超或CT引导下行囊肿穿刺抽液治疗, 囊肿抽液术创伤小, 但仅能暂时缓解症状, 且容易复发, 据报道肝囊肿穿刺抽液后复发率高达100%. 近年来更常用方法是在抽吸囊液的同时注入硬化剂或无水乙醇等, 以此破坏具有分泌功能的囊壁上皮细胞, 从而减少复发率至20%左右[1]. 而且此方法可以反复多次操作以增强治疗效果. 另一种是手术治疗, 分为腹腔镜手术和开腹手术, 手术方式有囊肿开窗术、内引流术、囊肿切除术或肝部分切除术. 开窗术通过去除一部分囊肿壁, 使囊内液体可以流入腹腔, 通常适用于位于肝脏表面的囊肿. 腹腔镜下肝囊肿开窗手术因其创伤小, 且保证治疗效果, 目前已经成为代替手术治疗的手段之一.
20世纪90年代末Anthony Kalloo教授提出了"经口经胃壁腹腔镜技术"的观念. 2005年美国消化内镜学会和美国胃肠内镜外科学会的专家小组正式提出了NOTES的新概念. 目前绝大多数自然开口经腔内镜的手术案例限于动物实验研究. 国内已有报道成功采用经胃内镜行胃窦至胃体上部前壁外巨大肝囊肿的开窗术[2]. 但关于这项技术仍有许多问题存在争议: 如对空腔脏器及切开部位如何选择[3]. 采用何种方式确切关闭空腔脏器的切口, 术中如何精确操作、充分暴露及严密止血, 如何避免内镜或手术标本对自然腔道的损伤, 如何预防和控制感染, 对于漏的发生如何有效预防等[4-6].
选择切口位置进入腹腔时需要考虑离手术区域近, 避免损伤邻居器官以及切口闭合难度. 经胃手术大部分研究者借鉴经皮内镜胃造瘘术(percutaneous endoscopic gastrostomy-like, PEG)[7], 经胃前壁大弯进入腹腔, 先行穿刺, 再使用气囊将穿刺点扩张至18 mm. 该部位, 其壁外为腹壁, 没有肝脏或其他脏器覆盖. 本例手术选择胃体大弯前壁作为切开部位, 使用钩刀切开胃壁, 热活检钳止血.
肝囊肿切开时最常见问题是出血和胆瘘. 出血常常是肝脏损伤的表现, 胆汁性腹膜炎是囊肿与胆管相通的结果. 本例患者首先穿刺抽吸囊液清亮, 无血性囊性和胆汁, 采用切开刀开窗手术, 直接引流到腹腔. 一旦术中发现穿刺液为黄色, 考虑囊肿与胆管相同, 可以采用与B超引导下穿刺注射无水酒精相同的办法在抽吸完囊液后注射无水酒精破坏囊壁, 达到根治的目的, 需要注意无水酒精不能流入腹腔, 注射后放置5-10 min后抽出. 另一种办法为采用氩气刀彻底处理囊壁, 或者更换为腹腔镜手术切除囊壁.
预防感染是NOTES面临的主要问题之一. 胃壁切开前胃腔清洗、内镜器械和附件的消毒、减少或者避免术中腹腔内灌注、术中术后抗生素应用等可有效预防术后感染的发生. 本例NOTES中我们对所有器械和操作场地进行严格消毒, 术中保持无菌操作, 手术前30 min开始静脉滴注头孢曲松2.0 g及奥硝唑500 mg, 术后患者未发生腹腔及胃壁切口的感染.
动物实验显示经胃和经结肠NOTES腹腔镜和腹膜内超声相结合(NOTES-EUS)的方法是安全的、可行的、并可提供足够的视野[8]. 在2010 DDW会议上分别有两项动物研究在NOTES中, 分别对胰腺及肝脏组织进行超声探查. 通过EUS-NOTES可以到达胰腺前后区域, 从而能更好地提高腹腔疾病的诊断和内镜治疗[9,10]. 本例患者中通过带水囊的小探头进入腹腔评估肝囊肿的诊断及与肝脏及周围血管的关系.
NOTES手术作为新兴的微创技术具有痛苦小、恢复快等优点. EUS可以作为NOTES的一种补充设备. 目前大多为动物实验, 人体开展仍需积累更多经验. 本例NOTES处理肝囊肿, 为肝囊肿处理提供了新的可供选择的手段, 为NOTES手术诸多争议积累了一份证据. 随着研究的深入、技术的革新和临床经验的积累, NOTES临床应用将更具前景.
炎症性肠病的发病机制尚不完全明确, 其中遗传因素与炎症性肠病的发病密切有关. 目前已发现多个与IBD相关的易感基因及易感单核苷酸多态性(SNP)位点, IL-23R即是其中之一. 由于IBD发病机制复杂且存在显著种族差异性, 国际上对IL-23R的研究争议颇多, 而我国目前有关IL-23R基因多态性与IBD临床特征相关性尚不明确.
邢建峰, 副教授, 西安交通大学医学院
目前已发现多个IBD易感基因和易感SNP位点, 这也进一步证实了IBD的发病与遗传因素相关, 但目前尚未找到确切的与我国IBD明显相关的基因和SNP位点, 而这也将是今后研究IBD发病机制的热点之一.
Duerr等报道, IL-23R存在rs11 209026, p.Arg 381Gln多态性, 且与CD相关. 然而患者家族中存在强烈的传递不平衡. IL-23R基因多态性在不同IBD患者种群中的分布及相关性尚不明确.
本研究首次对我国IBD患者IL-23R 3个非同义SNP进行研究, 探讨了其等位基因的表现频率分布, 了解了我国IBD患者的IL-23R基因多态性与IBD的关系.
本文选题新颖, 对炎症性肠病的发病机制的探讨有重要的现实意义.
编辑: 李薇 电编:何基才
| 1. | Erdogan D, van Delden OM, Rauws EA, Busch OR, Lameris JS, Gouma DJ, van Gulik TM. Results of percutaneous sclerotherapy and surgical treatment in patients with symptomatic simple liver cysts and polycystic liver disease. World J Gastroenterol. 2007;13:3095-3100. [PubMed] |
| 3. | Ko CW, Shin EJ, Buscaglia JM, Clarke JO, Magno P, Giday SA, Chung SS, Cotton PB, Gostout CJ, Hawes RH. Preliminary pneumoperitoneum facilitates transgastric access into the peritoneal cavity for natural orifice transluminal endoscopic surgery: a pilot study in a live porcine model. Endoscopy. 2007;39:849-853. [PubMed] [DOI] |
| 4. | Swanstrom LL, Kozarek R, Pasricha PJ, Gross S, Birkett D, Park PO, Saadat V, Ewers R, Swain P. Development of a new access device for transgastric surgery. J Gastrointest Surg. 2005;9:1129-1136; discussion 1129-1136;. [PubMed] [DOI] |
| 5. | Hochberger J, Lamadé W. Transgastric surgery in the abdomen: the dawn of a new era? Gastrointest Endosc. 2005;62:293-296. [PubMed] [DOI] |
| 7. | Kantsevoy SV, Jagannath SB, Niiyama H, Isakovich NV, Chung SS, Cotton PB, Gostout CJ, Hawes RH, Pasricha PJ, Kalloo AN. A novel safe approach to the peritoneal cavity for per-oral transgastric endoscopic procedures. Gastrointest Endosc. 2007;65:497-500. [PubMed] [DOI] |
| 8. | Voermans RP, van Berge Henegouwen MI, Bemelman WA, Fockens P. Feasibility of transgastric and transcolonic natural orifice transluminal endoscopic surgery peritoneoscopy combined with intraperitoneal EUS. Gastrointest Endosc. 2009;69:e61-e67. [PubMed] [DOI] |
| 9. | Saftoiu A, Vilmann P, Surlin V, Fleming JB, Uthamanthil RK, Rimbas M, Singh H, Bektas M, Bhutani MS. Feasibility study of EUS-NOTES as a novel approach for pancreatic cancer staging and therapy: an international collaborative study. Gastrointest Endosc. 2010;71:AB222-AB223. [DOI] |
| 10. | Fyock C, Kirtane T, Forsmark C, Wagh M. Intraoperative NOTES Endosonography and Identification of Mock Hepatic Lesions. Gastrointest Endosc. 2010;71:AB321. [DOI] |