修回日期: 2011-06-21
接受日期: 2011-06-28
在线出版日期: 2011-07-18
目的: 研究环氧合酶2(COX-2)与多药耐药基因葡萄糖神经酰胺合成酶(GCS)在胃癌组织中的表达及其相关性, 初步探讨COX-2参与胃癌多药耐药的可能机制.
方法: 采用免疫组织化学法对经手术切除的63例胃癌组织标本及30例非癌性胃组织标本中COX-2及GCS的表达情况进行研究, 并且对COX-2与GCS在胃癌组织中的表达进行相关性分析.
结果: COX-2、GCS在胃癌组织中的阳性表达均高于非癌性胃组织(87.3% vs 36.7%; 49.2% vs 23.3%, 均P<0.05). 在有淋巴结转移的胃癌组织中COX-2阳性表达率高于无淋巴结转移的胃癌组织(100% vs 69.2%, P<0.05), 在不同年龄、性别、不同分化程度、不同的癌肿浸润深度中COX-2的阳性表达率无明显差异; GCS在胃癌组织中的阳性表达率与有无淋巴结转移、年龄、性别、分化程度、不同的侵犯深度等均无明显关系. 在胃癌组织中, COX-2与GCS的表达正相关(r = 0.724, P = 0.004).
结论: GCS在胃癌组织中存在高表达, 可能是引起胃癌原发性多药耐药的耐药基因之一; 在胃癌组织中, COX-2与GCS的表达存在正相关, COX-2介导胃癌耐药可能与影响GCS在胃癌组织中的表达有关.
引文著录: 王俊先, 张开光, 李诚, 李祥春, 王晓秋, 丁敏. COX-2与GCS在胃癌组织中的表达及意义. 世界华人消化杂志 2011; 19(20): 2171-2175
Revised: June 21, 2011
Accepted: June 28, 2011
Published online: July 18, 2011
AIM: To investigate the expression of cyclooxygenase-2 (COX-2) and glucosylceramide synthase (GCS) in gastric cancer and to analyze their clinical significance.
METHODS: Immunohistochemistry was used to investigate the expression of COX-2 and GCS in 63 cases of gastric cancer tissues and 30 cases of non-gastric cancer tissues. The correlation of COX-2 and GCS expression with patient's age, sex, tumor histological type, differentiation, and lymph node metastasis was analyzed.
RESULTS: The positive rate of COX-2 expression in gastric cancer was higher than that in non-cancerous tissue (87.3% vs 36.7%, P < 0.05). The positive rate of GCS expression in gastric cancer was also higher than that in non-cancerous tissue (49.2% vs 23.3%, P < 0.05). Neither COX-2 nor GCS expression was related with age, sex, tumor differentiation, depth of invasion or histological type (all P > 0.05). The positive rate of COX-2 in patients with lymph node metastasis was significantly higher than that in patients without lymph node metastasis (100% vs 69.2%, P < 0.05), whereas the positive rate of GST-π was not related with lymph node metastasis (P > 0.05). There is a significant correlation between the expression of COX-2 and that of GST-π in gastric cancer (r = 0.724, P = 0.004).
CONCLUSION: GCS is highly expressed in gastric cancer and may be involved in tumor drug resistance. COX-2 may mediate drug resistance by influencing the expression of GCS in gastric cancer.
- Citation: Wang JX, Zhang KG, Li C, Li XC, Wang XQ, Ding M. Significance of expression of COX-2 and GCS in gastric cancer. Shijie Huaren Xiaohua Zazhi 2011; 19(20): 2171-2175
- URL: https://www.wjgnet.com/1009-3079/full/v19/i20/2171.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i20.2171
化疗是综合治疗胃癌的重要手段, 但肿瘤多药耐药(multidrug resistance, MDR)限制了化疗药物的进一步应用. 研究MDR的发生及影响机制, 对指导临床合理化疗有重要的意义. MDR的产生机制较为复杂, 其中耐药基因的激活与表达增加, 被认为是MDR的主要原因. 葡萄糖神经酰胺合成酶(glucosylceramide synthase, GCS)是近年来发现的一种重要的MOR基因, 在恶性肿瘤组织或细胞株中有较高表达, 被认为是引起肿瘤MOR的重要基因之一[1-3]. 有研究表明, COX-2参与肿瘤MOR的发生[4], 而选择性COX-2抑制剂可以增加肿瘤对化疗药物的敏感性[5], 其具体机制尚不清楚, 围绕以COX-2为靶点逆转肿瘤耐药成为目前这一领域的研究热点. 本试验对COX-2及多药耐药基因GCS在胃癌组织中的表达进行研究, 同时对他们在胃癌组织中的表达进行相关性分析.
收集2008-06-10在安徽省立医院外科手术切除并被病理证实为腺癌的胃癌组织标本63例, 所有标本来源患者术前均未接受任何形式的抗肿瘤治疗. 其中男47例, 女16例; 患者年龄26-79(平均年龄59)岁, 其中≥55岁者44例, <55岁者19例; 高、中分化腺癌25例, 低分化腺癌38例; 伴有淋巴结转移者37例, 无淋巴结转移者26例. 癌肿仅限于黏膜及黏膜下(早期胃癌)者14例, 侵犯肌层者9例, 侵及全层或侵及浆膜外者40例. 同时收集同期手术切除并被病理证实为非癌性胃组织标本30例为对照组, 胃癌组与非胃癌组标本来源患者在年龄、性别、用药等可能影响试验观察结果的情况没有明显差异, 以保证资料的可比性. 即用型COX-2单克隆一抗, 即用型二抗试剂盒PV-6000, DAB显色剂等试剂均购自北京中杉金桥生物有限公司; GCS多克隆一抗原液(粉针剂, 使用时临时配制, 本试验所用浓度为1:200), 购自北京博奥森生物科技有限公司.
1.2.1 免疫组织化学法检测COX-2和GCS在胃癌组织和非癌性胃组织中的表达: 所有标本经标本均用40 g/L的中性甲醛固定, 石蜡包埋, 4 μm连续切片, 每份标本切3张, 1张行HE染色, 另2张行免疫组织化学染色, 试验步骤严格按照试剂说明书提供的操作步骤进行. 以PBS代替一抗作阴性对照, 以已知阳性表达的胃组织标本作为阳性对照.
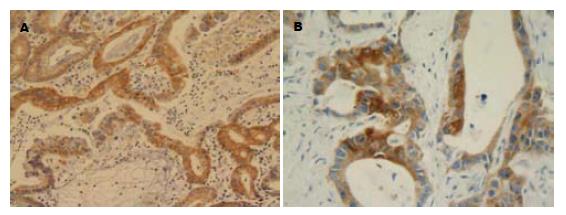
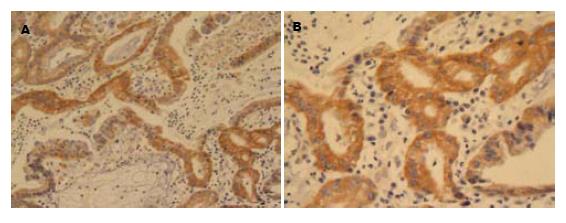
1.2.2 结果判断: COX-2和GCS均为胞质表达为主. 试验采用的评分标准如下[6]: 以胞质表达颗粒的着色深浅及着色的阳性细胞数进行评分: 无着色为0分, 淡黄色为1分, 棕黄色为2分, 棕褐色为3分. 无细胞着色为0分, 着色细胞<10%为1分, 10-25%为1分, 25-50%为2分, 50-75%, 为3分, >75%为4分. 以二者的分值之积作为最终评分数值. ≤3分者为阴性, 4-6分为+, 7-9为++, 9-12为+++(以上由两位病理科医生盲法操作); 另外用显微照相机将所有免疫组织化学玻片在相同的工作条件下一次性进行拍摄, 所有照片均保存为TIFF格式, 用Image-pro plus(IPP)6.0图像分析软件, 采用积分吸光度(integrated absorbance, IA)对所拍照片阳性部位进行图像分析, 收集图像数据.
统计学处理 用SPSS13.0软件进行统计学分析, 胃癌组与对照组中COX-2与GCS阳性表达率的差异, 采用卡方检验进行分析; 胃癌组织中COX-2与GCS之间表达的相关性用两变量(IA值)相关性进行分析. 检验水准为α = 0.05.
COX-2及GCS在胃癌组织中的阳性表达率均高于非癌性胃组织(87.3% vs 36.7%, 49.2% vs 23.3%, 均P<0.05, 表1, 图1). 在有淋巴结转移的胃癌组织中COX-2阳性表达率高于无淋巴结转移的胃癌组织(100% vs 69.2%, P<0.05); GCS在有无淋巴结转移的胃癌组织中的阳性表达率无明显差别(48.6% vs 50.0%, P>0.05, 图2); COX-2与GCS在胃癌组织中的阳性表达率与年龄、性别、肿瘤的分化程度、胃癌组织侵犯深度等均无明显关系(表2).
| 组织 | n | COX-2(n) | χ2值 | P值 | GCS(n) | χ2值 | P值 | ||
| + | - | + | - | ||||||
| 胃癌 | 63 | 55 | 8 | 25.289 | 0.000 | 31 | 32 | 5.930 | 0.023 |
| 非胃癌 | 30 | 11 | 19 | 7 | 23 | ||||
| n | COX-2 | GCS | |||||||
| - | + | ++ | +++ | - | + | ++ | +++ | ||
| 年龄(岁) | |||||||||
| ≥55 | 44 | 6 | 14 | 16 | 8 | 23 | 15 | 6 | 0 |
| <55 | 19 | 2 | 9 | 4 | 4 | 9 | 8 | 1 | 1 |
| 性别 | |||||||||
| 男 | 47 | 6 | 19 | 13 | 9 | 24 | 18 | 5 | 0 |
| 女 | 16 | 2 | 4 | 7 | 3 | 8 | 5 | 2 | 1 |
| 分化程度 | |||||||||
| 高中分化腺癌 | 25 | 1 | 9 | 12 | 3 | 12 | 10 | 2 | 1 |
| 低分化腺癌 | 38 | 7 | 14 | 8 | 9 | 20 | 13 | 5 | 0 |
| 浸润深度 | |||||||||
| 黏膜及黏膜下层 | 14 | 1 | 7 | 4 | 2 | 6 | 5 | 2 | 1 |
| 肌层 | 9 | 1 | 3 | 4 | 1 | 4 | 5 | 0 | 0 |
| 全层及浆膜外 | 40 | 6 | 13 | 12 | 9 | 22 | 13 | 5 | 0 |
| 淋巴结转移 | |||||||||
| 有 | 37 | 0 | 12 | 17 | 8 | 19 | 14 | 3 | 1 |
| 无 | 26 | 8 | 11 | 3 | 4 | 19 | 9 | 4 | 0 |
将同一组织切片的两种蛋白表达的IA值作为配对资料, 用两变量相关性的分析方法, 分析COX-2及GCS在胃癌组织中表达的相关性. 结果显示: 在胃癌组织中, COX-2与GCS的表达存在明显的正相关性(r = 0.724, P = 0.004).
MDR[7]是指肿瘤细胞可耐受结构、功能及杀伤机制不同的多种药物的致死量, 一旦肿瘤细胞对某种药物产生耐受, 即可以同时对多种作用机制不同的药物产生耐受. 肿瘤细胞在治疗的初始阶段就对多种化疗药物无反应, 称之为原发性耐药或内在耐药(intrinsic drug resistance); 如果在化疗初期疗效很好, 经过几个疗程后, 肿瘤细胞对所用药物产生了耐药性, 则称之为获得性耐药(acquired drug resistance). 肿瘤多药耐药的产生机制较为复杂, 目前已经证实耐药基因的激活与表达增加肯定与恶性肿瘤包括胃癌的多药耐药性有明显的关系[8].
GCS属于糖基转移酶家族成员, 可以催化尿苷二磷酸葡萄糖(uridine diphosphoglucose, UDPG)上的葡萄糖基以β型糖苷键与神经酰胺结合[9], 使神经酰胺糖基化为葡萄糖神经酰胺(glucosylceramide, GlcCer). 神经酰胺是细胞凋亡过程中的重要的第二信使, 可以通过与其下游蛋白激酶如神经酰胺活化蛋白激酶(ceramide-activated protein kinase, CAPK)、Bcl-2、半胱天冬酶(caspases)级联活化等途径参与调节细胞的凋亡[10,11], 许多化疗药物(如阿霉素、长春新碱)等可以使细胞内的神经酰胺水平增高[12]. GCS则催化神经酰胺糖基化, 生成GlcCer, 从而抑制细胞凋亡, 进而拮抗化疗药引起的促细胞凋亡作用, 从而使肿瘤产生多药耐药. GCS参与肿瘤多药耐药还可能与其调节经典耐药基因p-gp的表达有关[13,14], 也可能与调控凋亡基因p53及其他与凋亡相关的基因有关[15,16]. 关于GCS与胃癌多药耐药的研究, 现在尚处于初始阶段, 到目前为止尚未见GCS在胃癌组织中表达的研究报道, 张艳等[3]在对耐药胃癌细胞株进行研究时发现, GCS的表达增多, 并且认为GCS是引起耐药细胞株耐药的重要基因.
本研究发现, 在未经任何治疗胃癌患者的胃癌组织中, 其阳性表达也明显高于非胃癌胃组织, 并且GCS的阳性表达与患者的年龄、性别、分化程度、临床分期等无明显关系, 表明GCS可能是引起胃癌原发性MDR的耐药基因之一, 且其介导胃癌MDR可能在胃癌发病时即可伴随出现.
大量研究表明, COX-2是一种诱导性酶, 对胃癌的发生与发展起重要作用. COX-2还参与胃癌的多药耐药的产生[17,18]. 本研究表明, 在胃癌组织中, COX-2存在高表达, 并且与淋巴结转移有明显关系, 进一步证实COX-2对胃癌发生与发展的作用, 同时本研究还发现, COX-2与GCS在胃癌组织中的表达存在正相关, 表明COX-2可能对胃癌耐药基因GCS的表达有一定的影响, COX-2介导胃癌耐药可能与影响胃癌组织中GCS的表达有关. COX-2可以促进抗凋亡基因Bcl-2的表达[19], 而GCS与Bcl-2也存在一定的联系[11]; COX-2参与肿瘤MDR与p-gp有关, 而GCS参与肿瘤耐药也与p-gp有关[14], 是否存在以Bcl-2或p-gp为中间环节将COX-2与GCS建立关系的可能, 将是我们下一步研究的内容之一.
环氧合酶-2 (COX-2)与肿瘤的发生发展有密切的关系, 同时也被证明参与肿瘤耐药的发生, 可以调节多种耐药基因的表达, 选择性COX-2抑制剂已被证明可以降低某些耐药基因的表达.
黄颖秋, 教授, 本溪钢铁集团有限责任公司总医院消化内科
实验证实COX-2可以影响肿瘤耐药基因的表达, 进而影响肿瘤对化疗药物的敏感性, 围绕COX-2对肿瘤耐药基因表达的影响机制及以COX-2为靶点减低或逆转肿瘤耐药成为目前医学科研的一个热点.
Senzaki等报道COX-2可增加肿瘤对化疗药物的敏感性, 但未对其机制进行进一步阐述, 有报道称COX-2选择性抑制剂可以增加降低肿瘤组织中经典耐药蛋白P-gp的表达, 关于COX-2与GCS在胃癌组织中的关系未见相关报道.
本文首次报道GCS在胃癌组织中的表达, 并对COX-2和GCS在胃癌组织中的表达进行相关性研究, 从分子生物学角度对COX-2介导胃癌耐药的可能机制进行初步探讨
本文对COX-2和GCS在胃癌组织中的相关性表达初步探讨, 为从GCS面上进一步研究COX-2介导胃癌耐药机制和以COX-2为靶点逆转胃癌耐药提供理论依据.
本文选题较新颖, 可读性和学术性较好, 为探讨胃癌的耐药性机制提供了一定的理论依据.
编辑: 曹丽鸥 电编:张洋
| 1. | Ruckhäberle E, Karn T, Hanker L, Gätje R, Metzler D, Holtrich U, Kaufmann M, Rody A. Prognostic relevance of glucosylceramide synthase (GCS) expression in breast cancer. J Cancer Res Clin Oncol. 2009;135:81-90. [PubMed] [DOI] |
| 2. | Gouazé V, Yu JY, Bleicher RJ, Han TY, Liu YY, Wang H, Gottesman MM, Bitterman A, Giuliano AE, Cabot MC. Overexpression of glucosylceramide synthase and P-glycoprotein in cancer cells selected for resistance to natural product chemotherapy. Mol Cancer Ther. 2004;3:633-639. [PubMed] |
| 3. | 张 艳, 刘 宗文, 贾 丹辉, 乐 晓萍, 张 钦宪. 葡萄糖神经酰胺合成酶基因在人胃癌细胞SGC-7901及SGC-7901/VCR的表达和意义. 世界华人消化杂志. 2007;15:1008-1011. [DOI] |
| 4. | Patel VA, Dunn MJ, Sorokin A. Regulation of MDR-1 (P-glycoprotein) by cyclooxygenase-2. J Biol Chem. 2002;277:38915-38920. [PubMed] [DOI] |
| 5. | Senzaki M, Ishida S, Yada A, Hanai M, Fujiwara K, Inoue S, Kimura T, Kurakata S. CS-706, a novel cyclooxygenase-2 selective inhibitor, prolonged the survival of tumor-bearing mice when treated alone or in combination with anti-tumor chemotherapeutic agents. Int J Cancer. 2008;122:1384-1390. [PubMed] [DOI] |
| 6. | Koga H, Sakisaka S, Ohishi M, Kawaguchi T, Taniguchi E, Sasatomi K, Harada M, Kusaba T, Tanaka M, Kimura R. Expression of cyclooxygenase-2 in human hepatocellular carcinoma: relevance to tumor dedifferentiation. Hepatology. 1999;29:688-696. [PubMed] [DOI] |
| 7. | Gianni L. Anthracycline resistance: the problem and its current definition. Semin Oncol. 1997;24:S10-11-S10-17. [PubMed] |
| 8. | Zhang D, Fan D. Multidrug resistance in gastric cancer: recent research advances and ongoing therapeutic challenges. Expert Rev Anticancer Ther. 2007;7:1369-1378. [PubMed] [DOI] |
| 9. | Bleicher RJ, Cabot MC. Glucosylceramide synthase and apoptosis. Biochim Biophys Acta. 2002;1585:172-178. [PubMed] |
| 10. | Lin CF, Chen CL, Lin YS. Ceramide in apoptotic signaling and anticancer therapy. Curr Med Chem. 2006;13:1609-1616. [PubMed] [DOI] |
| 12. | Modrak DE, Gold DV, Goldenberg DM. Sphingolipid targets in cancer therapy. Mol Cancer Ther. 2006;5:200-208. [PubMed] [DOI] |
| 13. | Chai L, McLaren RP, Byrne A, Chuang WL, Huang Y, Dufault MR, Pacheco J, Madhiwalla S, Zhang X, Zhang M. The chemosensitizing activity of inhibitors of glucosylceramide synthase is mediated primarily through modulation of P-gp function. Int J Oncol. 2011;38:701-711. [PubMed] |
| 14. | Liu YY, Gupta V, Patwardhan GA, Bhinge K, Zhao Y, Bao J, Mehendale H, Cabot MC, Li YT, Jazwinski SM. Glucosylceramide synthase upregulates MDR1 expression in the regulation of cancer drug resistance through cSrc and beta-catenin signaling. Mol Cancer. 2010;9:145. [PubMed] [DOI] |
| 15. | Liu YY, Patwardhan GA, Bhinge K, Gupta V, Gu X, Jazwinski SM. Suppression of glucosylceramide synthase restores p53-dependent apoptosis in mutant p53 cancer cells. Cancer Res. 2011;71:2276-2285. [PubMed] [DOI] |
| 16. | Liu Y, Xie KM, Yang GQ, Bai XM, Shi YP, Mu HJ, Qiao WZ, Zhang B, Xie P. GCS induces multidrug resistance by regulating apoptosis-related genes in K562/AO2 cell line. Cancer Chemother Pharmacol. 2010;66:433-439. [PubMed] [DOI] |
| 17. | Nardone G, Rocco A, Vaira D, Staibano S, Budillon A, Tatangelo F, Sciulli MG, Perna F, Salvatore G, Di Benedetto M. Expression of COX-2, mPGE-synthase1, MDR-1 (P-gp), and Bcl-xL: a molecular pathway of H pylori-related gastric carcinogenesis. J Pathol. 2004;202:305-312. [PubMed] [DOI] |
| 19. | Huang DS, Shen KZ, Wei JF, Liang TB, Zheng SS, Xie HY. Specific COX-2 inhibitor NS398 induces apoptosis in human liver cancer cell line HepG2 through BCL-2. World J Gastroenterol. 2005;11:204-207. [PubMed] |