修回日期: 2011-06-21
接受日期: 2011-06-28
在线出版日期: 2011-07-18
目的: 探讨肝再生过程中NF-κB、RBP-Jκ的作用及苦参碱对其调节机制, 揭示苦参碱参与肝再生启动的分子机制.
方法: 60只SD大鼠随机分为2组, 每组30只. 肝大部分切除组: 建立2/3肝切除模型; 苦参碱/肝大部分切除组: 建立2/3肝切除模型, 同时以苦参碱灌胃. 观察点为术后1、3、7、14、21 d, 通过苏木精-伊红染色、透射电解、免疫组织化学、RT-PCR方法, 在不同时间点检测各实验组肝脏组织学、超微结构、NF-κB蛋白、RBP-Jκ mRNA的表达.
结果: 苏木精-伊红染色可见肝大部分切除组术后第1天出现少量卵圆细胞增生, 7-14 d为高峰, 14-21 d卵圆细胞增生逐渐减少, 部分出现小肝细胞结节. 苦参碱/肝大部分切除组卵圆细胞增生减少. 透射电镜观察到卵圆细胞桥粒连接等特征性结构. 肝大部分切除组术后14 d NF-κB蛋白、RBP-Jκ mRNA为表达高峰, 21 d表达降低. 苦参碱/肝大部分切除组NF-κB蛋白、RBP-Jκ mRNA表达均较低.
结论: 苦参碱通过下调Notch-RBP-Jκ-NF-κB信号, 抑制卵圆细胞增生, 并促进其向小肝细胞分化参与肝再生启动.
引文著录: 杨志云, 王莉, 侯艺鑫, 王宪波. NF-κB和RBP-Jκ在大鼠肝再生过程中的作用及苦参碱的调节机制. 世界华人消化杂志 2011; 19(20): 2166-2170
Revised: June 21, 2011
Accepted: June 28, 2011
Published online: July 18, 2011
AIM: To explore the role that NF-κB and RBP-Jκ play during matrine-promoted hepatic regeneration.
METHODS: Sixty SD rats were equally and randomly divided into two groups: model group and matrine group. Both groups of rats underwent 2/3 partial hepatectomy. The matrine group was intragastrically administrated with matrine. Hepatic histology, ultramicrostructure and the expression of NF-κB protein and RBP-Jκ mRNA were evaluated by hematoxylin-eosin staining, transmission electron microscopy, immunohistochemistry and RT-PCR at different time points (1, 3, 7, 14, and 21 d) after operation.
RESULTS: The number of oval cells increased on day 1 after operation in the model group, reached the peak on days 7-14, but decreased on days 14-21. Treatment with matrine decreased the number of oval cells. Desmosome junctions were observed in hepatic oval cells by transmission electron microscopy. The expression of NF-κB protein and RBP-Jκ mRNA reached the peak 14 d after operation in the model group. Treatment with matrine decreased the expression of NF-κB protein and RBP-Jκ mRNA on day 21.
CONCLUSION: Matrine promotes hepatic regenerate by negatively regulating the Notch-RBP-Jκ-NF-κB signal pathway, inhibiting the proliferation of oval cells, and promoting the differentiation of oval cells.
- Citation: Yang ZY, Wang L, Hou YX, Wang XB. Matrine promotes hepatic regeneration by negatively regulating the Notch-RBP-Jκ-NF-κB signal pathway in rats. Shijie Huaren Xiaohua Zazhi 2011; 19(20): 2166-2170
- URL: https://www.wjgnet.com/1009-3079/full/v19/i20/2166.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i20.2166
大鼠肝组织具有很强的修复及再生能力, 当肝脏受到严重损伤时, 成熟肝细胞增殖受限, 肝干细胞再生是成熟肝细胞增殖的一种补充. 中药诱导干细胞定向分化是近年来一个新兴的研究领域, 中药强调多靶点体系协同作用, 相关诱导机制尚不十分清楚. 苦参碱为豆科植物苦参的主要成分, 具有调节免疫、抗炎、抗病毒、抑制肿瘤细胞生长及诱导肿瘤细胞分化等作用. 本实验观察了在大鼠肝大部分切除后肝再生过程中核转录因子NF-κB、Notch信号途径转录因子RBP-Jκ等信号分子的表达, 苦参碱的干预作用, 以期阐明苦参碱参与肝再生的相关作用机制.
SPF级♂SD大鼠, 周龄6 wk, 体质量120-150 g, 购自北京维通利华实验动物技术有限公司, 合格证号SCXK(京)2007-0001. 苦参碱标准品购自中国药品生物制品检定所(批号: 110780-200402). 山羊抗大鼠NF-κB抗体购自Santa Cruz公司. SP免疫组织化学染色试剂盒均购自DaKo试剂公司. RBP-Jκ引物由上海生物工程公司合成, RNA提取试剂TRIzol Reagent为Invitrogen公司产品、逆转录酶(M-MLV Reverse Transcriptase)为Promega公司产品, 核糖核酸酶抑制剂(Ribonuclease Inhibitor)、Taq DNA聚合酶(Taq DNA polymerase)、随机引物(Random primers)均为TaKaRa公司产品.
1.2.1 分组及建立2/3肝切除模型: 实验动物饲养于中日友好医院临床研究所国家二级实验动物中心, 饲养环境、实验动物、饲料、饮用水均无菌, 环境温度18 ℃-24 ℃, 湿度40%-60%. 60只SD大鼠随机分为2组, 每组30只. 肝大部分切除组: 建立2/3肝切除模型; 苦参碱/肝大部分切除组: 建立2/3肝切除模型, 同时以苦参碱用生理盐水配成2.5 g/L浓度, 按10 mL/kg灌胃. 建立2/3肝切除模型: 1%戊巴比妥麻醉后开腹, 游离肝左叶、中叶、尾状叶, 从根部结扎, 剪断游离端, 留下右叶及三角叶, 止血, 缝合切口. 分别于手术后第1、3、7、14、21天处死大鼠, 取肝组织进行检测.
1.2.2 苏木素-伊红染色: 石蜡切片二甲苯脱蜡, 600-1 000 mL/L乙醇依次脱苯, 苏木素浸泡5 min, 蒸馏水冲洗, 浸1%盐酸酒精、1%氨水各1-2S'伊红浸泡5 min, 蒸馏水冲洗3-4次, 700、800、900 mL/L乙醇各脱水1次, 1 000 mL/L乙醇脱水2次, 二甲苯透明, 中性树脂封片.
1.2.3 透射电镜观察肝再生细胞超微结构: 肝组织先经包埋剂环氧树脂Epon618和纯丙酮1:1浸透1 h, 3:1浸透过夜, 纯包埋剂浸透5 h以上后包埋, 聚合固化, 染色观察.
1.2.4 免疫组织化学观察NF-κB蛋白表达: 蜡块组织切片高温高压热修复2 min, 待冷却后, 自来水洗2遍, 蒸馏水洗1遍, H2O2中浸泡10 min, 消灭内源性过氧化物酶, 蒸馏水洗1遍, PBS浸泡5 min, 晾干, 放入湿盒中, 滴加50 μL封闭血清, 室温孵育50 min, 甩掉血清, 加50 μL一抗山羊抗大鼠NF-κB(1:200)多克隆抗体37 ℃孵育40 min, PBS洗3×5 min, 加50 μL生物素标记的二抗, 37 ℃孵育40 min, PBS洗3×5 min, 50 μL链亲和素-过氧化物酶溶液, 37 ℃, 15 min, PBS洗3×5 min, 加入100 μL新配制的DAB溶液, 显色5-10 min; 自来水冲洗, 苏木素复染30 s, 梯度脱水, 中性树脂封片, 显微镜下观察, 细胞质胞膜染成棕色为阳性. 彩色图文分析系统对染色阳性部位灰度值进行定量分析.
1.2.5 RT-PCR检测RBP-Jκ mRNA表达: 按试剂盒说明提取肝组织总RNA、反转成CDNA、PCR扩增. RBP-Jκ的PCR引物为: 5'-CCA ATT TCA GGC CAC TCC A-3'(上游), 5'-CTC TAC ATC CCC AAA CCA CAC TC-3'(下游), 以β-actin为内参. 扩增产物在1.5%琼脂糖凝胶(含EB)上电泳, 用凝胶图像分析系统(Gel-Pro Analyzer Version 3.0)进行吸光度半定量分析.
统计学处理 应用SPSS13.0统计软件进行统计学分析, 组间比较采用t检验, P<0.05为差异显著意义.
肝大部分切除组: 术后第1天可见少量卵圆细胞沿小胆管周围增生, 卵圆细胞体积约为成熟肝细胞的1/2, 核较大, 胞质少, 核质比高. 10-14 d为卵圆细胞大量增生的高峰, 以汇管区为中心向肝小叶内伸展, 至21 d卵圆细胞增生逐渐减少. 苦参碱/肝大部分切除组: 可见在多个实验观察点卵圆细胞增生较肝大部分切除组均减少, 尤其以14 d观察点更明显.
再生肝组织中卵圆细胞超微结构提示: 直径约6-10 μm, 核较大, 线粒体、内质网等细胞器较少, 胞质内可见张力微丝(图1), 细胞间有桥粒连接, 以上两点被认为是卵圆细胞的特征性结构.
肝大部分切除组再生肝组织中术后第3天可见NF-κB蛋白以汇管区周围高表达, 逐渐向肝小叶内延伸, 为胞浆和胞膜着色. 观察术后1、3、7、14、21 d, 14 d为表达高峰, 与术后3 d相比汇管区周围表达渐减少, 再生肝小叶内表达渐增多, 21 d表达渐减少. 苦参碱/肝大部分切除组NF-κB蛋白各时间点观察较肝大部分切除组均低(表1).
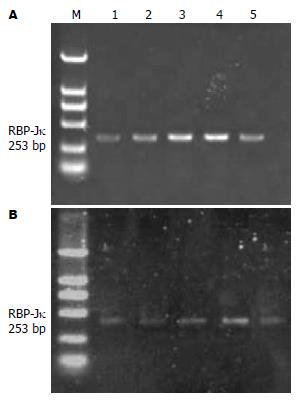
肝大部分切除组再生肝组织各时间点均有RBP-Jκ mRNA表达, 术后14 d为表达高峰, 21 d表达减少, 苦参碱/肝大部分切除组各时间点RBP-Jκ mRNA表达较肝大部分切除组低(图2).
肝再生是指肝脏受到病毒、化学物质、手术等作用, 导致肝脏功能严重受损, 肝脏表现出强大的自我修复能力, 肝细胞大量增殖实现肝组织补偿. 在肝再生的启动、进展、终止3个阶段中有2类细胞参与: 一类是成熟肝细胞通过有丝分裂进行肝细胞再生; 另一类是肝内干细胞可分化为前体肝细胞, 参与细胞更新. 苦参碱是临床治疗各种急慢性肝病的常用药物, 其具有抗炎、抗病毒、抗纤维化等多种临床疗效. 本课题组在前期工作基础上, 建立2/3肝切除模型, 研究苦参碱对肝再生及修复的作用机制.
肝大部分切除模型中术后第1天即可见少量卵圆细胞在小胆管周围增生, 核较大, 胞质少, 体积为成熟肝细胞的1/2; 14 d为增生高峰, 向肝小叶内延伸; 21 d增生减少. 经苦参碱干预后, 各时间点卵圆细胞增殖均较模型组少, 初步提示苦参碱在一定程度上抑制卵圆细胞增生. 通过透射电镜观察卵圆细胞的超微结构提示: 细胞内线粒体、内质网等细胞器较成熟肝细胞少, 并见到胞质内张力微丝及细胞与细胞之间的桥粒连接, 被认为是卵圆细胞的特有结构[1].
NF-κB蛋白是进化上高度保守的一种免疫反应介质, 病毒、氧化剂、炎症细胞因子等均可激活该转录因子, 从而参与细胞的生长、分化、发育、凋亡、黏附及炎症反应[2-4]. 有研究表明, 在应激及炎性状态下, 核转录因子NF-κB激活后调控基因的表达特别是TNF-α和IFN-γ, 是引起肝细胞炎性凋亡的2个重要因素[5-7]. 有人发现NF-κB的持续激活在肝细胞发生癌变中发挥重要作用[8]. 本实验中观察到肝大部分切除模型大鼠再生肝组织中有NF-κB蛋白表达, 术后14 d为表达高峰, 21 d表达下降. 苦参碱 干预后NF-κB表达均减少. 提示苦参碱通过降低NF-κB的活性来减轻炎症反应引起的肝损伤.
RBP-Jκ是Notch信号通路的重要调控分子. Notch/Delta信号通路是一条在胚胎发育中起调控作用的保守通路. 近年来, 该通号途径与肝干细胞增殖分化的关系备受学者关注[2,9,10]. RBP-Jκ是一种DNA结合蛋白, 其一方面与Notch受体细胞内特定结构域结合, 另一方面与核内特定的DNA序列结合, 而该序列位于Notch诱导基因的启动子上, 从而激活转录过程[6]. 本研究结果显示肝大部分切除模型大鼠再生肝组织中有RBP-Jκ mRNA表达, 术后14 d为表达高峰, 21 d表达下降. 苦参碱干预后RBP-Jκ mRNA表达均减少. 提示苦参碱通过下调RBP-Jκ mRNA从而抑制Notch信号通路激活参与肝损伤修复的. 有证据表明NF-κB家族是Notch信号通路的目的基因之一, Notch可通过蛋白-蛋白之间作用和基因转录水平调节靶基因NF-κB的表达[11-14]. 本实验证实了上述理论, 苦参碱可同时下调Notch信号通路关键分子RBP-Jκ及NF-κB, 我们推测苦参碱参与肝再生作用机制可能为抑制Notch-RBP-Jκ信号通路激活减轻NF-κB引起的炎症反应.
总之, 本实验成功复制了肝大部分切除致肝损伤模型, 观察到肝损伤后再生过程中卵圆细胞的增殖及其超微结构, 并证实苦参碱在肝损伤修复中抑制卵圆细胞增殖, 同时抑制Notch-RBP-Jκ信号通路激活减轻NF-κB引起再生肝组织的炎症反应, 即从而揭示了苦参碱参与肝再生的部分作用机制, 这为探讨肝损伤的修复机制及中医药治疗提供了有益的思路.
肝脏受到严重损伤时表现出强大的再生能力, 但机制尚不十分清楚. 近年来对中药及其单体在促进肝再生中的作用研究已受到广泛关注.
潘兴华, 副主任医师, 中国人民解放军成都军区昆明总医院病理实验科; 郑素军, 副主任医师, 首都医科大学附属北京佑安医院人工肝中心; 汤朝晖, 副主任医师, 上海交大医学院附属新华医院普外科
RBP-Jκ是Notch信号通路的重要调控分子, 该通号途径与肝干细胞增殖分化的关系备受学者关注, 但上述两者在肝再生修复中的作用机制尚缺乏报道.
有研究表明, 在应激及炎性状态下, 核转录因子NF-κB激活后调控基因的表达特别是TNF-α和IFN-γ, 是引起肝细胞炎性凋亡的两个重要因素.
本研究观察到苦参碱在肝损伤修复中抑制卵圆细胞增殖, 同时抑制Notch-RBP-Jκ信号通路激活、减轻NF-κB引起再生肝组织的炎症反应, 即从而揭示了苦参碱参与肝再生的部分作用机制, 这为探讨肝损伤的修复机制及中医药治疗提供了有益的思路.
本文创新性较好, 有一定的科学价值, 对于了解苦参碱对肝再生的作用, 有一定意义.
编辑: 李军亮 电编:何基才
| 1. | De Vos R, Desmet V. Ultrastructural characteristics of novel epithelial cell types identified in human pathologic liver specimens with chronic ductular reaction. Am J Pathol. 1992;140:1441-1450. [PubMed] |
| 2. | Hansson EM, Lendahl U, Chapman G. Notch signaling in development and disease. Semin Cancer Biol. 2004;14:320-328. [PubMed] [DOI] |
| 3. | Schmid JA, Birbach A. IkappaB kinase beta (IKKbeta/IKK2/IKBKB)--a key molecule in signaling to the transcription factor NF-kappaB. Cytokine Growth Factor Rev. 2008;19:157-165. [PubMed] [DOI] |
| 4. | Tergaonkar V. NFkappaB pathway: a good signaling paradigm and therapeutic target. Int J Biochem Cell Biol. 2006;38:1647-1653. [PubMed] [DOI] |
| 5. | Spahr L, Giostra E, Frossard JL, Bresson-Hadni S, Rubbia-Brandt L, Hadengue A. Soluble TNF-R1, but not tumor necrosis factor alpha, predicts the 3-month mortality in patients with alcoholic hepatitis. J Hepatol. 2004;41:229-234. [PubMed] [DOI] |
| 6. | Trinh DV, Zhu N, Farhang G, Kim BJ, Huxford T. The nuclear I kappaB protein I kappaB zeta specifically binds NF-kappaB p50 homodimers and forms a ternary complex on kappaB DNA. J Mol Biol. 2008;379:122-135. [PubMed] [DOI] |
| 7. | Williams LM, Lali F, Willetts K, Balague C, Godessart N, Brennan F, Feldmann M, Foxwell BM. Rac mediates TNF-induced cytokine production via modulation of NF-kappaB. Mol Immunol. 2008;45:2446-2454. [PubMed] [DOI] |
| 8. | Qiao L, Zhang H, Yu J, Francisco R, Dent P, Ebert MP, Röcken C, Farrell G. Constitutive activation of NF-kappaB in human hepatocellular carcinoma: evidence of a cytoprotective role. Hum Gene Ther. 2006;17:280-290. [PubMed] [DOI] |
| 9. | Fre S, Pallavi SK, Huyghe M, Laé M, Janssen KP, Robine S, Artavanis-Tsakonas S, Louvard D. Notch and Wnt signals cooperatively control cell proliferation and tumorigenesis in the intestine. Proc Natl Acad Sci U S A. 2009;106:6309-6314. [PubMed] [DOI] |
| 10. | Rodilla V, Villanueva A, Obrador-Hevia A, Robert-Moreno A, Fernández-Majada V, Grilli A, López-Bigas N, Bellora N, Albà MM, Torres F. Jagged1 is the pathological link between Wnt and Notch pathways in colorectal cancer. Proc Natl Acad Sci U S A. 2009;106:6315-6320. [PubMed] [DOI] |
| 11. | Oswald F, Liptay S, Adler G, Schmid RM. NF-kappaB2 is a putative target gene of activated Notch-1 via RBP-Jkappa. Mol Cell Biol. 1998;18:2077-2088. [PubMed] |
| 12. | Shimizu T, Kagawa T, Inoue T, Nonaka A, Takada S, Aburatani H, Taga T. Stabilized beta-catenin functions through TCF/LEF proteins and the Notch/RBP-Jkappa complex to promote proliferation and suppress differentiation of neural precursor cells. Mol Cell Biol. 2008;28:7427-7441. [PubMed] [DOI] |
| 13. | Schouwey K, Larue L, Radtke F, Delmas V, Beermann F. Transgenic expression of Notch in melanocytes demonstrates RBP-Jkappa-dependent signaling. Pigment Cell Melanoma Res. 2010;23:134-136. [PubMed] [DOI] |
| 14. | Souilhol C, Cormier S, Tanigaki K, Babinet C, Cohen-Tannoudji M. RBP-Jkappa-dependent notch signaling is dispensable for mouse early embryonic development. Mol Cell Biol. 2006;26:4769-4774. [PubMed] [DOI] |