修回日期: 2011-06-27
接受日期: 2011-07-05
在线出版日期: 2011-07-18
目的: 探讨脂蛋白受体相关蛋白5、6(LRP-5、LRP-6)在溃疡性结肠炎(UC)相关癌组织中的表达及意义.
方法: 以溃疡性结肠炎伴不典型增生(UD)和溃疡性结肠炎相关癌(UCAC)为病例组, 溃疡性结肠炎(UC组)和散发性大肠癌(SCRC组)为对照组, 应用免疫组织化学S-P法检测各组肠黏膜组织中LRP-5、LRP-6的表达.
结果: 5例UCAC中, LRP-5和LRP-6蛋白阳性表达率均明显高于对照组, 与对照UC、SCRC比较差异有统计学意义(LRP-5: 80.00% vs 23.33%, 40.00%; LRP-6: 80.00% vs 16.67%, 45.00%, 均P<0.01). 在15例UD组中, LRP-5和LRP-6蛋白阳性表达分别为14例(93.33%)及13例(86.67%), 与对照组UC、SCRC比较差异有统计学意义(P<0.05).
结论: LRP-5、LRP-6在UCAC的发病机制中可能起着较重要的作用, 并可能作为一个早期生物学标记物来提示瘤变的可能.
引文著录: 党彤, 田旭阳, 李慧艳, 陈言东, 孔洁, 杨莉. LRP-5、LRP-6在溃疡性结肠炎相关癌组织中表达的临床意义. 世界华人消化杂志 2011; 19(20): 2128-2132
Revised: June 27, 2011
Accepted: July 5, 2011
Published online: July 18, 2011
AIM: To explore the clinical significance of expression of low-density lipoprotein receptor-related protein 5 (LRP-5) and LRP-6 in ulcerative colitis (UC)-associated cancer (UCAC).
METHODS: Immunohistochemistry was used to detect the expression of LRP-5 and LRP-6 in 15 cases of UC-associated atypical hyperplasia (UD), 5 cases of UCAC, 30 cases of UC and 20 cases of sporadic colorectal cancer (SCRC).
RESULTS: The positive rate of LRP-5 expression in UCAC was the same as that of LRP-6 (4/5, 80.00%). The positive rates of LRP-5 and LRP-6 were significantly higher in UCAC than in UC (LRP-5: 80.00% vs 23.33%, 40.00%; LRP-6: 80.00% vs 16.67%, 45.00%, all P < 0.01). The positive rates of LRP-5 and LRP-6 expression in 15 cases of UD were 93.33% (14/15) and 86.67% (13/15), respectively, significantly higher than those in UC and SCRC (all P < 0.05).
CONCLUSION: LRP5 and LRP6 may play a significant role in the development of UCAC and can be used as early markers to hint dysplasia.
- Citation: Dang T, Tian XY, Li HY, Chen YD, Kong J, Yang L. Expression of LRP-5 and LRP-6 in ulcerative colitis-associated cancer. Shijie Huaren Xiaohua Zazhi 2011; 19(20): 2128-2132
- URL: https://www.wjgnet.com/1009-3079/full/v19/i20/2128.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i20.2128
成溃疡性结肠炎(ulcerative colitis, UC)是一种主要累及直肠、结肠黏膜的慢性非特异性炎, 病因尚未完全清楚, 发病率在国内外有增高趋势, 且有发生癌变的可能性[1], UC背景下发生的大肠癌称为溃疡性结炎相关性癌(ulcerative colitis-associated colorectal cancer, UCAC)[2], 有关其发病机制的研究报道较少. 自Crohn等[3]首次报道UC并发结肠癌以来, UC与癌的关系引起人们的高度重视; 目前临床大多依靠肠镜活检偶然发现UC黏膜的异型增生及早期癌变, 常有漏诊病例, 若能客观地发现一种生物学标志物来提示恶变潜能, 有针对性的对高危患者进行肠镜活检变得越来越重要; 故本研究采用免疫组织化学方法, 通过设立对照探讨脂蛋白受体相关蛋白5, 6(lipoprotein receptor-related protein 5, 6, LRP-5, 6)在UD及UCAC中的表达, 一方面从分子水平上研究UCAC可能的发病机制, 另一方面对提示早期瘤变, 及时采取措施预防癌的发生, 对提高患者的生存质量将具有非常重要的意义.
病例组选自1995-2009年包头医学院第二附属医院由临床确诊的8年以上UC患者, 长期随访, 后经病理确诊为癌, 临床行大肠癌根治术标本5例设为UCAC组, 且手术根治标本未见淋巴结及远隔器官的转移; 其中男4例, 女1例, 年龄30-71(平均48.2)岁; 依病理诊断为UC伴有异型增生15例设为UD组, 其中男8例, 女7例, 年龄从27-70(平均48.4)岁. 对照组选取同期年龄、性别与病例组相似的30例UC患者(UC组), 其中男15例, 女15例, 年龄24-58(平均42.8)岁; 散发性结直肠癌20例(SCRC组), 其中男14例, 女6例, 年龄51-82(平均67.5)岁. UD组及UC组分别于肠黏膜病变处钳取粟粒大组织3-5块, 以上各组标本均用中性甲醛溶液固定, 临床排出了细菌性痢疾、阿米巴痢疾、慢性血吸虫病、肠结核等感染性结肠炎、缺血性结肠炎、放射性结肠炎等. 正常对照组无UC家庭史.
1.2.1 UC的诊断标准[4]: 采用中华医学会消化病学分会炎症性肠病协作组, 对我国炎症性肠病诊断治疗规范的共识意见.
1.2.2 免疫组织化学SP法检测LRP-5、LRP-6的表达: LRP-5、LRP-6分别购于香港Abcam公司及美国Santa Cruz公司, 两者的深度稀释比为1:100, 1:50, LRP-5、LRP-6定位于胞膜或胞质. 两种抗体阳性等级采用Sinicrope改良半定量法[5], 显微镜下观察并记录各切片中阳性细胞的百分数, 按5级法计分: 0分: 阳性细胞数<5%; 1分: 阳性细胞数5%-25%; 2分: 阳性细胞数26%-50%; 3分: 阳性细胞数51%-75%; 4分: 阳性细胞数>75%. 同时将染色强度分为4级, 0分: 不显色或显色不清; 1分: 浅黄色; 2分: 棕黄色; 3分: 深棕色. 最后综合计分 = (染色细胞分数+染色强度分数)/2, 阴性: 所得分数<0.5分; 弱阳性(+): 0.5-1.5分; 中度阳性(++): 1.6-2.5分; 强阳性(+++): >2.5分.
统计学处理 采用SPSS13.0版软件包进行统计分析, 半定量资料采用等级资料的秩和检验法分析, P<0.05为差异有统计学意义.
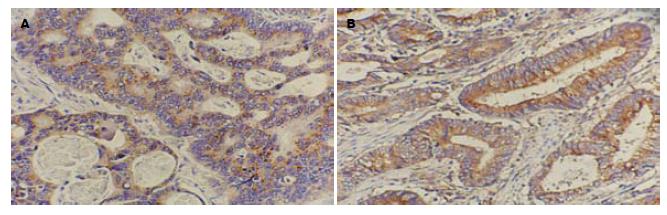
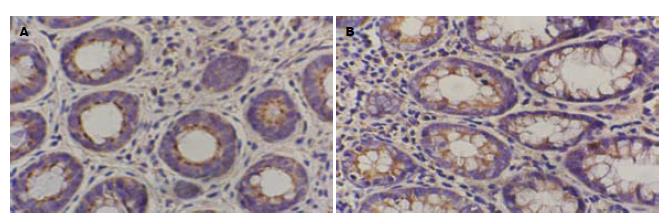
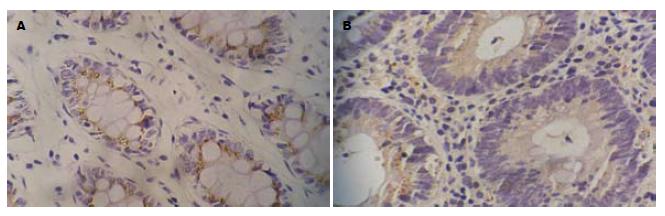
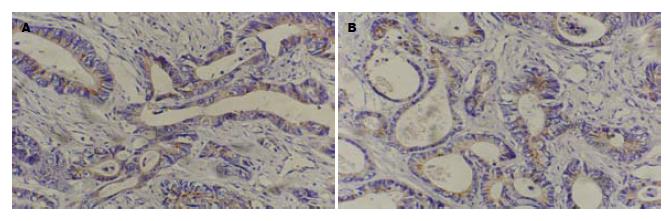
LRP-5、LRP-6阳性表达定位于肠黏膜非典型细胞、癌细胞、腺上皮的胞膜、胞质内, 多呈浅黄色至深棕黄色(图1-4), LRP-5、LRP-6在UD组阳性表达率分别93.33%、86.67%, 高于UC组及SCRC组(P<0.05); 两者在UCAC组阳性表达率均为80.00%, 高于UC组及SCRC组(P<0.01, 表1).
结肠直肠癌(colorectal cancer, CRC)是炎症性肠病(inflammatory bowel disease, IBD)一个严重的并发症, 占IBD患者死亡率的10%-15%[6]. IBD的患者有发展成CRC的风险, 这种风险因素包括疾病持续的时间、病变范围、诊断时的年龄、炎症的严重度、结肠癌的家族史等[7]. 不同的研究表明, UC确诊20年后, 其发生CRC的风险范围从1%-34%各不相同[8-13]. 最近更多的研究显示每年UC发展为CRC的发病率为0.06%-0.20%[14,15]. 尽管如此, 但人们对UCAC发病机制研究较少, 亟待进一步加以阐释.
低密度LRP是Herz于1998年发现的, 经cDNA序列分析, 他含有与低密度脂蛋白(low-density lipoprotein, LDL)受体相关的重复序列, 故称LRP; LRP-5、LRP-6是LRP家族成员之一, LRP-5是一种由1 615个氨基酸编码蛋白, 由胞外区、跨膜区和胞质区组成, LRP-6是一种由1 613个氨基酸编码蛋白, 所编码的蛋白在结构与LRP-5相似.
CRC的发生机制是控制细胞生长和存活的信号转导途径被异常激活, 其中经典的Wnt信号转导途径是其中通路之一, 主要成分包括细胞外因子(Wnt)、跨膜受体(Fz)、辅助受体(LRP-5、LRP-6)、β-链蛋白(β-cat)等一系列蛋白质; 当Wnt信号存在时, Wnt蛋白与Fz的胞外区结合, 在辅助受体LRP-5、LRP-6的共同作用下, 胞质中的散乱蛋白被募集至胞膜下, 后者能将糖原合酶激酶3β磷酸化, 使其从轴蛋白上脱落, β-cat无法降解, 大量游离的β-cat在胞质中聚集并进入胞核内和TCF转录因子结合, 导致Wnt靶基因的转录, 由于他们在细胞增殖及癌变过程中起重要作用, 当过度表达时将会影响到细胞的增值、分化, 促进肿瘤的发生.
目前有关UCAC发病机制研究甚少, 本研究采用免疫组织化学的方法研究LRP-5、LRP-6在各组中的表达情况, 研究结果发现, LRP-5、LRP-6在UD组阳性表达14例(14/15)、13例(13/14), 显著高于UC组及SCRC组, 差异有统计学意义(P<0.05); 提示在UD组已有LRP-5、LRP-6的过表达. LRP-5、LRP-6在UCAC组阳性表达均为4例(4/5), 高于UC组及UCAC组, 差异有统计学意义(P<0.01), 进一步提示LRP-5、LRP-6在UCAC的发病机制中可能起着起较重要的作用, 在单一信号转导相关的基因中, LRP-5和LRP-6作为Wnt途径的辅助受体, 可作为一个识别基因, 转导细胞内的Wnt信号, 促进上皮异型增生及癌的发生,国外有关研究也支持我们的观点[16,17].
一组病例对照研究显示[18], 从确诊UC到发展为CRC, 平均年龄为52.5岁, 本组病例表明UCAC平均年龄为48.2岁, 年龄分布偏小, 分析其原因可能与病变持续的时间、范围、炎症的程度、环境及饮食习惯等因素有关.
UCAC并发CRC的危险性较正常人群高20倍[19], 多项研究分析结果表明[13,20-24]: UC患者10年发生结直肠癌的发生率为2%, 20年为8%, 而30年高达18%. UC易发癌变已经成为一个不争的事实. UCAC的发生遵循炎症-异型增生-癌的序列而不同于散发性CRC的腺瘤-癌的途径, 通过内镜来识别癌前病变会变得非常困难[25-27], 故寻找一种揭示瘤变的生物学标志物显得很重要, Velayos等[28]研究认为, 目前还没有一个很好的因子来预测、提示UCAC发生的可能性. 随着研究的不断深入, 人们逐步认识到, 利用分子生物学技术检测长期的UC患者, 从而筛选出可能癌变的高危人群, 进行有针对性的肠镜检查将具有重要的实用价值[29]. 通过本研究显示LRP-5、LRP-6这两种生物标志物的检测手段比较简便, 可客观反应肠道黏膜从炎症-上皮内瘤变的过程, 有利于临床进行实时监控, 对高表达的高危人群, 有针对性的肠镜活检以尽早发现UD, 提示恶变为UCAC的可能性, 有助于临床指导治疗, 对减少患者痛苦, 提高患者的生活质量有较重要的意义.
本研究UD及UCAC病例数有限, UD与UCAC间是否存在统计学意义, 还需大量前瞻性研究来确定, 但是, 本研究从分子水平上研究了UCAC的发病机制, 对未来的相关研究提供了一个可参考的研究方向.
溃疡性结肠炎(UC)发病率在国内外有增高趋势, 且有发生癌变的可能性, UC背景下发生的结直肠称为溃疡性结炎相关性癌(UCAC), 有关其发病机制的研究报道较少, 临床肠镜检查常造成漏诊, 若能客观地发现一种生物学标志物来提示恶变可能, 对研究其发病机制及有效预防结直肠癌(CRC)的发生将非常重要.
戈之铮, 教授, 上海交通大学医学院附属仁济医院消化科
Toshiaki等采用DNA微阵列检测53例UC患者, 其中8例为UCAC, 2例为UD, 研究结果表明LRP5、LRP6在两组中皆存在高表达.
本研究在国内首次应用免疫组织化学SP法联合检测LRP5、LRP6蛋白在UCAC、UD及正常肠黏膜组织中的表达情况, 从而在分子水平上探讨LRP5 及LRP6蛋白在UCAC发病中的可能机制, 同时为临床寻找一个从炎症-瘤变的生物学标志物, 有针对性的肠镜活检, 以早期发现、预防CRC的发生提供依据.
本研究证实了LRP5、LRP6蛋白在UD及UCAC中存在高表达. 联合检测两种蛋白的表达, 为CRC的防治提供新的思路和理论依据.
本文设计合理, 具有一定的临床借鉴意义.
编辑: 曹丽鸥 电编:何基才
| 3. | Crohn BB, Rosenberg H. The sigmoidoscopic picture of chronic ulcerative colitis. Am J Med Sci. 1925;170:220-228. [DOI] |
| 5. | Sinicrope FA, Hart J, Michelassi F, Lee JJ. Prognostic value of bcl-2 oncoprotein expression in stage II colon carcinoma. Clin Cancer Res. 1995;1:1103-1110. [PubMed] |
| 6. | Munkholm P. Review article: the incidence and prevalence of colorectal cancer in inflammatory bowel disease. Aliment Pharmacol Ther. 2003;18 Suppl 2:1-5. [PubMed] [DOI] |
| 7. | Ahmadi A, Polyak S, Draganov PV. Colorectal cancer surveillance in inflammatory bowel disease: the search continues. World J Gastroenterol. 2009;15:61-66. [PubMed] [DOI] |
| 8. | Winther KV, Jess T, Langholz E, Munkholm P, Binder V. Long-term risk of cancer in ulcerative colitis: a population-based cohort study from Copenhagen County. Clin Gastroenterol Hepatol. 2004;2:1088-1095. [PubMed] [DOI] |
| 9. | Prior P, Gyde SN, Macartney JC, Thompson H, Waterhouse JA, Allan RN. Cancer morbidity in ulcerative colitis. Gut. 1982;23:490-497. [PubMed] [DOI] |
| 10. | Ekbom A, Helmick C, Zack M, Adami HO. Ulcerative colitis and colorectal cancer. A population-based study. N Engl J Med. 1990;323:1228-1233. [PubMed] [DOI] |
| 11. | Langholz E, Munkholm P, Davidsen M, Binder V. Colorectal cancer risk and mortality in patients with ulcerative colitis. Gastroenterology. 1992;103:1444-1451. [PubMed] |
| 12. | Kewenter J, Ahlman H, Hultén L. Cancer risk in extensive ulcerative colitis. Ann Surg. 1978;188:824-828. [PubMed] [DOI] |
| 13. | Eaden JA, Abrams KR, Mayberry JF. The risk of colorectal cancer in ulcerative colitis: a meta-analysis. Gut. 2001;48:526-535. [PubMed] [DOI] |
| 14. | Bernstein CN, Blanchard JF, Kliewer E, Wajda A. Cancer risk in patients with inflammatory bowel disease: a population-based study. Cancer. 2001;91:854-862. [PubMed] [DOI] |
| 15. | Lakatos L, Mester G, Erdelyi Z, David G, Pandur T, Balogh M, Fischer S, Vargha P, Lakatos PL. Risk factors for ulcerative colitis-associated colorectal cancer in a Hungarian cohort of patients with ulcerative colitis: results of a population-based study. Inflamm Bowel Dis. 2006;12:205-211. [PubMed] [DOI] |
| 16. | Watanabe T, Kobunai T, Toda E, Kanazawa T, Kazama Y, Tanaka J, Tanaka T, Yamamoto Y, Hata K, Kojima T. Gene expression signature and the prediction of ulcerative colitis-associated colorectal cancer by DNA microarray. Clin Cancer Res. 2007;13:415-420. [PubMed] [DOI] |
| 17. | Brennan K, Gonzalez-Sancho JM, Castelo-Soccio LA, Howe LR, Brown AM. Truncated mutants of the putative Wnt receptor LRP6/Arrow can stabilize beta-catenin independently of Frizzled proteins. Oncogene. 2004;23:4873-4884. [PubMed] [DOI] |
| 18. | Pinczowski D, Ekbom A, Baron J, Yuen J, Adami HO. Risk factors for colorectal cancer in patients with ulcerative colitis: a case-control study. Gastroenterology. 1994;107:117-120. [PubMed] |
| 19. | Eaden JA, Mayberry JF. Guidelines for screening and surveillance of asymptomatic colorectal cancer in patients with inflammatory bowel disease. Gut. 2002;51 Suppl 5:V10-V12. [PubMed] [DOI] |
| 20. | Rozen P, Baratz M, Fefer F, Gilat T. Low incidence of significant dysplasia in a successful endoscopic surveillance program of patients with ulcerative colitis. Gastroenterology. 1995;108:1361-1370. [PubMed] [DOI] |
| 21. | Lennard-Jones JE, Melville DM, Morson BC, Ritchie JK, Williams CB. Precancer and cancer in extensive ulcerative colitis: findings among 401 patients over 22 years. Gut. 1990;31:800-806. [PubMed] [DOI] |
| 22. | Stonnington CM, Phillips SF, Zinsmeister AR, Melton LJ. Prognosis of chronic ulcerative colitis in a community. Gut. 1987;28:1261-1266. [PubMed] [DOI] |
| 23. | Maratka Z, Nedbal J, Kociánová J, Havelka J, Kudrmann J, Hendl J. Incidence of colorectal cancer in proctocolitis: a retrospective study of 959 cases over 40 years. Gut. 1985;26:43-49. [PubMed] [DOI] |
| 24. | Gyde SN, Prior P, Allan RN, Stevens A, Jewell DP, Truelove SC, Lofberg R, Brostrom O, Hellers G. Colorectal cancer in ulcerative colitis: a cohort study of primary referrals from three centres. Gut. 1988;29:206-217. [PubMed] [DOI] |
| 25. | Lutgens MW, Vleggaar FP, Schipper ME, Stokkers PC, van der Woude CJ, Hommes DW, de Jong DJ, Dijkstra G, van Bodegraven AA, Oldenburg B. High frequency of early colorectal cancer in inflammatory bowel disease. Gut. 2008;57:1246-1251. [PubMed] [DOI] |
| 26. | Itzkowitz SH, Yio X. Inflammation and cancer IV. Colorectal cancer in inflammatory bowel disease: the role of inflammation. Am J Physiol Gastrointest Liver Physiol. 2004;287:G7-G17. [PubMed] [DOI] |
| 27. | Brackmann S, Andersen SN, Aamodt G, Roald B, Langmark F, Clausen OP, Aadland E, Fausa O, Rydning A, Vatn MH. Two distinct groups of colorectal cancer in inflammatory bowel disease. Inflamm Bowel Dis. 2009;15:9-16. [PubMed] [DOI] |
| 28. | Velayos FS, Loftus EV, Jess T, Harmsen WS, Bida J, Zinsmeister AR, Tremaine WJ, Sandborn WJ. Predictive and protective factors associated with colorectal cancer in ulcerative colitis: A case-control study. Gastroenterology. 2006;130:1941-1949. [PubMed] [DOI] |
| 29. | Risques RA, Rabinovitch PS, Brentnall TA. Cancer surveillance in inflammatory bowel disease: new molecular approaches. Curr Opin Gastroenterol. 2006;22:382-390. [PubMed] [DOI] |