修回日期: 2011-06-19
接受日期: 2011-06-21
在线出版日期: 2011-07-18
目的: 研究Conophylline(CnP)联合Betacellulin-δ4(BTCδ4)对胎猪导管源胰腺干细胞的体外诱导分化作用.
方法: 在培养基中加入CnP、BTCδ4等诱导因子诱导胎猪导管源胰腺干细胞分化, 台盼蓝检测CnP对胰岛样细胞团(islet-like cell cluster, ICC)的毒性, ICC行ELISA、免疫组织化学检测, 逆转录-多聚酶链反应(RT-PCR)检测胰岛素基因、PDX-1等在未诱导、诱导细胞中的表达, 葡萄糖刺激实验检测ICC分泌胰岛素的功能.
结果: 用0.1 g/L CnP诱导ICC不显示明显的细胞毒性. 诱导培养4-6 wk, ELISA和免疫组织化学显示CnP联合BTCδ4提高了胰岛素分泌细胞量和胰岛素含量; RT-PCR显示提高了PDX-1, neuroD/Beta2, 胰岛素等在ICC中的表达. 葡萄糖刺激实验结果显示, 诱导后, ICC合成、分泌胰岛素的能力显著增强(P<0.05).
结论: CnP联合BTCδ4促进诱导胎猪导管源胰腺干细胞分化为胰岛素分泌细胞, 分化细胞表达β细胞表面标志并能分泌胰岛素.
引文著录: 黄跃南, 郭欣. Conophylline联合Betacellulin-δ4对胎猪导管源胰腺干细胞体外诱导分化的促进作用. 世界华人消化杂志 2011; 19(20): 2109-2115
Revised: June 19, 2011
Accepted: June 21, 2011
Published online: July 18, 2011
AIM: To investigate the impact of alkaloid conophylline (CnP) in combination with betacellulin-δ4 (BTCδ4) on the differentiation of porcine fetal pancreatic duct stem cells in vitro.
METHODS: For inducing cell differentiation, porcine fetal pancreatic duct stem cells were cultured in Medium 199 (M199) with CnP and BTCδ4, alone or in combination. Then cell viability was assessed by the trypan blue dye exclusion assay. Enzyme-linked immunosorbent assay (ELISA) and immunohistochemistry were used to measure the content of insulin released by islet-like cell clusters (ICCs). The expression of PDX-1, Neuro D/Beta2 and insulin mRNAs was detected by reverse transcription-polymerase chain reaction (RT-PCR). Insulin release in response to glucose was assessed by glucose load test.
RESULTS: Conophylline at concentrations below 0.1 g/L showed no marked toxicity toward the ICCs. Either CnP or BTCδ4 weakly enhanced the content of insulin, while CnP in combination with BTCδ4 synergistically increased cellular insulin content. The expression of PDX-1, insulin and Neuro D/Beta2 mRNAs could be detected in untreated ICCs. After treatment with CnP in combination with BTCδ4, the ICCs exhibited a prompt response to 25.0 mmol/L glucose by increasing insulin secretion.
CONCLUSION: CnP in combination with BTCδ4 potentiated the differentiation of porcine pancreatic duct stem cells in cluster cultures towards β-cells.
- Citation: Huang YN, Guo X. Alkaloid conophylline in combination with betacellulin-δ4 promotes the differentiation of fetal porcine pancreatic duct stem cells. Shijie Huaren Xiaohua Zazhi 2011; 19(20): 2109-2115
- URL: https://www.wjgnet.com/1009-3079/full/v19/i20/2109.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i20.2109
糖尿病是严重危害人类健康的内分泌代谢性疾病, 近年来其患病率在全球呈现快速增长的趋势, 在大多数国家已成为继心血管疾病和肿瘤之后的第三大疾病. 目前几乎所有Ⅰ型糖尿病和部分Ⅱ型糖尿病患者都需要长期注射胰岛素治疗, 常规治疗方案发生全身血管并发症的危险性较高, 而强化治疗方案虽可使糖尿病并发症的危险性降低, 但也存在容易出现低血糖反应甚至昏迷而危及生命等不容忽视的缺陷[1-3]. 2000年, 胰岛移植取得了突破性进展, 来自加拿大Edmonton的研究小组改良了抗免疫排斥的用药方案, 取得连续7例胰岛移植的成功[4]. 然而, Edmonton方案中每次移植的胰岛组织需要来自两个或两个以上的供体胰腺, 且移植后需要长期的抗免疫排斥治疗, 因而限制了胰岛移植的广泛开展. 随着胰腺干细胞的研究深入, 不仅可以为胰岛移植提供新的材料来源, 同时也能为治疗糖尿病提供新的思路和途径[5-7]. 从理论上讲, 这种方法可以克服目前胰岛移植面临的两大难题, 即供体来源不足和免疫排斥反应. 近年研究发现, 胚胎干细胞和成体多能干细胞均可在体外诱导分化为胰岛素分泌细胞[8]. 胰腺导管干细胞是一类存在于胰腺组织, 能自我更新, 具有多分化潜能的发育早期细胞, 在特定的条件下, 可分化为胰岛细胞[9]. 已利用小鼠导管细胞诱导获得胰岛样结构[10]. 因为在体外成人胰岛细胞成长有限, 胰岛分离提纯后, 从富含导管的细胞培养为胰岛的能力提供了一个很重要的方法来用于β-cell的替代治疗[11]. 猪胰岛异种移植被作为一种治疗糖尿病的备选方案来研究, 他们的胰腺大小和抗原性与人胰腺相似. Conophylline(CnP)是从热带植物小叶狗牙花中提取出来的新的长春碱类衍生物, 在鼠胰腺腺泡癌细胞中, 这种生物碱诱导一种形态学改变, 并且诱导分化为β细胞[12]. CnP促进胎鼠胰腺器官形成和胰腺祖细胞的转化, 并促进在体内体外β细胞的形成[13]. 而且, 生物碱诱导在培养基里培养的胎儿小鼠胰腺组织分化为β细胞, 并且降低链唑霉素治疗的胎儿小鼠的血糖水平[13,14]. 最近发现CnP和BTCδ4联用可以较强的诱导胰岛素分泌细胞的分化[15]. BTCδ4是一种Betacellulin基因的嫁接同种型, 缺少EGF基序的C-loop和跨膜区, 而含有外显子4"跳过"(exon 4"skipping")[16]. 很有意义的是, BTCδ4提高胰岛素含量, β细胞, ICC数量, 和PDX-1阳性导管细胞[16]. CnP作用于干细胞并且通过降低Neurogenin 3(Ngn3)[17,18]的表达来将母细胞转化为内分泌细胞. 而BTCδ4作用于那些已经分化为内分泌腺的细胞并且将其转化为胰岛素分泌细胞. 他们作用于β细胞分化过程中的不同步骤, 所以联合使用产生的效果是可以叠加. 本研究中, 我们联合添加CnP和BTCδ4诱导胎猪导管源胰腺干细胞, 探索合适的诱导条件, 促使其向胰岛素分泌细胞分化, 并对诱导产物进行形态鉴定和功能检测.
胎猪胰腺, 从哈尔滨哈达屠宰场收集怀孕60-90日龄的长白母猪子宫, 打开怀孕母猪腹腔后结扎子宫两端, 摘取子宫, 尽快送回实验室无菌采集雄性胎猪胰腺组织置于TRIzol试剂中, -70 ℃保存备用. Medium 199(Gibco)、胰蛋白酶(sigma美国)、谷氨酰胺glutamine(Merck), 丙酮酸钠、β-巯基乙醇(β-Me)(Sigma), bFGF、EGF(R&D公司), FBS(Hyclone), 牛血清白蛋白(BSA, Sigma, 美国), 尼克酰胺(nicotamide, NIC, Sigma, 美国), TRIzol试剂(美国Life Technologies公司), M-MLV逆转录试剂盒(Life Technologies, 美国). ELISA试剂盒(Mercodia, 瑞典), 抗猪胰岛素抗体(Mercodia, 瑞典). 鼠抗猪胰岛素抗体(Dako Cytomation, 丹麦). Cnp参照文献[12]准备. Betacellulin(BTC, Sigma, 美国), 重组人BTCδ4参照文献[13]准备.
1.2.1 细胞分离方法的建立: (1)培养基配制A液: M199加入100 mL/L FBS, 丙酮酸钠(1 mmol/L), β-巯基乙醇(71.5 µmol/L), EGF(20 μg/L), bFGF (20 μg/L), 10 mmol/L NIC, 青霉素100 U/mL, 链霉素100 g/L, HEPES(2 380 mg/L), 碳酸氢盐(2 000 mg/L), L-谷氨酰胺(600 mg/L). B液: M199加入200 mL/L FBS, 其余同A液; (2)细胞的分离培养无菌采取胎猪胰腺, 置于0 ℃的含双抗、无钙、镁磷酸盐缓冲液[PBS(-)]中, 剪去周围的脂肪、血管、被膜以及结缔组织, 冲洗3-4遍, 剪为1 mm×1 mm×1 mm左右的碎块, 用PBS(-)冲洗至溶液清澈后, 放入M199培养基, 然后用冷HBSS冲洗3次, 加入0.1%胶原酶Ⅳ37 ℃消化, 期间不时剧烈震荡, 用HBSS 4 ℃条件下冲洗3次, 观察消化情况, 以形成多量直径50-100 μm细胞团和单个细胞为宜, 加A液终止消化, 胶原酶Ⅳ消化约25-30 min. 再次更换培养A液培养24 h后, 对细胞进行连续的密度梯度离心[19], 取上层(密度量程: 1.062-1.096)和中层(密度量程: 1.096-1.11)细胞备用. 然后, 在37 ℃低于50 mL/L CO2的增湿条件下, 将细胞培养于B液中.
1.2.2 ICC的制备和检测: 配制诱导培养基(C液): M199加入100 mL/L FBS, 丙酮酸钠(1 mmol/L), β-巯基乙醇(71.5 µmol/L), EGF(20 μg/L), bFGF(20 μg/L), 10 mmol/L NIC, Activin-A(10 nmol/L), BSA(1 g/L), 青霉素100 U/mL, 链霉素100 g/L, HEPES (2 380 mg/L), 碳酸氢盐(2 000 mg/L), L-谷氨酰胺(600 mg/L). 收集过夜培养的贴壁细胞, 如上述, 以3×108个/L的密度接种于C液. 取200 µL悬浮液接种到96孔圆底板在37 ℃培养. 每3-4 d更换1次培养基. 4-7 d后, 细胞簇形成. 应用trypan blue(台盼蓝)染色检测细胞活力. 5份ICC接种到12孔圆底板. 然后, 分别在24 h和48 h添加各种生物碱浓聚物(CnP、BTCδ4), 随后台盼蓝染色. 每200个细胞计数染色细胞.
1.2.3 ELISA测量胰岛素: 胰岛素分泌实验分析, 接种5份ICC在含1.5 mL培养基的6孔平板里. 培养基分别添加1 nmol/L BTCδ4(B), 0.1 g/L CnP(C), 1 nmol/L BTCδ4(B)联合0.1 g/L CnP (BC). 每3 d更换1次培养基, 我们同时取上层清液和黏附细胞检测胰岛素分泌情况. 参照说明书, 我们应用ELISA试剂盒检测ICC和胰岛素分泌量. 上层清液保存在-20 ℃. 测量胰岛素, 用冰预冷的PBS冲洗, 然后用1 mL缓冲液冲洗. 用酸性的 EtOH(75% EtOH conc. HCl = 1 000:15)提取ICC的胰岛素再进行测量.
1.2.4 胰岛素免疫组织检测: 将ICC接种到含1.5 mL培养基的两腔载玻片上. 培养基分别添加1 nmol/L BTCδ4(B), 0.1 g/L CnP(C组), 1 nmol/L BTCδ4(B组)联合0.1 g/L CnP(BC组). 每3 d更换1次培养基, 每周收获1次细胞. 用40 g/L甲醛固定细胞3 h, 然后用含0.3% Triton X-100的PBS孵育10 min. 下一步, 添加50 mL的3% H2O2阻断5 min. 然后, 载玻片用蒸馏水冲洗, 再用0.03% Triton X-100/PBS室温冲洗5 min. 在含有20%山羊血清/PBS的封闭液培养10 min, 然后, 将鼠抗猪胰岛素抗体置于0.1% BSA的PBS溶液里稀释添加到保温皿, 并将细胞培养在保温皿里150 min. 下一步, 细胞用0.03% Triton X-100/PBS冲洗5 min, 然后室温下与抗鼠抗体共培育1 h. 将DAB-H2O2缓冲液加入细胞中, 然后室温培养5 min. 下一步, 样品浸泡在0.03% Triton X-100的PBS里以终止反应. PBS冲洗后镜检, 照相, 计算胰岛素阳性细胞在ICC细胞总数里的百分率.
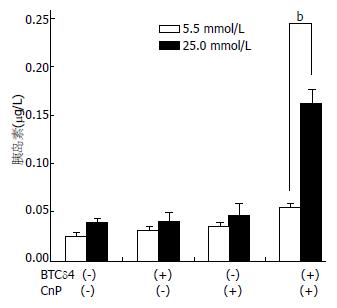
1.2.5 葡萄糖刺激实验: 取诱5 wk后的细胞进行葡萄糖刺激试验. ICC用如上描述的添加化合物的培养方法培养5 wk后, 接种到6孔板. PBS冲洗 2-3遍后, 在100 mL/L FBS/M199(5.5 mmol/L葡萄糖)培养3 h. 在含0.1% BSA的M199培养基再培养1 h. 最后, 分别培养在含0.1% BSA的M199的低糖刺激相(5.5 mmol/L葡萄糖)和高糖刺激相(25.0 mmol/L葡萄糖)的培养基里. 收获上层清液后, 用ELISA测量胰岛素释放量, 取未诱导细胞和诱导液做对照. 然后再培养1.5 h. 实验重复3次.
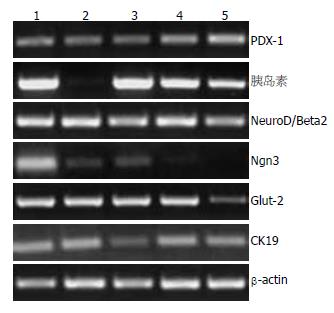
1.2.6 RT-PCR基因表达分析: 应用TRIzol试剂一步法提取胎猪胰腺组织对照、未诱导组、B组、C组、BC组细胞共5组的总RNA, 总RNA经DNaseⅠ37 ℃消化1 h, 以去除可能污染的痕量基因组DNA, 取2 µg RNA用M-MLV逆转录试剂盒将RNA转录成cDNA. 取2 µL逆转录产物进行RT-PCR检测. 检测各基因的引物序列为: β-actin基因为内参基因, 上游引物为5'-CCAAAGCCAACCGTGAGA-3', 下游引物为5'-CTCGTTGCCGATGGTGAT-3', 扩增片度长度: 425 bp; PDX-1上游引物为5'-AAGGCTCACGCGTGGAAAAGG-3', 下游引物为5'-GTCCTCCTCCTTTTTCCAC-3', 长度: 229 bp; 胰岛素上游引物为5'-AGGCCTTCGTGAACCAGCAC-3', 下游引物为5'-GAGGGAACAGATGCTGGTGC-3',长度: 233 bp; 葡萄糖转运体2(glucose transporter type 2, Glut-2)上游引物为5'-TGTGCCATCTTCATGTCGG-3', 下游引物为5'-AATTGCGGGTCCAGTTGCT-3', 长度: 208 bp; Ngn3上游引物为5'-CGTACCGGGGAACAGCGCG-3', 下游引物为5'-GCGTCTCTATCTTGGTGAGT-3', 长度: 251 bp; CK19上游引物: 5'-TGCTACCAGTTGACAAGAGC-3', 下游引物: 5'-GGCACCAAGAATCTTGTACC-3', 长度: 299 bp; NeuroD/Beta2上游引物为5'-CTGTGCACCCCTACTTTAC-3', 下游引物为5'-TCTCAAACTCGGCGGACGG-3', 长度: 251 bp. PCR反应条件如下: β-actin, 94 ℃ 30 s, 54 ℃ 30 s, 72 ℃ 30 s, 循环35次; 胰岛素, PDX-1, Ngn3, CK19和NeuroD/Beta2, 94 ℃ 30 s, 62 ℃ 30 s, 72 ℃ 30 s, 循环35次; Glut-2, 94 ℃ 30 s, 52 ℃ 30 s, 72 ℃ 30 s, 循环35次; 所有反应均为94 ℃预变性4 min, 72 ℃延伸10 min. 取PCR扩增产物1.5%琼脂糖凝胶电泳分析, 照相并记录.
统计学处理 实验数据采用mean±SD形式表示, 使用SPSS13.0统计软件进行数据分析,统计学处理采用标准差分析, 以P<0.05为具有统计学意义上的显著性差异.
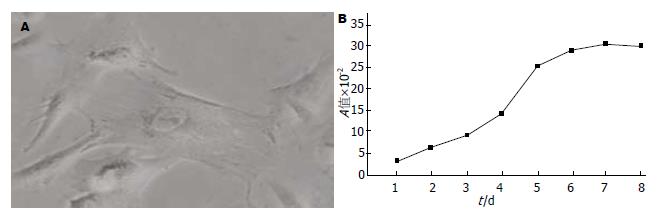
获取5只胎猪的导管源胰腺干细胞, 用于本实验. 胎猪胰腺干细胞形态为多角形或梭形(图1A), 每 6-7 d传代1次; 生长曲线显示: 该细胞在接种后1-3 d生长缓慢, 3-6 d进入对数增长期, 随后进入平台期(图1B).
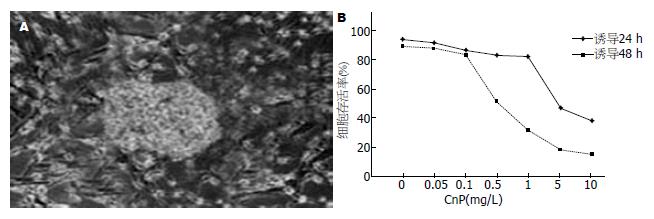
2.2.1 ICC的检测: 胎猪胰腺干细胞传代培养后, 大量细胞在头4 d增殖, 形成悬浮细胞簇, 并且增殖形成正常组织、胰岛样结构. 待细胞生长至50%-60%融合时进行诱导分化, 诱导1 wk后, 开始出现具有立体三维结构的ICC, 然后将每个细胞簇接种到圆底平板再培养1 wk; 诱导至2 wk左右, ICC增多, 并且更加致密(图2A). 用不同浓度的CnP诱导ICC, 分别诱导24 h(菱形)和48 h(正方形). 然后, 应用台盼蓝染色检测细胞毒性. 重复3次计算平均值. 用0.1 g/L浓度以下的CnP诱导ICC 48 h后并未显示明显的细胞毒性(图2B). 因此, 以后的实验使用CnP的浓度为0.1 g/L.
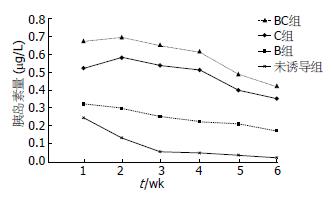
2.2.2 ELISA结果: 在6 wk内, BTCδ4单独使用提高胰岛素分泌细胞的活性不明显; CnP单独使用提高胰岛素分泌细胞的活性较BTCδ4明显; 当联合使用时, 显著提高了ICC向胰岛素分泌细胞分化的能力(图3).
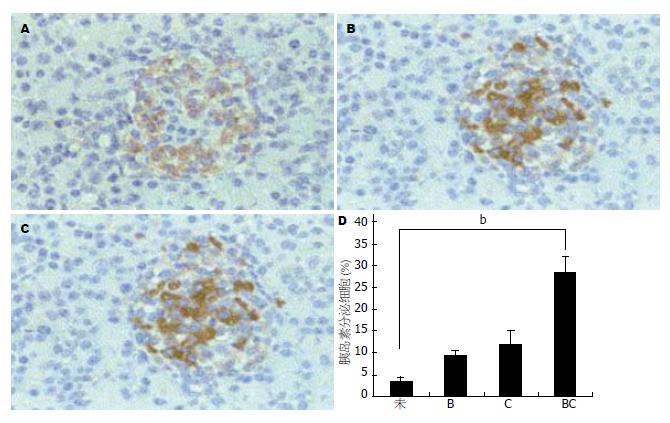
2.2.3 免疫组织化学结果: CnP和BTCδ4 1 wk 1次单独或联合诱导ICC, 直到第3周, 免疫组织化学检测ICC的胰岛素表达. 细胞经CnP、BTCδ4联合诱导培养3 wk后, CnP单独诱导比BTCδ4单独诱导较强的促进了干细胞分化为胰岛素分泌细胞, 而联合作用比单独诱导作用更强. CnP、BTCδ4联合治疗3 wk的细胞里胰岛素阳性细胞平均数与正常对照组有显著差异(P<0.01). 而CnP、BTCδ4单独诱导3 wk后, 胰岛素阳性细胞与正常组无显著差异(P>0.05). 继续诱导3 wk后发现, 胰岛素分泌细胞的活性逐渐下降(图4).
2.2.4 RT-PCR检测结果: 在CnP、BTCδ4联合诱导1 wk以后的细胞检测到胰岛素转录物弱阳性. 我们进一步也检测了诱导2 wk后, 各基因的表达水平, 包括胰岛素、PDX-1、CK19、Ngn3、NeuroD/Beta2、Glut-2等. CnP、BTCδ4联合诱导的基因表达最强, 其次是CnP诱导治疗的, BTCδ4单独治疗的最弱(图5).
2.2.5 糖刺激胰岛素释放反应: ICC在含有CnP、BTCδ4单独或联合诱导的无糖培养基里预培养5 wk, 然后暴露在葡萄糖(5.5 mmol/L或25.0 mmol/L)里. ELISA检测胰岛素分泌量. 对照组培养基CnP、BTCδ4单独诱导的培养基里的细胞几乎对葡萄糖不反应, 几乎无胰岛素释放. 然而, 在CnP、BTCδ4联合治疗后, ICC对25.0 mmol/L葡萄糖迅速反应(图6).
糖尿病是一种常见的内分泌疾病, 是因为胰岛素绝对或相对不足或靶细胞对胰岛素敏感性降低引起以糖代谢紊乱为主, 继发脂肪、水、电解质代谢障碍[8]. 糖尿病分为胰岛素依赖型糖尿病(IDDM又称Ⅰ型)和非胰岛素依赖型糖尿病(NIDDM又称Ⅱ型). Ⅱ型糖尿病的主要特征是: 周围组织的胰岛素抵抗和胰岛分泌胰岛素能力降低[20]. β细胞多半在胎儿时期分化而来, 而成体胰腺分化复制很慢. 因此, β细胞的分化能力恢复可能作为治疗Ⅱ型糖尿病有用的方法[21,22]. 另一方面, 胰岛素分泌细胞的移植可能是Ⅰ型糖尿病再生治疗的方法. 虽然β细胞的移植是治疗糖尿病的重要希望, 但是人胰腺供体的缺乏和移植后的排斥反应限制了同种移植的临床应用. 最近, 大量研究证实了多潜能细胞可以调控分化为再生治疗细胞. 因为猪的胰腺大小和抗原性与人胰腺相似, 所以猪胰岛异种移植被作为一种治疗糖尿病的备选方案来研究. 对于糖尿病治疗, 猪胰岛细胞已经被考虑作为最有可能的用于移植的胰岛素分泌细胞的潜在资源.
CnP具有诱导胰腺前体细胞模型-AR42J细胞体外分化成胰岛素分泌细胞的能力, 并且和activin A相比, CnP不会诱导细胞凋亡, 被认为是一种神奇的植物诱导剂[14]. 由CnP、BTCδ4单独诱导或联合诱导产生的主要效果是由位于胰腺导管的干细胞产生的新生的β细胞的刺激作用而不是已有β细胞的应答[17,18,23]. CnP和BTCδ4单独诱导干细胞均能起一定诱导分化作用, 而这两种不同的因素的作用是可以相互叠加的. CnP 和BTCδ4的作用点是不同的[17,18]. CnP作用于干细胞并且通过降低Ngn3的表达来将干细胞转化为内分泌细胞. 而BTCδ4作用于那些已经分化为内分泌腺的细胞并且将其转化为胰岛素分泌细胞. 他们分别作用于β细胞分化过程中的不同步骤, 功效是可以叠加的, 故本实验设计CnP联合BTCδ4诱导胎猪导管源胰腺干细胞. NIC能协同CnP较大程度提高胰岛素分泌细胞生成[24], HGF能增加胰岛素量, 促进胰岛增殖, 诱导细胞转分化产生胰岛素, 故本实验联合添加NIC、HGF.
本实验采用以M199为基础培养液, 联合添加CnP、BTCδ4、HGF、NIC等诱导因子, 诱导胎猪导管源胰腺干细胞定向分化为胰岛素分泌细胞; ELISA、免疫组织化学检测不同诱导组ICC内胰岛素含量, 并以不同浓度葡萄糖刺激胰岛素分泌细胞分泌胰岛素. 结果证明在诱导14-18 d后细胞可达到最大程度的成熟, 诱导时间短于6 d达不到诱导效果, 但诱导时间过长细胞会大量漂浮死亡. Glut-2是存在于β细胞膜内的一种特殊的跨膜转运蛋白, 可以将葡萄糖转运入细胞内, 故又称为"葡萄糖感受器". 细胞表达Glut-2, 显示细胞具有葡萄糖感受能力及潜在的分泌胰岛素的功能[25]. 本实验Glut-2表达阳性, 说明所获得的细胞具有潜在的分泌胰岛素的功能. 应用RT-PCR检测分离获得的细胞, 胰岛素表达阴性, 证明我们所分离获得的细胞不含胰岛细胞. 检测诱导形成的胰岛素分泌细胞具有对不同浓度葡萄糖不同的反应性, 25.0 mmol/L葡萄糖刺激胰岛素释放敏感. 用CnP和BTCδ4进行诱导实际上增加了ICC的数目和大小, 但其大小仍小于正常值, 提示ICC的形成是非常有效的, 但他们并不能相应地成长为正常大小的β细胞岛. 可能有一些不清楚的因素参与ICC的形成, 仍需要进一步研究提高正常β细胞岛的成功率.
总之, CnP联合BTCδ4诱导胎猪导管源胰腺干细胞, 体外可分化为胰岛素分泌细胞, 提高其体外诱导分化效率, 对葡萄糖刺激敏感. 如能解决异种细胞移植时的免疫排斥问题, 便可作为一种理想的供体细胞来源, 解决胰岛细胞移植时供体细胞不足的问题, 从而使胰岛细胞移植治疗胰岛素依赖的糖尿病患者成为可能.
随着胰腺干细胞的研究深入, 不仅可以为胰岛移植提供新的材料来源, 同时也能为治疗糖尿病提供新的思路和途径. 胰腺导管中存在一类干细胞, 具有多向分化潜能, 通过特定的诱导, 例如添加适当的诱导剂, 可使其想胰岛素分泌细胞分化.
石毓君, 副研究员, 四川大学华西医院外科
研究证实, CnP作用于干细胞并且通过降低Ngn3的表达来将母细胞转化为内分泌细胞. 而BTCδ4作用于那些已经分化为内分泌腺的细胞并且将其转化为胰岛素分泌细胞. 他们作用于β细胞分化过程中的不同步骤, 联合使用产生的效果是可以叠加.
本研究通过添加CnP联合BTCδ4对胎猪导管源胰腺干细胞体外诱导分化, 发现了联合作用促进了导管干细胞分化为胰岛素分泌细胞, 为阐明胰腺导管干细胞定向分化为β细胞的机制奠定了基础.
本研究发现了CnP联合BTCδ4促进胎猪导管源胰腺干细胞体外诱导分化为胰岛素分泌细胞, 选择性地扩增胰腺干细胞为治疗糖尿病患者胰岛素不足, 提供充足的有功能的β细胞有着非常广阔的前景.
本文创新性较好, 有一定的理论和实际价值.
编辑: 曹丽鸥 电编:张洋
| 1. | Yamada S, Kojima I. Regenerative medicine of the pancreatic beta cells. J Hepatobiliary Pancreat Surg. 2005;12:218-226. [PubMed] [DOI] |
| 2. | Päth G, Seufert J. [Current status and perspectives of stem cell therapy for the treatment of diabetes mellitus]. Med Klin (Munich). 2003;98:277-282. [PubMed] |
| 3. | Minami K, Okuno M, Miyawaki K, Seino S. [Regenerative medicine of the pancreas]. Nippon Rinsho. 2003;61:504-508. [PubMed] |
| 4. | Shapiro AM, Lakey JR, Ryan EA, Korbutt GS, Toth E, Warnock GL, Kneteman NM, Rajotte RV. Islet transplantation in seven patients with type 1 diabetes mellitus using a glucocorticoid-free immunosuppressive regimen. N Engl J Med. 2000;343:230-238. [PubMed] [DOI] |
| 5. | Kume S. Stem-cell-based approaches for regenerative medicine. Dev Growth Differ. 2005;47:393-402. [PubMed] [DOI] |
| 6. | Soria B, Roche E, Reig JA, Martin F. Generation of insulin-producing cells from stem cells. Novartis Found Symp. 2005;265:158-167; discussion 167-173, 204-211. [PubMed] |
| 7. | Soria B, Bedoya FJ, Martin F. Gastrointestinal stem cells. I. Pancreatic stem cells. Am J Physiol Gastrointest Liver Physiol. 2005;289:G177-G180. [PubMed] [DOI] |
| 8. | Brubaker PL, Drucker DJ. Minireview: Glucagon-like peptides regulate cell proliferation and apoptosis in the pancreas, gut, and central nervous system. Endocrinology. 2004;145:2653-2659. [PubMed] [DOI] |
| 10. | Edlund H. Pancreas: how to get there from the gut? Curr Opin Cell Biol. 1999;11:663-668. [PubMed] [DOI] |
| 11. | Noguchi H, Naziruddin B, Jackson A, Shimoda M, Ikemoto T, Fujita Y, Chujo D, Takita M, Kobayashi N, Onaca N. Characterization of human pancreatic progenitor cells. Cell Transplant. 2010;19:879-886. [PubMed] [DOI] |
| 12. | Umezawa K, Hiroki A, Kawakami M, Naka H, Takei I, Ogata T, Kojima I, Koyano T, Kowithayakorn T, Pang HS. Induction of insulin production in rat pancreatic acinar carcinoma cells by conophylline. Biomed Pharmacother. 2003;57:341-350. [PubMed] [DOI] |
| 13. | Ogata T, Li L, Yamada S, Yamamoto Y, Tanaka Y, Takei I, Umezawa K, Kojima I. Promotion of beta-cell differentiation by conophylline in fetal and neonatal rat pancreas. Diabetes. 2004;53:2596-2602. [PubMed] [DOI] |
| 14. | Kojima I, Umezawa K. Conophylline: a novel differentiation inducer for pancreatic beta cells. Int J Biochem Cell Biol. 2006;38:923-930. [PubMed] [DOI] |
| 15. | Hisanaga E, Park KY, Yamada S, Hashimoto H, Takeuchi T, Mori M, Seno M, Umezawa K, Takei I, Kojima I. A simple method to induce differentiation of murine bone marrow mesenchymal cells to insulin-producing cells using conophylline and betacellulin-delta4. Endocr J. 2008;55:535-543. [PubMed] [DOI] |
| 16. | Ogata T, Dunbar AJ, Yamamoto Y, Tanaka Y, Seno M, Kojima I. Betacellulin-delta4, a novel differentiation factor for pancreatic beta-cells, ameliorates glucose intolerance in streptozotocin-treated rats. Endocrinology. 2005;146:4673-4681. [PubMed] [DOI] |
| 17. | Kitamura R, Ogata T, Tanaka Y, Motoyoshi K, Seno M, Takei I, Umezawa K, Kojima I. Conophylline and betacellulin-delta4: an effective combination of differentiation factors for pancreatic beta cells. Endocr J. 2007;54:255-264. [PubMed] [DOI] |
| 18. | Watada H. Neurogenin 3 is a key transcription factor for differentiation of the endocrine pancreas. Endocr J. 2004;51:255-264. [PubMed] [DOI] |
| 19. | Bonner-Weir S, Taneja M, Weir GC, Tatarkiewicz K, Song KH, Sharma A, O'Neil JJ. In vitro cultivation of human is lets from expanded ductal tissue. Proc Natl Acad Sci U S A. 2000;97:7999-8004. [PubMed] [DOI] |
| 20. | Alberti KG, Zimmet PZ. Definition, diagnosis and classification of diabetes mellitus and its complications. Part 1: diagnosis and classification of diabetes mellitus provisional report of a WHO consultation. Diabet Med. 1998;15:539-553. [PubMed] [DOI] |
| 21. | Butler AE, Janson J, Bonner-Weir S, Ritzel R, Rizza RA, Butler PC. Beta-cell deficit and increased beta-cell apoptosis in humans with type 2 diabetes. Diabetes. 2003;52:102-110. [PubMed] [DOI] |
| 22. | Ritzel RA, Butler AE, Rizza RA, Veldhuis JD, Butler PC. Relationship between beta-cell mass and fasting blood glucose concentration in humans. Diabetes Care. 2006;29:717-718. [PubMed] [DOI] |
| 23. | Kodera T, Yamada S, Yamamoto Y, Hara A, Tanaka Y, Seno M, Umezawa K, Takei I, Kojima I. Administration of conophylline and betacellulin-delta4 increases the beta-cell mass in neonatal streptozotocin-treated rats. Endocr J. 2009;56:799-806. [PubMed] [DOI] |
| 24. | Kawakami M, Hirayama A, Tsuchiya K, Ohgawara H, Nakamura M, Umezawa K. Promotion of beta-cell differentiation by the alkaloid conophylline in porcine pancreatic endocrine cells. Biomed Pharmacother. 2010;64:226-231. [PubMed] [DOI] |
| 25. | 徐 彩棉, 赵 瑞景, 朱 铁年. PDX-1及其对胰岛β细胞的调控作用. 国际病理科学与临床杂志. 2006;26:55-58. |