修回日期: 2010-11-19
接受日期: 2010-12-01
在线出版日期: 2011-01-18
目的: 探讨DNA聚合酶δ催化亚基基因(DNA polymerase delta catalytic subunit gene 1, POLD1)及其编码蛋白p125在原发性肝癌中的表达及意义.
方法: 选用原发性肝癌患者手术切除标本20例, 分别采用逆转录聚合酶链反应(RT-PCR)法和Western blot法检测POLD1基因表达, 同时分析POLD1基因产物p125蛋白与临床特征的相关性.
结果: 与癌旁组织相比, 肝癌组织中POLD1基因表达明显升高(0.70±0.34 vs 0.37±0.23, P<0.05); 其编码蛋白p125表达与POLD1基因表达一致, 在肝癌组织中的表达显著高于癌旁组织(0.63±0.19 vs 0.39±0.21, P<0.05). p125蛋白的阳性表达率与肿瘤大小和临床分期有关(P<0.05), 而与HBV是否感染、性别及年龄无明显关系(P>0.05).
结论: 原发性肝癌与POLD1基因表达有关, 检测其蛋白产物p125有利于判断肝癌的恶性程度.
引文著录: 欧贤红, 廖柳凤, 刘华钢, 徐恒. POLD1基因在原发性肝癌中的表达及其意义. 世界华人消化杂志 2011; 19(2): 151-155
Revised: November 19, 2010
Accepted: December 1, 2010
Published online: January 18, 2011
AIM: To investigate the significance of expression of DNA polymerase delta catalytic subunit gene (POLD1) and its protein product p125 in hepatocellular carcinoma (HCC).
METHODS: The expression of POLD1 mRNA and protein in 20 surgically resected HCC tissue samples was detected by reverse transcription-polymerase chain reaction (RT-PCR) and Western blot, respectively.
RESULTS: The expression level of POLD1 mRNA was significantly higher in HCC than in matched tumor-adjacent noncancerous tissue (0.70 ± 0.34 vs 0.37 ± 0.23, P < 0.05). The expression level of p125 in HCC was also significantly higher than that in tumor-adjacent tissue (0.63 ± 0.19 vs 0.39 ± 0.21, P < 0.05). p125 expression was correlated with tumor size and clinical stage, but not with HBV infection, age and sex in HCC.
CONCLUSION: POLD1 mRNA and protein expression is significantly correlated with pathological stage of HCC. POLD1 may be used as a diagnostic maker and a potential therapeutic target for HCC.
- Citation: Ou XH, Liao LF, Liu HG, Xu H. Significance of POLD1 expression in primary hepatocellular carcinoma. Shijie Huaren Xiaohua Zazhi 2011; 19(2): 151-155
- URL: https://www.wjgnet.com/1009-3079/full/v19/i2/151.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i2.151
肝细胞癌(hepatocellular carcinoma, HCC)是世界上最常见的恶性肿瘤之一, 在东亚HCC发病率特别高[1]. 在我国南方地区, HCC属于死亡率最高的恶性肿瘤[2]. 由于诊断患HCC时一般已到癌症晚期, 因此HCC的治疗不理想. 随着人们对HCC发病机制认识地不断提高, 使HCC的治疗取得了很大进展[3]. HCC发病的分子机制是多方面的. 目前, 普遍认可的观点是: (1)肝炎病毒感染、毒物(如乙醇)或代谢等因素诱发肝组织损伤, 从而引发肝硬化, 影响肝再生功能; (2)抑癌基因的突变[4]. 这两种机制均与细胞信号通路有关, 包括: RAF/MEK/ERK通路, 磷脂酰肌醇3-激酶(phosphatidylinositol-3 kinase, PI3K)/AKT/哺乳类动物的雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)通路, WNT/β-连环素(β-catenin)通路, 胰岛素样生长因子(insulin-like growth factor, IGF)通路, 肝细胞生长因子(hepatocyte growth factor)/c-MET通路和生长因子-血管生成信号通路等. 要想解决HCC进展快、预后差等问题, 使HCC患者获得较好的治疗, 肝癌发病机制的研究是首要解决的问题之一.
DNA复制是生命现象最本质的内容, 是细胞正常分裂、增殖的关键一步. 因此有学者提出, 癌的恶性增殖与DNA的大量复制相关[5]. DNA聚合酶δ是真核生物DNA复制的最主要复制酶[6], DNA聚合酶δ催化亚基基因1(polymerase delta catalytic subunit gene 1, POLD1)基因编码DNA聚合酶δ催化亚基p125[7-9]. 但POLD1及其编码蛋白p125与肝癌的关系尚未明确. 本文旨在探讨HCC组织中POLD1基因表达水平及其表达蛋白p125与HCC发生、发展的关系.
广西医科大学第一附属医院2008-01/2009-11手术切除的原发性肝癌标本20例, 取与癌相距≥2 cm的癌周肝组织为癌旁组织标本. 男12例, 女8例, 年龄41-66(平均48.2±12.5)岁. 癌灶直径为1.1-12.0(中位数4.5) cm. 肿瘤临床分期Ⅲ期6例, Ⅱ期14例. 标本均经病理学检查证实为HCC. 标本于-70 ℃冰箱中保存备用. 引物由上海生工生物工程技术服务有限公司合成, TRIzol(Invitrogen公司), 逆转录试剂盒(Promega公司), 蛋白提取试剂(碧云天生物技术研究所), 羊抗-p125多克隆抗体(Santa Cruz), HRP标记鼠抗-GAPDH单克隆抗体(上海康成), HRP标记抗山羊IgG(北京中杉金桥).
1.2.1 引物设计: 参照GenBank基因序列设计, 设计好后Blast, 比对结果与目的基因相符(表1).
| 目的 | 基因片段长度(bp) | 引物序列 |
| POLD1 | 487 | 上游: 5'-ACCTACTGAGCAACCGCATCG-3' |
| 下游: 5'-CGGTACTGGCAGAACTCACAC-3' | ||
| β-actin | 247 | 上游: 5'-AACTCCATCATGAAGTGTGA-3' |
| 下游: 5'-ACTCCTGCTTGCTGATCCAC -3' |
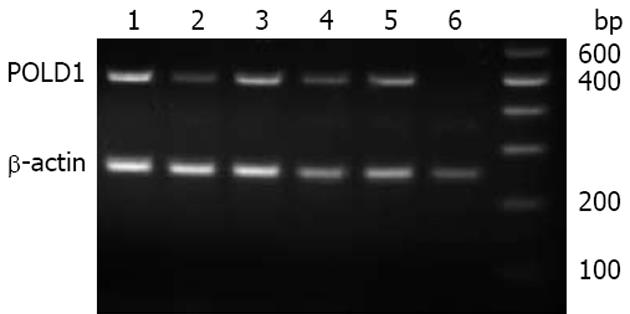
1.2.2 RT-PCR检测mRNA表达[10,11]: 分别取肝癌组织及对应癌旁组织100 mg, 按TRIzol试剂说明书采用一步法提取总RNA. 紫外分光光度计(A260/A280)检测RNA纯度. 逆转录反应: 总RNA 1 μg, Oligo(dT)18 1 μL, 再加去离子水至12 μL, 混匀, 瞬间离心, 70 ℃ 5 min, 迅速置于冰中冷却.依次加入5×Buffer 4 μL, 10 mmol/L dNTP mix 2 μL, RNA酶抑制剂(20 U/μL) 1 μL, Revert AidTM M-MuLV逆转录酶1 μL, 混匀, 瞬间离心. 42 ℃ 60 min, 70 ℃ 10 min. 逆转录合成的cDNA在-20 ℃保存用于PCR. PCR扩增体系25 μL, 加入10×Buffer 2.5 μL、25 mmol/L MgCl2 1.5 μL、10 mmol/L dNTP 0.5 μL、102.5 μmol/L上下游引物各1 μL、cDNA模板2 μL、Taq酶1 U(TaKaRa公司)0.2 μL. 扩增条件为94 ℃ 4 min, 1个循环; 94 ℃ 45 s, 62 ℃ 45 s, 72 ℃ 1 min, 30个循环; 接72 ℃后延伸10 min. PCR产物用3%琼脂糖凝胶电泳分离, 并采用自动电泳凝胶成像分析仪(Bio-Rad, USA)及Quantity One分析软件(Bio-Rad, USA)进行图像分析. POLD1积分灰度值/β-actin积分灰度值为POLD1 mRNA相对表达值.
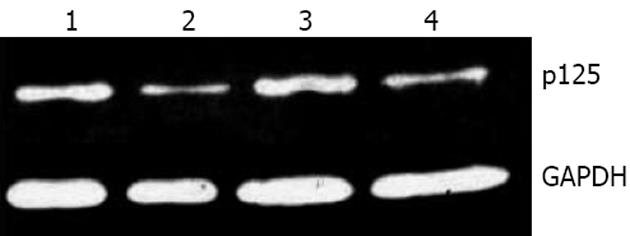
1.2.3 Western blot检测蛋白表达[12]: 提取细胞总蛋白, 定量, 与上样缓冲液按比例混匀, 100 ℃煮5 min, 10% SDS-PAGE电泳后电转移至PVDF膜上, 5%脱脂牛奶室温封闭1 h, 加入羊抗-p125多克隆抗体, 4 ℃孵育过夜, TBST洗涤6次, 每5 min换液1次. 加入HRP标记抗山羊IgG, 室温孵育1 h, TBST洗涤3次, 每5 min换液1次, 在暗室中压片, 然后显影、定影. 图像分析同1.2.2.
统计学处理 SPSS10.0处理, 数据均以mean±SD表示, 采用独立样本t检验作显著性分析. 用χ2检验各病理因素与p125的关系. P<0.05表示有显著性意义.
经紫外分光光度计(A260/A280)检测, RNA纯度较高. 半定量RT-PCR结果显示, 20例肝癌组织中POLD1 mRNA表达与癌旁组织相比明显升高(图1). Quantity One软件分析计算POLD1 mRNA相对表达值, 数据经统计处理, 肝癌组织中POLD1 mRNA的表达为0.70±0.34, 明显高于癌旁组织0.37±0.23(P<0.05, 表2).
| 分组 | POLD1 mRNA | p125 |
| 肝癌组织 | 0.70±0.34 | 0.63±0.19 |
| 癌旁组织 | 0.37±0.23 | 0.39±0.21 |
| t值 | 3.515 | 3.636 |
| P值 | <0.05 | <0.05 |
Western blot检测20对肝癌及癌旁组织中p125蛋白表达情况, 结果显示肝癌组织中p125蛋白表达明显低于癌旁组织. Quantity One软件分析计算p125相对表达值, 数据经统计处理, 肝癌组织中p125蛋白表达为0.63±0.19, 明显高于癌旁组织0.39±0.21(P<0.05, 表2, 图2). p125蛋白表达结果与POLD1 mRNA表达一致.
经统计分析p125蛋白表达与肿瘤大小、HBV感染、临床分期、性别及年龄关系, 结果如表3所示, p125蛋白的阳性表达率与肿瘤大小和临床分期有关(P<0.05), 而与HBV感染、性别及年龄无明显关系(P>0.05).
| 临床病理因素 | n | p125 | χ2值 | P值 | |
| 阳性 | 阴性 | ||||
| 肿瘤直径(cm) | |||||
| <5 | 9 | 3 | 6 | 7.213 | <0.05 |
| ≥5 | 11 | 10 | 1 | ||
| HBsAg | |||||
| + | 18 | 12 | 6 | 2.2 | >0.05 |
| - | 2 | 1 | 1 | ||
| 临床分期 | |||||
| Ⅲ期 | 6 | 6 | 0 | 4.615 | <0.05 |
| Ⅱ期 | 14 | 7 | 7 | ||
| 性别 | |||||
| 男 | 12 | 8 | 4 | 0.03 | >0.05 |
| 女 | 8 | 5 | 3 | ||
| 年龄(岁) | |||||
| ≥60 | 11 | 6 | 5 | 1.174 | >0.05 |
| <60 | 9 | 7 | 2 | ||
原发性肝癌(绝大部分是HCC)在全球癌症死亡率中居第3位, 在我国为第2位的癌症死因[13]. 由于肝癌起病隐匿, 绝大部分患者就诊时已至中、晚期, 预后差. 早期发现是提高外科干预和远期疗效的前提. 手术切除和肝移植虽已被认为是根治肝癌的最好手段[14], 但转移和复发仍是影响肝癌术后生存的最大障碍. 探讨肝癌发生发展和转移复发的分子机制, 寻找早期诊断肝癌、预测转移的生物标志和干预治疗的靶点, 已成为当今肝癌研究的热点[15].
细胞增殖涉及到细胞生命活动的最基本的问题, 与癌和细胞增殖性疾病的发生与发展有着直接的关系[16]. 作为生命现象最本质的内容, DNA复制是细胞正常分裂、增殖的关键一步. 在正常情况下, 细胞周期调控系统通过G1/S期转换调节和控制DNA复制过程的起始和进程. 执行DNA复制这个关键生命功能的多蛋白组成的DNA复制体, 是细胞周期调控因子的综合作用点和效应点[17-19]. 正常DNA复制的完成依赖众多调控因子相互作用对DNA复制体的调控. 比如, 细胞周期素依赖性蛋白激酶(cyclin-dependent kinases, CDKs)、细胞分裂周期蛋白(cell division cycle proteins, CDCs)和细胞周期素(Cyclins)、细胞周期抑制因子(cyclin dependent kinas inhibitor, CDKI)如P21、增殖细胞核抗原(proliferating cell nuclear antigen, PCNA)及E2F、p53、Myc、Rb等多种细胞周期调控因子和不同促进细胞增殖的生长因子参与了此进程的调控[20,21]. 这些调控蛋白和某些已知或未知的上游调控蛋白相互作用形成一个特异的细胞周期依赖的DNA复制调控系统[18,19,22,23]. 一旦某个调控环节失常, 会造成DNA复制异常而导致细胞癌变或病变[24,25]. 所以, 认识DNA复制调控的机制对了解癌症的发生和发展至关重要.
DNA聚合酶δ是真核生物DNA复制的最主要复制酶, 在DNA复制功能蛋白PCNA的辅助下定位于复制叉, 负责以前导链和后续链为模板两种不同形式的DNA复制[6]. 同时他还具有3'-5'核酸外切酶活性[16], 参与复制错误的修正和DNA损伤的修复[26,27], 对保持真核生物基因组的结构完整性和遗传稳定性具有重要作用[28-31]. DNA聚合酶δ的聚合酶和外切酶二者活性位于其催化亚基p125. 只有通过p125上的PIP-box和KA-box两个PCNA相互作用位点, p125与PCNA相互作用才能发挥其功能活性[7,8]. POLD1基因编码p125亚基[9], 该基因定位于染色体19q13.3-13.4[9], 其5'上游区1.8 kb启动子区域已被分离, 该区富含G/C, 不含有TATA box[9]. 相对正常细胞, 肿瘤细胞中POLD1启动子的-110至-324区域含有(特异)上调表达因子的结合序列; -325至-635区域含有(特异)下调表达因子的结合序列[32]. 研究表明在快速生长的人急性淋巴白血病Molt4细胞中p125 mRNA和蛋白质水平在G1/S期间达到高峰, 而且其编码基因POLD1的启动子活性此时也增加了4倍[33]. 敲除POLD1基因能抑制前列腺癌细胞株PC-3细胞生长, 使细胞周期停滞于S期. 证实了在前列腺癌细胞中, POLD1基因是一种重要的调控因子, 会影响癌细胞的生长. 但目前尚未有学者对POLD1与人类癌组织细胞的恶性增殖间的关系进行研究.
本研究采用RT-PCR和Western blot法分别检测20例原发性肝癌患者手术切除的肝癌组织及癌旁组织标本的POLD1基因及蛋白表达, 并分析POLD1蛋白表达与临床特征相关性. 结果发现, 肝癌组织中POLD1基因表达水平显著高于癌旁组织, POLD1基因编码蛋白的表达与基因表达一致. 证实了癌的恶性增殖可能与POLD1的表达相关这一观点. 结合临床资料分析, 肝癌组织中的p125蛋白阳性表达率与肿瘤大小和临床分期有关, 而与HBV感染、性别及年龄无明显关系. 表明癌细胞的恶性增殖与POLD1基因蛋白的表达上调有关, 可作为研究肝癌恶性增殖机制的调控点.
但是, 上述结果仍有待于进一步扩大样本加以证实, 使结果更趋精确. 为了更好地研究肝癌发病机制, 我们接下来的研究重点可放在 "以POLD1为中心的调控网络与癌细胞恶性增殖的关系"上, 明确POLD1调控网络是如何调控DNA异常复制, 从而使细胞恶性增殖的.
DNA复制是细胞正常分裂、增殖的关键一步. 有学者提出"癌的恶性增殖与DNA的大量复制相关". DNA聚合酶δ是真核生物DNA复制的最主要复制酶, POLD1基因编码DNA聚合酶δ的催化亚基p125, 但POLD1及其编码的蛋白p125与肝癌的关系尚未明确.
高润平, 教授, 吉林大学第一医院肝病科
手术切除和肝移植虽已被认为是根治肝癌的最好手段, 但转移和复发仍是影响肝癌术后生存的最大障碍. 探讨肝癌发生发展和转移复发的分子机制, 寻找早期诊断肝癌、预测转移的生物标志和干预治疗的靶点, 已成为当今肝癌研究的热点.
本研究发现, 肝癌组织中POLD1基因蛋白表达水平显著高于癌旁组织, 表明癌的恶性增殖与POLD1的表达相关, 且POLD1编码蛋白p125的阳性表达率与肿瘤大小和临床分期有关, 但与HBV感染、性别及年龄无明显关系.
本文设计合理, 内容新颖, 对于探索原发性肝癌的发生机制具有实际意义.
编辑: 李薇 电编:何基才
| 1. | Jemal A, Siegel R, Ward E, Hao Y, Xu J, Thun MJ. Cancer statistics, 2009. CA Cancer J Clin. 2009;59:225-249. [PubMed] [DOI] |
| 2. | Yuen MF, Hou JL, Chutaputti A. Hepatocellular carcinoma in the Asia pacific region. J Gastroenterol Hepatol. 2009;24:346-353. [PubMed] [DOI] |
| 3. | Wörns MA, Galle PR. Future perspectives in hepatocellular carcinoma. Dig Liver Dis. 2010;42 Suppl 3:S302-S309. [PubMed] [DOI] |
| 4. | Whittaker S, Marais R, Zhu AX. The role of signaling pathways in the development and treatment of hepatocellular carcinoma. Oncogene. 2010;29:4989-5005. [PubMed] [DOI] |
| 6. | Hindges R, Hübscher U. DNA polymerase delta, an essential enzyme for DNA transactions. Biol Chem. 1997;378:345-362. [PubMed] |
| 7. | Xu H, Zhang P, Liu L, Lee MY. A novel PCNA-binding motif identified by the panning of a random peptide display library. Biochemistry. 2001;40:4512-4520. [PubMed] [DOI] |
| 8. | Naryzhny SN. Proliferating cell nuclear antigen: a proteomics view. Cell Mol Life Sci. 2008;65:3789-3808. [PubMed] [DOI] |
| 9. | Chang LS, Zhao L, Zhu L, Chen ML, Lee MY. Structure of the gene for the catalytic subunit of human DNA polymerase delta (POLD1). Genomics. 1995;28:411-419. [PubMed] [DOI] |
| 12. | 王 驰, 钟 鹰, 粟 滔, 黄 靓, 毛 振江, 肖 祥. miR-200b对胃癌MGC-803细胞增殖的影响以及对Bcl-2表达的调节. 世界华人消化杂志. 2010;18:2077-2083. [DOI] |
| 13. | Parkin DM, Bray F, Ferlay J, Pisani P. Global cancer statistics, 2002. CA Cancer J Clin. 2005;55:74-108. [PubMed] [DOI] |
| 14. | Llovet JM, Burroughs A, Bruix J. Hepatocellular carcinoma. Lancet. 2003;362:1907-1917. [PubMed] [DOI] |
| 16. | Shevelev IV, Hübscher U. The 3' 5' exonucleases. Nat Rev Mol Cell Biol. 2002;3:364-376. [PubMed] [DOI] |
| 17. | Tyson JJ, Novak B. Temporal organization of the cell cycle. Curr Biol. 2008;18:R759-R768. [PubMed] [DOI] |
| 18. | Sclafani RA, Holzen TM. Cell cycle regulation of DNA replication. Annu Rev Genet. 2007;41:237-280. [PubMed] [DOI] |
| 19. | Nishitani H, Lygerou Z. Control of DNA replication licensing in a cell cycle. Genes Cells. 2002;7:523-534. [PubMed] [DOI] |
| 20. | Tokino T, Nakamura Y. The role of p53-target genes in human cancer. Crit Rev Oncol Hematol. 2000;33:1-6. [PubMed] [DOI] |
| 21. | Hallstrom TC, Nevins JR. Balancing the decision of cell proliferation and cell fate. Cell Cycle. 2009;8:532-535. [PubMed] [DOI] |
| 22. | Stillman B. DNA polymerases at the replication fork in eukaryotes. Mol Cell. 2008;30:259-260. [PubMed] [DOI] |
| 23. | Budzowska M, Kanaar R. Mechanisms of dealing with DNA damage-induced replication problems. Cell Biochem Biophys. 2009;53:17-31. [PubMed] [DOI] |
| 24. | Bandura JL, Calvi BR. Duplication of the genome in normal and cancer cell cycles. Cancer Biol Ther. 2002;1:8-13. [PubMed] |
| 25. | Blow JJ, Gillespie PJ. Replication licensing and cancer--a fatal entanglement? Nat Rev Cancer. 2008;8:799-806. [PubMed] [DOI] |
| 26. | Longley MJ, Pierce AJ, Modrich P. DNA polymerase delta is required for human mismatch repair in vitro. J Biol Chem. 1997;272:10917-10921. [PubMed] [DOI] |
| 27. | Parsons JL, Preston BD, O'Connor TR, Dianov GL. DNA polymerase delta-dependent repair of DNA single strand breaks containing 3'-end proximal lesions. Nucleic Acids Res. 2007;35:1054-1063. [PubMed] [DOI] |
| 28. | Goldsby RE, Hays LE, Chen X, Olmsted EA, Slayton WB, Spangrude GJ, Preston BD. High incidence of epithelial cancers in mice deficient for DNA polymerase delta proofreading. Proc Natl Acad Sci U S A. 2002;99:15560-15565. [PubMed] [DOI] |
| 29. | Venkatesan RN, Treuting PM, Fuller ED, Goldsby RE, Norwood TH, Gooley TA, Ladiges WC, Preston BD, Loeb LA. Mutation at the polymerase active site of mouse DNA polymerase delta increases genomic instability and accelerates tumorigenesis. Mol Cell Biol. 2007;27:7669-7682. [PubMed] [DOI] |
| 30. | Meng X, Zhou Y, Zhang S, Lee EY, Frick DN, Lee MY. DNA damage alters DNA polymerase delta to a form that exhibits increased discrimination against modified template bases and mismatched primers. Nucleic Acids Res. 2009;37:647-657. [PubMed] [DOI] |
| 31. | Yabuta T, Shinmura K, Yamane A, Yamaguchi S, Takenoshita S, Yokota J. Effect of exogenous MSH6 and POLD1 expression on the mutation rate of the HPRT locus in a human colon cancer cell line with mutator phenotype, DLD-1. Int J Oncol. 2004;24:697-702. [PubMed] |
| 33. | Zeng XR, Hao H, Jiang Y, Lee MY. Regulation of human DNA polymerase delta during the cell cycle. J Biol Chem. 1994;269:24027-24033. [PubMed] |