修回日期: 2010-11-10
接受日期: 2010-11-17
在线出版日期: 2011-01-18
目的: 探讨巨噬细胞抑制因子-1(macrophage inhibitory cytokine-1, MIC-1)及尿激酶型纤容酶原激活剂(urokinase plasminogen activator, uPA)在胃癌组织中的蛋白表达及其临床意义.
方法: 收集郑州大学第一附属医院2009-01/2010-05胃癌存档蜡块55例, 采用免疫组织化学方法检测55例胃癌及正常胃黏膜上皮组织中MIC-1及uPA的蛋白表达情况, 并分析其表达与胃癌临床病理特征的关系.
结果: MIC-1蛋白在胃癌组织中的阳性表达率显著高于正常胃黏膜上皮, 组间比较差异均具有统计学意义(56.4% vs 20.0%, χ2 = 7.792, P<0.05), 并且其在胃癌组织中的阳性表达率与癌的组织学分级、浸润深度及淋巴结转移均相关(χ2 = 6.781, 11.071, 12.806, 均P<0.05). uPA蛋白在胃癌组织中的阳性表达率显著高于正常胃黏膜上皮, 组间比较差异均具有统计学意义(61.8% vs 25.0%, χ2 = 7.965, P<0.05), 并且其在胃癌组织中的阳性表达率与癌的组织学分级、浸润深度及淋巴结转移均相关(χ2 = 13.803, 14.561, 10.668, 均P<0.05). MIC-1与uPA蛋白表达呈正相关关系(γp = 0.591, P<0.05).
结论: MIC-1及uPA的过表达可能与胃癌的发生发展有关, 并对判断胃癌患者的生物学行为具有一定的意义.
引文著录: 曹征, 曲蕴慧, 杜英. 巨噬细胞抑制因子-1及尿激酶型纤容酶原激活剂在胃癌组织中的表达及临床病理意义. 世界华人消化杂志 2011; 19(2): 138-142
Revised: November 10, 2010
Accepted: November 17, 2010
Published online: January 18, 2011
AIM: To investigate the expression of macrophage inhibitory cytokine-1 (MIC-1) and urokinase plasminogen activator (uPA) in gastric carcinoma and to analyze their clinical and pathological significance.
METHODS: Fifty-five gastric carcinoma tissue samples obtained from patients treated from Jan 2009 to May 2010 at the First Affiliated Hospital of Zhengzhou University were used to detect MIC-1 and uPA protein expression by immunohistochemistry. Twenty normal gastric epithelial tissue samples were used as controls. Correlation between MIC-1 and uPA expression and clinical and pathological parameters of gastric carcinoma was then analyzed.
RESULTS: The positive rate of MIC-1 expression in gastric carcinoma was significantly higher than that in normal gastric epithelial tissue (56.4% vs 20.0%, χ2 = 7.792, P < 0.05). The expression of MIC-1 protein was closely correlated with tumor grade, infiltration and lymph node metastasis in gastric carcinoma (χ2 = 6.781, 11.071, 12.806, all P < 0.05). The positive rate of uPA expression in gastric carcinoma was also significantly higher than that in normal gastric epithelial tissue (61.8% vs 25.0%, χ2 = 7.965, P < 0.05). The expression of uPA protein was also closely correlated with tumor grade, infiltration and lymph node metastasis in gastric carcinoma (χ2 = 13.803, 14.561, 10.668, all P < 0.05). There was a positive correlation between the expression of MIC-1 and uPA (γp = 0.591, P < 0.05).
CONCLUSION: The expression of MIC-1 and uPA may be associated with gastric carcinogenesis. Detection of MIC-1 and uPA expression can be used for evaluation of the biological behavior of gastric carcinoma.
- Citation: Cao Z, Qu YH, Du Y. Clinical and pathological significance of MIC-1 and uPA expression in gastric carcinoma. Shijie Huaren Xiaohua Zazhi 2011; 19(2): 138-142
- URL: https://www.wjgnet.com/1009-3079/full/v19/i2/138.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i2.138
转化生长因子-β(transforming growth factor β, TGF-β)超家族成员是一种多功能生长因子, 他们的生物学行为取决于细胞所处的环境. 巨噬细胞抑制因子-1(macrophage inhibitory cytokine-1, MIC-1)是TGF-β超家族的成员之一[1]. 国内外的研究结果显示, MIC-1可以导致肿瘤的发生, 也可以抑制肿瘤的发生. 尿激酶型纤容酶原激活剂(urokinase plasminogen activator, uPA)是一种丝氨酸蛋白酶, 当uPA与其受体结合时, 就引发了蛋白酶激活以及纤溶酶原转化为纤维蛋白溶酶, 这些蛋白酶可以增强对基底膜降解的能力, 从而使之能够克服细胞间和细胞基质的相互作用的制约而导致肿瘤细胞的浸润和/或转移[2,3]. 本研究应用免疫组织化学SP法联合检测胃癌组织中MIC-1和uPA的表达情况, 并对他们与肿瘤的组织学分级、浸润深度及淋巴结转移等临床病理因素之间的关系进行深入分析, 探讨他们在胃癌发病中的可能作用机制, 以期为胃癌的诊断、治疗、临床监测、疗效判断及预后评估等提供新的理论依据.
收集郑州大学第一附属医院2009-01/2010-05胃癌存档蜡块55例, 其中男34例, 女21例, 年龄36-77(平均56.28±10.3)岁; 分化Ⅰ级20例, Ⅱ级21例, Ⅲ级14例; 浸润深度: T1-T2者(未侵及肌层)32例, T3-T4者(侵及肌层)23例; 有淋巴结转移者31例, 无淋巴结转移者24例. 选取20例胃癌手术远端正常黏膜组织做对照. 采用免疫组织化学染色. 兔抗人多克隆Tiam抗体及鼠抗人Rac1单克隆抗体均购自美国Santa Cruz公司, 免疫组织化学试剂盒及3, 3-二氨基联苯胺(digital audio broadcasting, DAB)显色剂购自北京中杉金桥生物技术有限公司.
1.2.1 MIC-1的免疫组织化学染色: 采用链霉菌抗生物素蛋白-过氧化酶连接(streptavidin-perosidase, SP)法, 常规脱蜡, PBS清洗, 抗原修复, 体积分数30 mL/L H2O2清除内源性过氧化物酶活性, PBS清洗, 滴加正常山羊血清封闭, 加一抗(稀释比例分别为1∶100和1∶120), 4 ℃冰箱过夜, PBS清洗, 加二抗, PBS清洗, 加三抗, PBS清洗, DAB显色. 苏木素复染, 梯度乙醇脱水, 二甲苯透明, 中性树胶封片. 用Novus Biologicals公司提供的切片作为阳性对照, PBS代替一抗作为阴性对照.
1.2.2 结果判定: MIC-1阳性显色为棕黄色颗粒, 主要位于细胞核. 参照文献[4,5], 在高倍视野下(×400)随机选取5个视野(每个视野观察≥200个细胞), 按阳性细胞所占的百分比及着色强度进行结果判定. 按着色强度评分, 0分: 无着色; 1分: 浅黄色; 2分: 黄色; 3分: 棕黄色. 按阳性细胞数占同类细胞数的百分比评分: 0分: 阴性; 1分: 阳性细胞数≤10%; 2分: 11%-50%; 3分: 51%-75%; 4分: >75%. 取2项评分的乘积作为总积分, 阴性(-): 0-2分; 阳性(+): 2分以上.
统计学处理 实验结果应用SPSS13.0统计分析软件进行分析, 计数资料采用χ2检验, 检验水准α = 0.05.
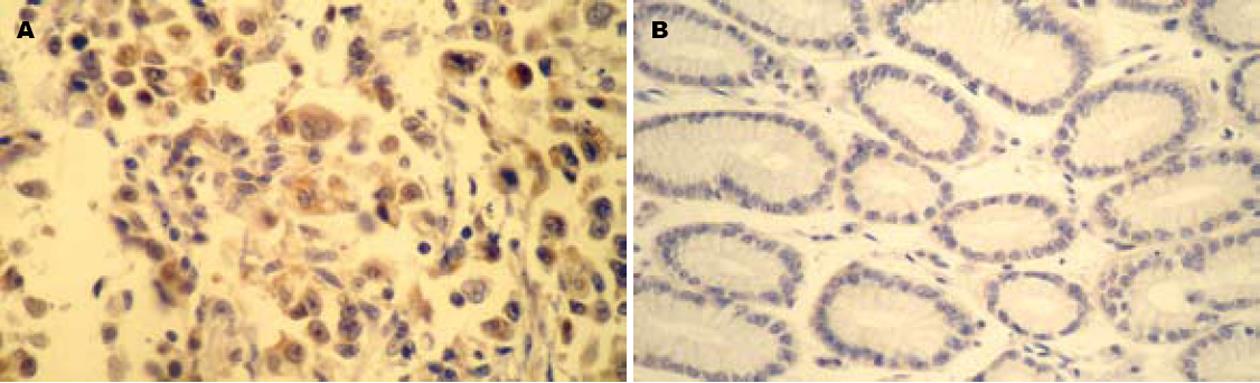
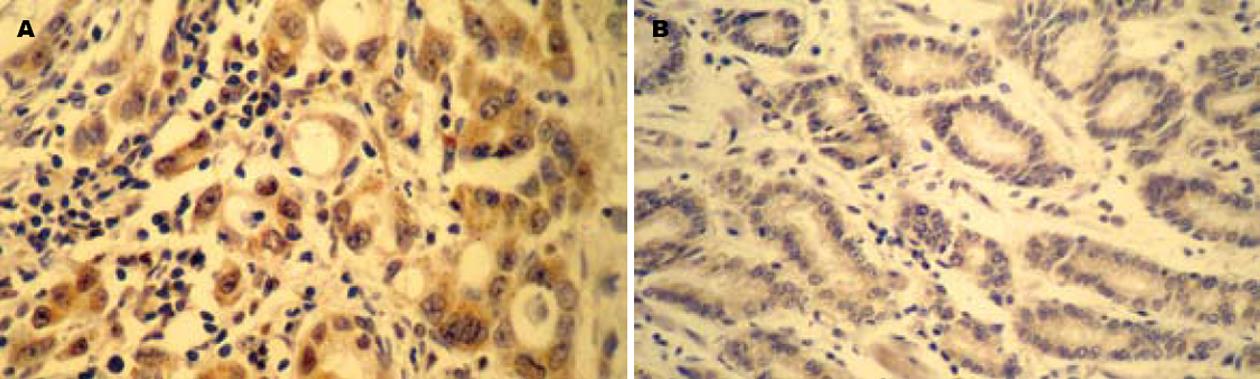
MIC-1蛋白阳性显色为棕黄色颗粒, 主要定位于细胞质, 肿瘤组织中多呈强阳性表达(图1A), 正常黏膜上皮组织多不表达或表达程度较弱(图1B). MIC-1正常胃黏膜上皮中有4例(20.0%)阳性表达, 胃癌组织中MIC-1蛋白阳性表达31例(56.4%), 阳性表达率显著高于正常胃黏膜上皮(P<0.05). MIC-1蛋白的表达与胃癌的分化程度、浸润深度及淋巴结转移均密切相关, 组间比较差异具有统计学意义(P<0.05, 表1).
| 病理特征 | MIC-1 | uPA | |||||
| n | 阳性表达n(%) | χ2值 | P值 | 阳性表达n(%) | χ2值 | P值 | |
| 部位 | |||||||
| 正常胃组织 | 20 | 4(20.0) | 7.792 | 0.005 | 5(25.0) | 7.965 | 0.005 |
| 胃癌 | 55 | 31(56.4) | 34(61.8) | ||||
| 组织学分级 | |||||||
| Ⅰ | 20 | 7(35.0) | 6.781 | 0.034 | 6(30.0) | 13.803 | 0.001 |
| Ⅱ | 21 | 13(61.9) | 16(76.2) | ||||
| Ⅲ | 14 | 11(78.6) | 12(85.7) | ||||
| 浸润深度 | |||||||
| T1-T2 | 32 | 12(37.5) | 11.071 | 0.001 | 13(40.6) | 14.561 | 0.000 |
| T3-T4 | 23 | 19(82.6) | 21(91.3) | ||||
| 淋巴结转移 | |||||||
| 有 | 31 | 24(77.4) | 12.806 | 0.000 | 25(80.6) | 10.668 | 0.001 |
| 无 | 24 | 7(29.2) | 9(37.5) | ||||
MIC-1由活化中的巨噬细胞(单核细胞)分泌, 其在正常情况下通常不表达或者低表达. 人类胎盘组织内MIC-1含量较高, 但是在肾脏、前列腺、胰腺等组织的上皮组织中含量较低, 在其他组织或器官内几乎无表达[6]. 但是某些情况下, 比如在急性损伤、炎症或者是在肿瘤的发生、发展时可呈异常的高表达, 同时, 发现其在败血症和炎症组织, 如类风湿性关节炎、溃疡性结肠炎内的含量增高外, 与胃癌、前列腺癌、肺癌、胰腺癌、结直肠癌等许多恶性肿瘤还有存在着密切的关系[7-14].
uPA系统是导致细胞外基质降解的一个关键因素, 与肿瘤血管的生成、浸润及转移密切相关. 癌细胞的侵袭转移能力与其产生降解细胞外基质的蛋白酶的能力密切相关, 降解基质的蛋白酶包括丝氨酸蛋白酶、半胱氨酸蛋白酶、天冬氨酸蛋白酶及金属蛋白酶(matrix metalloproteinases, MMP)4类, 其中纤溶酶原激活因子(plasminogen activator, PA)和MMP起着关键作用[15]. 纤溶酶原激活因子包括uPA和组织型(tissue urokinase plasminogen activator, tPA). uPA是一种多功能丝氨酸蛋白酶, 相对分子质量大约55 000 Da. uPA可在肾小管上皮细胞、单核细胞、肺上皮细胞及成纤维细胞中表达, 也可在肿瘤细胞内表达[2,3]. Lee等[16]通过稳定转染MIC-1进入人胃癌细胞系SNU-216发现, 其能显著增加胃癌细胞系的侵袭性, 转染的SNU-216细胞高度表达MIC-1, 可能是通过胞外信号传导激酶1/2相关途径来上调uPA/uPA受体(urokinase plasminogen activator receptor, uPAR)活性系统来诱导肿瘤细胞的侵袭性和促进胃癌细胞的恶性程度, 随着剂量的增加, 肿瘤细胞侵袭性和恶性程度也随之增强.
本研究结果显示: MIC-1及uPA激活剂在胃癌组织中的表达显著要高于其在相应的正常对照组中蛋白的表达情况, 该实验结果充分表明: MIC-1及uPA激活剂的激活可能参与了胃癌的发生、发展等相关过程; MIC-1及uPA激活剂可能也参与了胃癌的发病过程, 并有可能会在其发病过程中发挥到了非常重要的作用. 本研究结果同时也还表明: 不同组织分化程度胃癌组织的胃癌中MIC-1及uPA激活剂的表达亦不尽相同; 其蛋白的阳性表达率随着胃癌组织的分化程度降低而增高; 伴随有淋巴结转移的病例组中MIC-1和uPA表达显著高于无淋巴结转移组的表达, 说明巨MIC-1及uPA激活剂与胃癌的恶性程度可能存在有某种关系. 随着胃癌患者组织浸润深度的增加, 其蛋白阳性表达率也随之增加, 而MIC-1及uPA激活剂表达则显著增高. 这又证明了MIC-1及uPA激活剂基因在胃癌的演进过程中与肿瘤细胞的分化和肿瘤的发生有关, MIC-1及uPA激活剂与肿瘤的预后及分子生物学行为可能存在有一定的关系.
研究MIC-1及uPA的表达与肿瘤生长、浸润和转移以及治疗等方面都有重要意义. 我们采用免疫组织化学和RT-PCR技术联合检测了胃癌组织中MIC-1蛋白和mRNA的表达, 初步证明了MIC-1在胃癌的发生、发展中具有重要作用, 检测其表达对于判断胃癌患者的预后也具有一定的意义.
巨噬细胞抑制因子-1(MIC-1)是TGF-β超家族的成员之一. 研究结果显示, MIC-1可以导致肿瘤的发生, 也可以抑制肿瘤的发生.
王鲁平, 主任医师, 中国人民解放军北京军区总医院病理科
关于MIC-1及uPA在胃癌发生发展中的作用国内外尚未见报道. 关于二者与恶性肿瘤关系的研究已成为热点.
本文首次采用免疫组织化学法检测了胃癌组织MIC-1及uPA蛋白的表达情况.
联合检测MIC-1及uPA蛋白表达可望成为胃癌早期诊断、判断预后的分子指标之一.
本研究设计合理, 结果可信, 具有一定的临床病理意义.
编辑: 李薇 电编:何基才
| 1. | Carstensen M, Herder C, Brunner EJ, Strassburger K, Tabak AG, Roden M, Witte DR. Macrophage inhibitory cytokine-1 is increased in individuals before type 2 diabetes diagnosis but is not an independent predictor of type 2 diabetes: the Whitehall II study. Eur J Endocrinol. 2010;162:913-917. [PubMed] [DOI] |
| 2. | Lootens L, Meuleman P, Pozo OJ, Van Eenoo P, Leroux-Roels G, Delbeke FT. uPA+/+-SCID mouse with humanized liver as a model for in vivo metabolism of exogenous steroids: methandienone as a case study. Clin Chem. 2009;55:1783-1793. [PubMed] [DOI] |
| 3. | Wu CY, Wu MS, Chen YJ, Chen HP, Chen CJ, Chang CS, Lin JT. Clinicopathological significance of urokinase-type plasminogen activator genotypes in gastric cancer. Hepatogastroenterology. 2008;55:1890-1894. [PubMed] |
| 4. | 高 冬玲, 李 晟磊, 陈 奎生, 赵 志华, 赵 秋民, 刘 宗文, 张 云汉. 金属蛋白酶抑制基因RECK在食管鳞癌中的表达及生物学意义. 世界华人消化杂志. 2008;16:1634-1638. [DOI] |
| 5. | 李 晟磊, 赵 秋民, 刘 宗文, 赵 志华, 高 冬玲, 郑 湘予, 陈 奎生, 张 云汉. 食管鳞癌中RECK和MMP-9蛋白表达的相关性及临床病理意义. 世界华人消化杂志. 2007;15:1082-1086. [DOI] |
| 6. | Park YJ, Lee H, Lee JH. Macrophage inhibitory cytokine-1 transactivates ErbB family receptors via the activation of Src in SK-BR-3 human breast cancer cells. BMB Rep. 2010;43:91-96. [PubMed] |
| 7. | Huh SJ, Chung CY, Sharma A, Robertson GP. Macrophage inhibitory cytokine-1 regulates melanoma vascular development. Am J Pathol. 2010;176:2948-2957. [PubMed] [DOI] |
| 8. | Taniguchi S, Taoka R, Inui M, Sugimoto M, Kakehi Y. Influence of inflammation and aging on macrophage inhibitory cytokine-1 gene expression in rat ventral prostate. Urology. 2009;73:410-414. [PubMed] [DOI] |
| 9. | Hayes VM, Severi G, Southey MC, Padilla EJ, English DR, Hopper JL, Giles GG, Sutherland RL. Macrophage inhibitory cytokine-1 H6D polymorphism, prostate cancer risk, and survival. Cancer Epidemiol Biomarkers Prev. 2006;15:1223-1225. [PubMed] [DOI] |
| 10. | Baek KE, Yoon SR, Kim JT, Kim KS, Kang SH, Yang Y, Lim JS, Choi I, Nam MS, Yoon M. Upregulation and secretion of macrophage inhibitory cytokine-1 (MIC-1) in gastric cancers. Clin Chim Acta. 2009;401:128-133. [PubMed] [DOI] |
| 11. | Senapati S, Rachagani S, Chaudhary K, Johansson SL, Singh RK, Batra SK. Overexpression of macrophage inhibitory cytokine-1 induces metastasis of human prostate cancer cells through the FAK-RhoA signaling pathway. Oncogene. 2010;29:1293-1302. [PubMed] [DOI] |
| 12. | Zimmers TA, Jin X, Hsiao EC, McGrath SA, Esquela AF, Koniaris LG. Growth differentiation factor-15/macrophage inhibitory cytokine-1 induction after kidney and lung injury. Shock. 2005;23:543-548. [PubMed] |
| 13. | Mimeault M, Batra SK. Divergent molecular mechanisms underlying the pleiotropic functions of macrophage inhibitory cytokine-1 in cancer. J Cell Physiol. 2010;224:626-635. [PubMed] [DOI] |
| 14. | Yang H, Choi HJ, Park SH, Kim JS, Moon Y. Macrophage inhibitory cytokine-1 (MIC-1) and subsequent urokinase-type plasminogen activator mediate cell death responses by ribotoxic anisomycin in HCT-116 colon cancer cells. Biochem Pharmacol. 2009;78:1205-1213. [PubMed] [DOI] |
| 15. | Schwock J, Dhani N, Hedley DW. Targeting focal adhesion kinase signaling in tumor growth and metastasis. Expert Opin Ther Targets. 2010;14:77-94. [PubMed] [DOI] |
| 16. | Lee DH, Yang Y, Lee SJ, Kim KY, Koo TH, Shin SM, Song KS, Lee YH, Kim YJ, Lee JJ. Macrophage inhibitory cytokine-1 induces the invasiveness of gastric cancer cells by up-regulating the urokinase-type plasminogen activator system. Cancer Res. 2003;63:4648-4655. [PubMed] |