修回日期: 2011-06-21
接受日期: 2011-06-28
在线出版日期: 2011-07-08
目的: 探讨不同浓度的软脂酸对酒精体外诱导的脂肪变性肝细胞的作用及机制.
方法: 体外培养人正常肝细胞株L-02, 设立空白对照组、酒精诱导组及软脂酸干预组. 软脂酸干预组设6个浓度梯度(2.5、5、10、20、30、40 μmol/L), 空白对照组用正常培基培养96 h, 酒精诱导组和软脂酸干预组在细胞培养24 h后加入终浓度为60 mL/L的无水乙醇, 继续培养24 h后, 软脂酸干预组加入各浓度软脂酸. 采用MTT法测细胞增殖, 油红O染色观察细胞内脂滴形成情况, 试剂盒检测细胞内三酰甘油的含量, Western blot法测定细胞核内成熟的固醇调节元件结合蛋白-1c(nSREBP-1c)的含量.
结果: 60 mL/L的无水乙醇培养L-02细胞72 h成功建立了脂肪变性模型, 软脂酸干预后, 软脂酸浓度≤10 μmol/L时, 软脂酸明显地促进酒精诱导的脂肪变性肝细胞的增殖(P<0.05), 并且明显地减轻细胞内脂滴的形成, 减少细胞内三酰甘油的含量和细胞核内nSREBP-1c的含量, 并呈现出剂量效应关系; 而软脂酸浓度≥20 μmol/L时, 明显地抑制酒精诱导的脂肪变性肝细胞的增殖(P<0.05), 并且加重细胞内脂滴的形成, 增加细胞内三酰甘油和细胞核内nSREBP-1的含量(P<0.05), 呈现出对酒精诱导的脂肪变性肝细胞的损害作用.
结论: 在一定浓度范围内, 软脂酸对酒精诱导的脂肪变性肝细胞有防治作用, 但超过此范围时, 却反过来加重肝细胞的脂肪变性. 推测软脂酸对酒精诱导的脂肪变性肝细胞的影响与调节肝细胞核内nSREBP-1c有关.
引文著录: 王春晖, 卿笃信. 软脂酸对酒精体外诱导的脂肪变性肝细胞的作用及机制. 世界华人消化杂志 2011; 19(19): 1996-2001
Revised: June 21, 2011
Accepted: June 28, 2011
Published online: July 8, 2011
AIM: To determine the effect of different concentrations of palmitic acid on alcohol-induced lipogenesis in L-02 liver cells and to explore mechanisms involved.
METHODS: Cultured L-02 liver cells were divided into three groups: blank control group, alcohol induction group, and palmitic acid intervention group, which were cultured in RPMI 1640 medium containing 10% serum, RPMI 1640 medium containing 10% serum and 6% ethanol, and RPMI 1640 medium containing 10% serum, 6% ethanol and different concentrations of palmitic acid (2.5, 5, 10, 20, 30, and 40 µmol/L), respectively. Cell proliferation was measured by MTT assay. The accumulation of lipid droplets was observed by light inverted microscopy after red oil-O staining. Intracellular triglyceride (TG) level was determined using commercial kits. Western blot was used to detect the levels of nuclear SREBP-1c protein in hepatocytes of each group.
RESULTS: A model of alcohol-induced steatosis was successfully induced in L-02 liver cells by incubation with 0.6% ethanol for 72 h. Compared to the alcohol induction group, palmitic acid at concentrations of 2.5, 5, and 10 µmol/L could not only significantly promote cell proliferation (all P < 0.05) but also significantly reduce the accumulation of lipid droplets and the levels of intracellular TG and nuclear SREBP-1c protein (all P < 0.05), showing concentration-dependent protective effects. However, palmitic acid at concentrations of 20, 30 and 40 µmol/L significantly inhibited cell proliferation (all P < 0.05) and increased the accumulation of lipid droplets and the levels of intracellular TG and nuclear SREBP-1c protein (all P < 0.05), showing harmful effect on alcohol-induced steatosis in L-02 liver cells.
CONCLUSION: Palmitic acid at concentrations <10 µmol/L has protective effects and palmitic acid at concentrations >10 µmol/L has harmful effects on alcohol-induced steatosis in L-02 liver cells. Palmitic acid exerts effects on alcohol-induced steatosis in L-02 liver cells via mechanisms associated with regulating the expression of nuclear SREBP-1c protein in hepatocytes.
- Citation: Wang CH, Qing DX. Effect of palmitic acid on ethanol-induced fatty degeneration in hepatic cells in vitro. Shijie Huaren Xiaohua Zazhi 2011; 19(19): 1996-2001
- URL: https://www.wjgnet.com/1009-3079/full/v19/i19/1996.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i19.1996
慢性饮酒引起的肝脏脂肪的累积可以导致更为严重的肝脏损伤形式[1,2]. 药理学发展的目标就是在早期阶段逆转脂肪变性. 如果说戒酒是处理各种形式的酒精性肝病(alcoholic liver disease, ALD)的长期目标, 那么通过饮食调节来防治ALD将是一个更吸引人的途径. 已有动物实验证实饱和脂肪酸可以防治ALD, 防治作用与调节脂质代谢[3,4]、降低氧化应激及脂质过氧化[5]、减轻肝纤维化[6]有关. 软脂酸是一种饱和脂肪酸, 除了具有某些潜在的生理功能外[7], 对血脂的影响作用也较复杂[8,9], 其富含于各种动物油脂中, 与人们日常生活息息相关. 本实验将在体外条件下研究软脂酸对酒精诱导的脂肪变性肝细胞的作用及可能机制.
人正常肝细胞株L-02购自中南大学湘雅医院细胞实验中心, 胎牛血清购自杭州四季青生物工程材料有限公司, RPMI 1640培养液购自美国Gibco公司, 软脂酸购自美国Sigma公司, 无水乙醇为国产分析纯, MTT购自湘雅附二医院实验中心, 三酰甘油检测试剂盒购自南京建成生物工程研究所, 细胞核内成熟的固醇调节元件结合蛋白-1c(nuclear sterol regulatory element-binding protein-1c, SREBP-1c)抗体购自北京博奥森生物技术有限公司.
1.2.1 软脂酸浓度的选择与溶解: 张红锋等[10]的实验结果证实6 mL/L的乙醇与20 μmol/L的软脂酸联合培养肝细胞, 可以建立肝细胞脂肪变性模型, 且比乙醇单独作用引起的脂肪变性严重, 因此我们考虑如果软脂酸对酒精诱导的脂肪变性肝细胞有防治作用, 其浓度可能低于20 μmol/L, 因此我们选用2.5、5、10、20、30、40 μmol/L一系列的浓度作为软脂酸的干预浓度, 以探讨软脂酸对酒精诱导的脂肪变性肝细胞的作用. 软脂酸的溶解[11]: 用0.1 mol/L的NaOH溶液在70 ℃中溶解一定量的软脂酸, 震荡混匀10 min, 然后过滤, 配成100 mmol/L的软脂酸储存液. 在55 ℃水浴中用去离子水配50 g/L的无脂肪酸的BSA溶液, 过滤, 然后将上述的软脂酸溶液和BSA溶液按1:19的体积比混合配成5 mmol/L 软脂酸和50 g/L BSA复合液, 复合液在水浴中震荡10 s后继续水浴10 min, 取出冷却至室温. 后将此复合液用不同体积的培养液配成终浓度为2.5、5、10、20、30、40 μmol/L的软脂酸工作液.
1.2.2 肝细胞L-02的培养与传代: 采用100 mL/L胎牛血清(FBS)的RPMI 1640培养液, 在37 ℃、50 mL/L CO2饱和湿度孵育箱内培养. 2-3 d换液1次, 约3-5 d能单层长满培养瓶底, 长满瓶底后, 用2.5 g/L胰蛋白酶消化, 按1:3传代, 所有实验均取对数生长期细胞.
1.2.3 实验分组与细胞的处理: 培养细胞到对数生长期后将细胞分为8组: 空白对照组(NA)、酒精诱导组(A)、2.5 μmol/L软脂酸干预组(PA1)、5 μmol/L软脂酸干预组(PA2)、10 μmol/L软脂酸干预组(PA3)、20 μmol/L软脂酸干预组(PA4)、30 μmol/L软脂酸干预组(PA5)、40 μmol/L软脂酸干预组(PA6), 3组均在37 ℃、50 mL/L CO2饱和湿度孵育箱内培养24 h后, NA组仍换用正常培养液, A组及软脂酸干预组分别加入含终浓度为60 mL/L无水乙醇的培养液, 继续培养24 h后, 软脂酸干预组加入软脂酸母液, 使其终浓度为2.5、5、10、20、30、40 μmol/L, NA组及A组加入与软脂酸母液其他成分相同但不含有软脂酸的等体积溶液, 48 h后进行相关指标的检测, 实验各组处理时均设4个复孔, 且每个指标重复测定3次.
1.2.4 MTT法观察软脂酸对酒精体外诱导的脂肪变性肝细胞增殖的影响: 采用96孔板, 每孔植入1×104个细胞, 按上述方法分组处理, 48 h后吸出培养液, 各孔中加入200 μL浓度为0.05%的MTT, 37 ℃孵育4 h, 去上清液, 各孔各加入200 μL二甲基亚砜(DMSO), 震荡10 min, 混匀以溶解被还原的MTT结晶, 在酶标仪上检测波长为490 nm吸光度值(A490), 计算各组细胞的存活率.
1.2.5 油红O染色观察各组细胞内脂滴的形成情况: 采用24孔板, 每孔植入4×104个细胞, 按上述方法分组处理, 结束后弃去上清液, 用PBS洗涤3遍, 加入4%多聚甲醛1 mL固定30 min, PBS洗2次, 后每孔中加入3油红O稀释液1 mL, 染色30 min, PBS漂洗2次, 稍干后, 可于倒置显微镜下观察细胞内脂滴的形成情况.
1.2.6 各组细胞内三酰甘油检测: 采用6孔板, 每孔植入1×105个细胞, 按上述方法分组处理, 结束后弃去上清液, 收集各组培养板上的细胞, 按三酰甘油检测试剂盒要求, 提取并检测细胞内三酰甘油的含量.
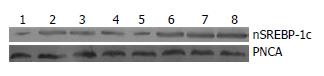
1.2.7 Western blot法检测各组细胞核内nSREBP-1c的含量: 细胞分组处理后提取核蛋白, 以50 μg孔上样, 电泳(60 V, 2.5 h)结束后用半干转仪将凝胶中蛋白转移到NC膜上, 后将NC膜用3% BSA封闭2 h, 一抗4 ℃孵育过夜, 二抗常温孵育1 h, 以新鲜配制NBT/BCIP显色, 水洗终止反应, NC膜晾干后用扫描仪输出结果, 结果用Image J软件分析处理. 以PCNA作为内参照, 将目的条带灰度值与PCNA灰度值相比作为目的蛋白的相对表达量.
统计学处理 采用SPSS17.0统计软件进行数据的处理分析, 实验数据均以mean±SD表示, 先进行方差齐性检验, 如符合方差齐性, A组与各干预组间比较采用单因素方差分析, NA组与A组两组间比较采取配对t检验, 确定P<0.05为差异有显著性意义.
A组细胞存活率较NA组降低(P<0.05), 当软脂酸浓度≤10 μmol/L时, 软脂酸对酒精体外诱导的脂肪变性肝细胞的增殖有一定的促进作用, 差别有统计学意义(P<0.05); 当软脂酸的浓度≥20 μmol/L时, 软脂酸反过来抑制细胞的增殖, 而且随着软脂酸浓度的增加抑制作用越明显, 差别有统计学意义(P<0.05, 表1).
| 分组 | A值 | 细胞活性的变化(%) |
| NA组 | 0.824±0.018 | 100.0 |
| A组 | 0.776±0.011a | 94.2 |
| PA1组 | 0.793±0.013c | 96.2 |
| PA2组 | 0.795±0.015c | 96.5 |
| PA3组 | 0.802±0.011c | 97.3 |
| PA4组 | 0.716±0.011c | 86.9 |
| PA5组 | 0.693±0.014ce | 84.1 |
| PA6组 | 0.649±0.014ceg | 78.8 |
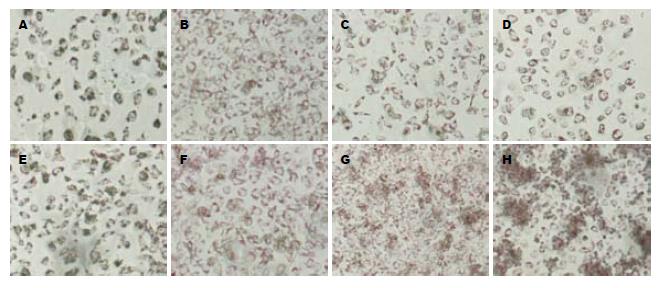
NA组细胞形态正常, 胞膜界限清楚, 胞内无明显脂滴形成; A组细胞较NA组稍肿胀, 胞内可见大小不等的橘红色脂滴, 分布在靠近细胞膜的区域, 并可见少许脱落细胞; 软脂酸干预后, 与酒精诱导组相比, 当软脂酸浓度≤10 μmol/L时, 肝细胞内形成的脂滴大小和数量均有所减轻, 脱落细胞减少, 而且软脂酸浓度越高对脂滴的减轻作用越明显, 当软脂酸浓度≥20 μmol/L时, 软脂酸反过来可以加重细胞内脂滴的形成, 且软脂酸浓度越大加重作用越强, 当软脂酸为40 μmol/L时, 细胞内橘红色的脂滴明显增多, 并连接成片, 同时脱落细胞亦明显增多(图1).
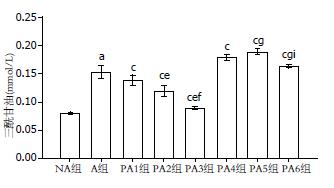
经测定A组细胞内三酰甘油的量较NA组高(P<0.05), 软脂酸干预组: 当软脂酸浓度≤10 μmol/L时, 软脂酸可以减少细胞内三酰甘油的量(P<0.05), 且随软脂酸浓度的增加减轻作用越明显, 当软脂酸浓度≥20 μmol/L时, 软脂酸则可以增加细胞内三酰甘油的量, PA5组较PA4组增加作用明显, 但PA6组较PA4、PA5组增加作用减小(P<0.05, 图2).
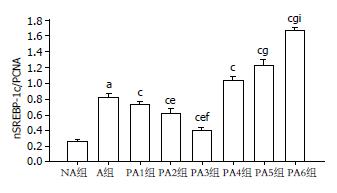
A组核内nSREBP-1c的相对表达量较NA组增高(P<0.05), 软脂酸干预组: 当软脂酸浓度≤10 μmol/L时, 软脂酸干预组核内nSREBP-1c的相对表达量较A组低(P<0.05), 且随软脂酸浓度的增加而降低, 当软脂酸浓度≥20 μmol/L时, 软脂酸干预组核内nSREBP-1c的相对表达量较A组高(P<0.05), 且随着软脂酸浓度的增加而增高(P<0.05, 图3, 4).
ALD是指长期大量摄入酒精而导致肝脏损害的一系列病变[12], 其包括酒精性脂肪肝(alcohol fatty liver, AFL)、酒精性肝炎(alcoholic hepatitis, AH)、酒精性肝纤维化(alcoholic hepatic fibrosis, AHF)、酒精性肝硬化(alcoholic cirrhosis, AC). 随着社会经济的发展, 饮酒人数和人均饮酒量呈现逐年上升的趋势, 酒精滥用和酒精依赖已成为当今世界日益严重的公共卫生问题[13]. 国内外流行病学研究均显示ALD的患病率呈不断上升趋势[14,15], 由此预测, 未来10年或20年以后, ALD将成为我国肝病防治的主要对象. 随着ALD发病机制的研究进展[16-19], 对于寻求和研发防治ALD的药物提供了基础, 目前用于防治ALD的措施有戒酒、中药[20]、应用降脂药物[21]、抗纤维化[22]、补充B类维生素及氨基酸、平衡营养等[23,24]. 近些年来许多动物实验证实了饱和脂肪酸可以用来防治ALD[3-6], 这就为通过饮食调节来防治ALD提供了希望, 且证实其防治作用广泛, 与调节脂质代谢、减少氧化应激、减轻炎症和纤维化有关, 但亦有实验证实饱和脂肪酸本身即可以导致脂肪肝[25], 且其导致脂肪肝的机制部分与上调SREBP-1c有关[26], 而且张红锋等[10]用乙醇与软脂酸共同培养肝细胞时, 也成功地建立了脂肪变性肝细胞模型, 因此饱和脂肪酸对ALD的确切作用还不清楚, 推测可能与饱和脂肪酸的量有关, 为了更好地研究饱和脂肪酸对ALD的作用, 且弥补动物实验的不足, 本实验在体外条件下观察了不同浓度的软脂酸对酒精诱导的脂肪变性肝细胞的作用及可能机制.
实验结果显示软脂酸浓度≤10 μmol/L时, 对酒精诱导的脂肪变性肝细胞起防治作用, 即使在酒精存在的情况下依旧对其起保护作用, 其中包括可以促进酒精诱导的脂肪变性肝细胞的增殖及减轻酒精引起的脂肪变性, 但当软脂酸浓度≥20 μmol/L时, 软脂酸反过来加重了酒精对肝细胞的损害, 其中包括抑制细胞的增殖及加重脂肪变性. 由此得出软脂酸对于酒精诱导的脂肪变性肝细胞的防治作用存在一个"界限", 即在界限范围之内可以防治酒精引起的肝细胞脂肪变性, 但超过此范围却反过来加重酒精引起的脂肪变性, 而且研究发现软脂酸的防治作用存在剂量效应关系, 同时加重作用也呈现出随浓度增加而加重的现象. 另外我们检测了与肝细胞脂肪合成密切相关的nSREBP-1c的表达量, 结果显示nSREBP-1c的表达呈现出与其他指标相同的趋势, 即在上述范围内nSREBP-1c表达量降低, 且随软脂酸浓度的增加而降低, 超过上述范围nSREBP-1c表达量升高, 且随软脂酸浓度增加而升高. 综合上述实验结果, 我们推测软脂酸对酒精诱导的脂肪变性肝细胞的防治作用存在一个"度"的问题, 超过了一定的"度"将对酒精诱导的脂肪变性肝细胞产生损害作用, 而且推测软脂酸对酒精诱导的脂肪变性肝细胞的影响可能部分与调节核内的nSREBP-1c的表达有关, 至于软脂酸是如何调节nSREBP-1c的更为精细的机制需要进一步研究, 而且由于本实验的研究时间比较短, 软脂酸对酒精诱导的脂肪变性肝细胞的长期作用如何也有待进一步的研究.
饱和脂肪酸对ALD存在防治作用为我们通过调节饮食来防治ALD带来了希望, 但是饱和脂肪酸本身可以导致脂肪肝, 以及对其他器官的损害作用又限制了他的应用, 因此需要我们进行更完善的实验以便更好的利用饱和脂肪酸, 另外本实验只探讨了饱和脂肪酸的其中一种, 由于各种种类的饱和脂肪酸拥有各自不同的生理作用[27-30], 不同种类的饱和脂肪酸对ALD的作用如何需要我们进一步的实验证实及探讨.
慢性饮酒引起的肝脏脂肪的累积可以导致更为严重的肝脏损伤形式. 药理学发展的目标就是在早期阶段逆转脂肪变性.
潘兴华, 副主任医师, 中国人民解放军成都军区昆明总医院病理实验科
已有动物实验证实饱和脂肪酸可以防治ALD, 防治作用与调节脂质代谢、降低氧化应激及脂质过氧化、减轻肝纤维化有关.
在一定浓度范围内, 软脂酸对酒精诱导的脂肪变性肝细胞有防治作用, 但超过此范围时, 却反过来加重肝细胞的脂肪变性. 推测软脂酸对酒精诱导的脂肪变性肝细胞的影响与调节肝细胞核内nSREBP-1c有关.
本文提示从饮食调节和外源干预的角度可能寻找到控制肝脂肪变性的简便方法, 有一定的参考和实用价值.
编辑: 李薇 电编:何基才
| 1. | Diehl AM. Nonalcoholic fatty liver disease: implications for alcoholic liver disease pathogenesis. Alcohol Clin Exp Res. 2001;25:8S-14S. [PubMed] [DOI] |
| 2. | Yang S, Lin H, Diehl AM. Fatty liver vulnerability to endotoxin-induced damage despite NF-kappaB induction and inhibited caspase 3 activation. Am J Physiol Gastrointest Liver Physiol. 2001;281:G382-G392. [PubMed] |
| 3. | You M, Cao Q, Liang X, Ajmo JM, Ness GC. Mammalian sirtuin 1 is involved in the protective action of dietary saturated fat against alcoholic fatty liver in mice. J Nutr. 2008;138:497-501. [PubMed] |
| 4. | You M, Considine RV, Leone TC, Kelly DP, Crabb DW. Role of adiponectin in the protective action of dietary saturated fat against alcoholic fatty liver in mice. Hepatology. 2005;42:568-577. [PubMed] [DOI] |
| 5. | Ronis MJ, Korourian S, Zipperman M, Hakkak R, Badger TM. Dietary saturated fat reduces alcoholic hepatotoxicity in rats by altering fatty acid metabolism and membrane composition. J Nutr. 2004;134:904-912. [PubMed] |
| 6. | Nanji AA, Jokelainen K, Tipoe GL, Rahemtulla A, Dannenberg AJ. Dietary saturated fatty acids reverse inflammatory and fibrotic changes in rat liver despite continued ethanol administration. J Pharmacol Exp Ther. 2001;299:638-644. [PubMed] |
| 7. | Mitchell DA, Vasudevan A, Linder ME, Deschenes RJ. Protein palmitoylation by a family of DHHC protein S-acyltransferases. J Lipid Res. 2006;47:1118-1127. [PubMed] [DOI] |
| 8. | Chait A, Brunzell JD, Denke MA, Eisenberg D, Ernst ND, Franklin FA, Ginsberg H, Kotchen TA, Kuller L, Mullis RM. Rationale of the diet-heart statement of the American Heart Association. Report of the Nutrition Committee. Circulation. 1993;88:3008-3029. [PubMed] |
| 9. | Sundram K, Hayes KC, Siru OH. Dietary palmitic acid results in lower serum cholesterol than does a lauric-myristic acid combination in normolipemic humans. Am J Clin Nutr. 1994;59:841-846. [PubMed] |
| 10. | 张 红锋, 杨 慧萍, 王 耀发. 乙醇和软脂酸诱导的脂肪肝离体细胞模型. 华东师范大学学报(自然科学版). 2002;88-95. |
| 11. | Karaskov E, Scott C, Zhang L, Teodoro T, Ravazzola M, Volchuk A. Chronic palmitate but not oleate exposure induces endoplasmic reticulum stress, which may contribute to INS-1 pancreatic beta-cell apoptosis. Endocrinology. 2006;147:3398-3407. [PubMed] [DOI] |
| 12. | Lieber CS. Alcoholic fatty liver: its pathogenesis and mechanism of progression to inflammation and fibrosis. Alcohol. 2004;34:9-19. [PubMed] [DOI] |
| 13. | 孙 艳, 吴 阳, 刘 兵, 刘 凯, 白 靓, 迟 宝荣. 酒精性肝病的研究进展. 吉林大学报(医学版). 2006;32:733-736. |
| 14. | Diehl AM. Liver disease in alcohol abusers: clinical perspective. Alcohol. 2002;27:7-11. [PubMed] [DOI] |
| 15. | 姚 桢. 酒精性肝病的发病机制: 遗传学机制. 北京: 中国医药科技出版社 2001; 20-21. |
| 17. | Venkatraman A, Landar A, Davis AJ, Chamlee L, Sanderson T, Kim H, Page G, Pompilius M, Ballinger S, Darley-Usmar V. Modification of the mitochondrial proteome in response to the stress of ethanol-dependent hepatotoxicity. J. Biol Chem. 2004;279:22092-22101. [PubMed] [DOI] |
| 18. | McClain CJ, Song Z, Barve SS, Hill DB, Deaciuc I. Recent advances in alcoholic liver disease. IV. Dysregulated cytokine metabolism in alcoholic liver disease. Am J Physiol Gastrointest Liver Physiol. 2004;287:G497-G502. [PubMed] [DOI] |
| 19. | Enomoto N, Takei Y, Yamashina S, Ikejima K, Kitamura T, Sato N. Anti-inflammatory strategies in alcoholic steatohepatitis. J Gastroenterol Hepatol. 2007;22 Suppl 1:S59-S61. [PubMed] [DOI] |
| 21. | Caballería J, Parés A, Brú C, Mercader J, García Plaza A, Caballería L, Clemente G, Rodrigo L, Rodés J. Metadoxine accelerates fatty liver recovery in alcoholic patients: results of a randomized double-blind, placebo-control trial. Spanish Group for the Study of Alcoholic Fatty Liver. J Hepatol. 1998;28:54-60. [PubMed] [DOI] |
| 23. | Stickel F, Hoehn B, Schuppan D, Seitz HK. Review article: Nutritional therapy in alcoholic liver disease. Aliment Pharmacol Ther. 2003;18:357-373. [PubMed] [DOI] |
| 25. | Storlien LH, Higgins JA, Thomas TC, Brown MA, Wang HQ, Huang XF, Else PL. Diet composition and insulin action in animal models. Br J Nutr. 2000;83 Suppl 1:S85-S90. [PubMed] [DOI] |
| 26. | Su HM, Zhang ZX, Pan L, Guo YR, Liu YK, Zhang Q. [Metabolic characteristics of a fatty liver disease model induced by high-fat feeding in young rats]. Zhonghua Ganzangbing Zazhi. 2010;18:54-58. [PubMed] |
| 27. | Molkentin J. Occurrence and biochemical characteristics of natural bioactive substances in bovine milk lipids. Br J Nutr. 2000;84 Suppl 1:S47-S53. [PubMed] [DOI] |
| 28. | Hornung B, Amtmann E, Sauer G. Lauric acid inhibits the maturation of vesicular stomatitis virus. J Gen Virol. 1994;75:353-361. [PubMed] [DOI] |
| 29. | Temme EH, Mensink RP, Hornstra G. Effects of medium chain fatty acids (MCFA), myristic acid, and oleic acid on serum lipoproteins in healthy subjects. J Lipid Res. 1997;38:1746-1754. [PubMed] |
| 30. | Grundy SM. Influence of stearic acid on cholesterol metabolism relative to other long-chain fatty acids. Am J Clin Nutr. 1994;60:986S-990S. [PubMed] |