修回日期: 2011-06-04
接受日期: 2011-06-15
在线出版日期: 2011-07-08
目的: 探讨小干扰RNA(siRNA)沉默泛素特异性肽酶22(ubiquitin specific peptidase 22, USP22)对胃癌细胞增殖的影响.
方法: 针对USP22基因设计3条siRNA及阴性siRNA, 用脂质体Lipofectamine 2000转染胃癌AGS细胞, 通过实时定量PCR和Western blot检测转染后AGS细胞USP22基因中mRNA和蛋白表达水平的变化情况, 流式细胞术检测细胞周期分布变化情况, CCK8法检测细胞增殖率及抑制率.
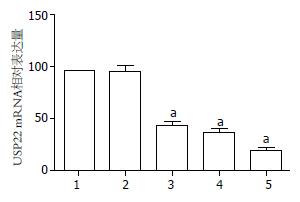
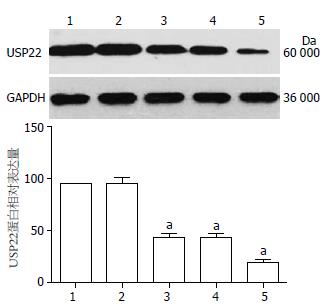
结果: 转染48 h后, 3条siRNA均能显著抑制USP22 mRNA和蛋白的表达. 其中, 以转染USP22 siRNA3后效果最明显, mRNA和蛋白表达分别下降80.47%±2.99%和79.40%±3.58%. 细胞增殖明显受到抑制, USP22 siRNA3组细胞增殖抑制率为27.33%±3.49%. 细胞周期中G0/G1期细胞增多, S期细胞减少.
结论: 采用RNA干扰技术能够有效地沉默USP22基因的表达, 并显著抑制胃癌细胞的增殖.
引文著录: 邓美洲, 陶凯雄, 王国斌, 刘兴华. siRNA沉默USP22基因对胃癌细胞增殖的抑制作用. 世界华人消化杂志 2011; 19(19): 1985-1989
Revised: June 4, 2011
Accepted: June 15, 2011
Published online: July 8, 2011
AIM: To evaluate the impact of silencing of the USP22 gene by small interfering RNA (siRNA) on the proliferation of human gastric cancer AGS cells.
METHODS: Three USP22-specific siRNAs and a negative siRNA were designed and transfected into AGS cells using Lipofectamine 2000. Quantitative real-time PCR (qRT-PCR) and Western blot were utilized to detect the expression levels of USP22 mRNA and protein, respectively. Cell proliferation was measured using Cell Counting Kit-8 (CCK-8). The distribution of cell cycle was determined by flow cytometry.
RESULTS: All three USP22-specific siRNAs could silence the expression of the USP22 gene. Forty-eight hours after transfection, the expression levels of USP22 mRNA and protein were reduced by 80.47% ± 2.99% and 79.40% ± 3.58%, respectively; the reduced rate of cell proliferation was 27.33% ± 3.49%; and the proportion of gastric cancer cells arrested in G0/G1 phase increased significantly, while those arrested in S phase decreased significantly.
CONCLUSION: Transfection of USP22-specific siRNAs could effectively inhibit the expression of the USP22 gene and significantly suppress cell growth in human gastric cancer cell line AGS.
- Citation: Deng MZ, Tao KX, Wang GB, Liu XH. SiRNA-mediated silencing of the USP22 gene inhibits cell proliferation in human gastric cancer cell line AGS. Shijie Huaren Xiaohua Zazhi 2011; 19(19): 1985-1989
- URL: https://www.wjgnet.com/1009-3079/full/v19/i19/1985.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i19.1985
胃癌是消化系最常见的恶性肿瘤之一. 尽管手术联合辅助化疗不断取得改进, 胃癌患者预后仍不理想[1]. 胃癌细胞增殖过快是导致胃癌患者生存率减低的重要原因, 因此抑制胃癌细胞增殖可作为抑制胃癌进展、改善胃癌患者预后的重要手段. 目前, 随着胃癌研究的进展, 针对肿瘤细胞生长、凋亡、细胞周期等分子靶向治疗在胃癌的诊治中逐渐受到重视, 寻找到合适的治疗靶点便成为影响治疗效果的关键因素[2-4]. 泛素特异性肽酶22(ubiquitin specific peptidase 22, USP22)参与肿瘤细胞周期相关基因的调控, 并与细胞增殖密切相关[5,6]. 本实验组在前期的实验中已证实胃癌组织中USP22蛋白高表达. 在此基础上, 本实验采用小干扰RNA(small interference RNA, siRNA)下调胃癌AGS细胞USP22基因的表达, 以观察其对胃癌增殖的影响.
胃癌AGS细胞(武汉协和医院腔镜实验室保存), 细胞培养基DMEM(HyClone), 胎牛血清(杭州四季青), Lipofectamine 2000(Invitrogen), Opti-MEMI培养基、青霉素、链霉素双抗(Gibco), TRIzol、逆转录试剂盒(TaKaRa), Fast SYBR Green Mast Mix(Applied Biosystems), USP22多克隆抗体(Abcam), 二抗(武汉博士德)、CCK8试剂、细胞周期检测试剂盒、ECL试剂盒、蛋白裂解液(碧云天), SDS-PAGE凝胶制备试剂盒(武汉谷歌生物), 阴性对照siRNA和USP22 siRNA(广州锐博生物公司).
1.2.1 细胞培养: 细胞培养使用含100 mL/L胎牛血清的DMEM培养基, 于37 ℃、50 mL/L CO2培养箱中. 48-72 h传代或换液.
1.2.2 USP22干扰片段的设计及合成: 通过Ambion网站设计针对USP22基因的特异性siRNA序列, 并由广州锐博公司合成. 序列为: siRNA-1, 5'-GGAGAAAGAUCACCUCGAATT-3'和3'-TTCCUCUUUCUAGUGGAGCUU-5'; siRNA-2, 5'-CUGCAAAGGUGAUGACAAUTT-3'和3'-TTGACGUUUCCACUACUGUUA-5'; siRNA-3', 5'-GAAGCAUAUUCACGAGCAUTT-3'和3'-TTCUUCGUAUAAGUGCUCGUA-5'. 同时设计阴性对照RNA, 序列为: 5'-GAGAAGACUACUCAAGCATT-3'和3'-TTCUCUUCUGAUGAGUUCGUA-5'.
1.2.3 细胞转染: 转染前1 d以2×105/孔接种6孔板, 待细胞铺满孔底约50%时, 参考广州锐博siRNA使用说明书转染, 转染时使用不含抗生素的Opti-MEMI培养基孵育siRNA片段和Lipofectamine 2000转染试剂, 每孔最终体积2 mL, 每孔siRNA浓度50 nmol/L, 转染6 h后换液. 实验分组: 空白对照组(control): 仅含有转染试剂; 阴性对照组(negative siRNA): 含转染试剂和不影响目的基因表达的干扰片段; 干预组(USP22 siRNAs): 含转染试剂和干扰片段.
1.2.4 实时定量PCR: 收集转染48 h后的细胞, TRIzol法提取细胞总RNA, 逆转录合成Cdna. 通过实时定量PCR扩增目的基因. 反应体系为20 μL, 其中Fast sybr green mix Ⅰ 10 μL, cDNA 2 μL, 上、下游引物各0.8 μL, ddH2O 6.4 μL. 反应条件为: 94 ℃预变性20 s, 94 ℃变性5 s, 60 ℃退火、延伸30 s, 反应40个循环. 采用2-ΔΔCt法分析目的基因mRNA的相对表达水平. 扩增基因的特异性引物由Invitrogen公司合成, 序列为: USP22(115 bp)5'-CTACCAGGAGTCCACAAAGCAG-3'和5'-CACATACGTGGTGATCTTCCGC-3'; GAPDH(131 bp), 5' -GTCTCCTCTGACTTCAACAGCG-3'和5'-ACCACCCTGTTGCTGTAGCCAA-3'.
1.2.5 Western blot: 转染细胞48 h后采用RIPA裂解液提取蛋白, 用BCA法进行蛋白定量. 配置10% SDS-PAGE分离胶10 mL: H2O 4 mL, 30%丙烯酰胺3.3 mL, 1.5 mol/L Tris-HCl(pH8.8)2.5 mL, 10% SDS 0.1 mL, AP 0.1 mL, TEMED 5 μL. 5% SDS-PAGE浓缩胶4.5 mL: H2O 3 mL, 30%丙烯酰胺0.75 mL, 1 mol/L Tris-HCl(pH6.8) 0.75 mL, 10% SDS 60 μL, AP 45 μL, TEMED 6 μL. 取等量蛋白30 μg上样于浓缩胶, 80 V电泳至样品基本进入分离胶后, 再改电压为100 V, 恒压电泳至电泳指示剂迁移至分离胶下游边缘时停止电泳. 200 mA电流转膜1 h后用含5%脱脂奶粉的TBST封闭2 h, 4 ℃孵育USP22、GAPDH抗体过夜, 用二抗IgG室温振荡孵育2 h后, TBST洗膜, ECL发光, AlphaEaseFC软件进行灰度扫描以分析相对蛋白表达值, 以GAPDH为内参对照.
1.2.6 流式细胞仪检测细胞周期: 转染48 h后, 用胰酶消化细胞, 培养基中和后离心细胞, 用PBS洗涤细胞1次, 加入700 mL/L乙醇1 mL固定过夜, 第2天离心除去酒精, 用含2 g/L PI的PBS 500 μL重悬, 避光孵育30 min后, 用流式细胞仪检测各细胞周期的分布情况.
1.2.7 CCK8检测细胞增殖: 将细胞以3×103/孔接种于96孔板, 每组设6个副孔, 待细胞铺满孔底50%时转染细胞, 每孔100 μL, siRNA浓度50 nmol/L, 转染48 h后每孔加入CCK8试剂10 μL, 于37 ℃培养箱中孵育2 h, 使用酶标仪选择450 nm波长测定吸光值, 计算细胞增殖率及增殖抑制率.
统计学处理 应用SPSS18.0进行统计学分析, 每组实验重复3次, 数据以mean±SD表示, 多组间比较采用单因素方差分析, 然后用SNK进行两两比较, P<0.05为差异有统计学意义.
转染3组USP22 siRNA片段后在mRNA水平和蛋白水平上能使USP22基因表达明显下调(P<0.05). 其中, 以转染USP22 siRNA3后效果最明显, mRNA和蛋白表达分别下降80.47%±2.99%和79.40%±3.58%. 而转染阴性对照组siRNA后mRNA和蛋白水平均无明显改变(P>0.05). 因此, 选择对USP22基因沉默效率最高的USP22 siRNA3组片段进行后续实验(图1, 2).
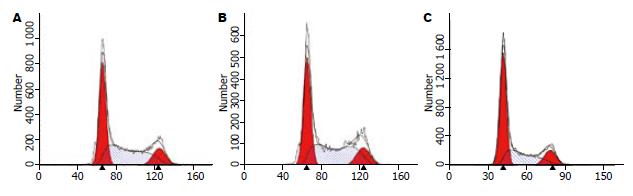
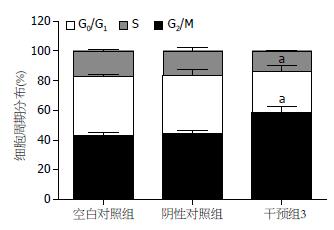
转染USP22 siRNA3之后, AGS细胞中G0/G1期细胞多于空白对照组(P<0.05), S期细胞少于空白对照组(P<0.05). 转染阴性对照siRNA组AGS细胞中G0/G1期及S期细胞与空白对照组相比无明显变化(P>0.05, 图3, 4, 表1).
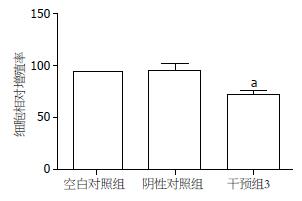
转染48 h后, USP22 siRNA3组细胞增殖抑制率为27.33%±3.49%, 与空白组差别有显著性意义(P<0.05). 阴性对照siRNA组细胞增殖抑制率为3.84%±6.64%, 与空白对照组差别无显著性意义(P>0.05, 图5).
去泛素化酶主要有两大类, 包括泛素羧基端水解酶(ubiquitin C-terminal hydrolases, UCH)和泛素特异性加工酶(ubiquitin-specific processing proteases, UBP或USP). 去泛素化酶调节细胞内的一系列生化反应, 包括细胞的生长分化, 肿瘤形成, 调控细胞周期, 转录激活和信号转导等[7-19]. USP22属于泛素特异性加工酶家族, 位于人类17号染色体, 编码蛋白产物60 000 Da, 通过去泛素化修饰达到调节细胞周期和促进肿瘤增殖的作用, 正常心脏和骨骼肌中USP22高表达, 肺和肝脏中低表达[20]. USP22在膀胱癌和结肠癌组织中表达高于癌旁正常组织, 而且随着肿瘤恶性程度的增加USP22表达增强, 此外, USP22与结肠癌肝转移和预后差相关[21,22]. 一项对P53表达缺失的肺癌H1299细胞的研究表明, 通过RNA干扰沉默USP22基因的表达后, 肺癌细胞增殖明显受到抑制[5]. 国内也有针对膀胱癌EJ细胞的相关研究, 得出了类似的结论[23]. 目前关于USP22基因在胃癌中的作用, 国内外尚未见报道. 由此我们通过针对USP22基因设计干扰片段, 以观察其表达下调对胃癌AGS细胞增殖的影响.
本组实验针对USP22基因设计合成小分子干扰片段, 3组干扰片段均能于作用48 h后在mRNA和蛋白水平下调USP22基因的表达. 其中, USP22 siRNA3组片段沉默效率最高, mRNA和蛋白水平USP22表达分别降低80.47%±2.99%和79.40%±3.58%. 沉默USP22基因后胃癌AGS细胞增殖明显受到抑制. 细胞周期分布中, G0/G1期细胞明显增多, S期细胞明显减少. 与空白对照组相比, USP22 siRNA3组细胞抑制率为27.33%±3.49%. 目前研究表明, SAGA(Spt-Ada-Gcn5 acetyltransferase)复合体通过参与翻译后水平组蛋白的修饰以调节一系列的细胞内进程, 其修饰方式包括: 乙酰化、甲基化、泛素化和磷酸化等[24-26]. 而USP22是SAGA复合体的一个亚基, 通过与SAGA其他亚基共同作用参与泛素化过程, 进而介导核受体的转录激活[6,27,28]. USP22通过介导组蛋白H2A和H2B去泛素化, 以调节组蛋白表达水平, 而组蛋白与转录激活, 遗传调节, 肿瘤进展相关[6,29-31]. 此外, USP22也是c-Myc介导的转录所必需的, 抑制其表达导致c-Myc激活转录效应降低, 进而抑制了肿瘤增长和细胞周期进行[5]. 因此, USP22可能通过调节组蛋白表达水平及促进c-Myc转录激活达到促进肿瘤增殖的作用, 其精确机制尚有待进一步研究.
总之, 本次实验针对USP22设计干扰片段, 降低了USP22基因的表达水平, 并通过进一步研究抑制了胃癌AGS细胞增殖, 阻滞了细胞周期, 为将USP22作为抑制胃癌增殖新的靶点, RNA干扰技术应用于胃癌研究提供了新的思路.
感谢吴轲、石亮及李伟同志在本实验中给予的大力帮助.
胃癌是最常见的消化系肿瘤, 虽然手术联合化疗不断取得改进, 但是预后仍不理想, 探索新的治疗方式有一定的意义. 泛素特异性肽酶22(USP22)参与肿瘤细胞周期相关基因的调控, 并与细胞增殖密切相关.
肖文华, 主任医师, 中国人民解放军总医院第一附属医院肿瘤科
分子靶向治疗是最近肿瘤分子生物学研究中的热点, 其中, 针对致癌基因的RNA干扰是近年肿瘤研究的热点领域, 寻找到合适的RNA干扰的靶点是目前亟待解决的问题.
Zhang等在肺癌的一项研究中证实, 通过RNA干扰沉默USP22基因的表达后, 肺癌细胞增殖明显受到抑制, 由此证实USP22基因表达确实在肿瘤的增殖中起到一定的作用. Liu等在结肠癌的研究中证实USP22高表达与预后较差, 与肝转移相关.
本文首次探索了抑制USP22基因表达对胃癌细胞增殖的抑制作用, 通过干预胃癌细胞增殖周期的进展, 抑制了胃癌细胞的增殖.
USP22基因促进胃癌细胞的增殖, 为胃癌分子靶向治疗提供了一个新的靶点. 针对USP22基因设计RNA干扰, 抑制肿瘤增殖, 为改善胃癌患者预后提供了一定的理论基础.
本文设计合理, 结果可信, 有一定的临床参考价值.
编辑: 曹丽鸥 电编:何基才
| 1. | Shah MA, Kelsen DP. Gastric cancer: a primer on the epidemiology and biology of the disease and an overview of the medical management of advanced disease. J Natl Compr Canc Netw. 2010;8:437-447. [PubMed] |
| 3. | Wu WK, Lee CW, Cho CH, Chan FK, Yu J, Sung JJ. RNA interference targeting raptor inhibits proliferation of gastric cancer cells. Exp Cell Res. 2011;317:1353-1358. [PubMed] [DOI] |
| 4. | De Vita F, Giuliani F, Silvestris N, Catalano G, Ciardiello F, Orditura M. Human epidermal growth factor receptor 2 (HER2) in gastric cancer: a new therapeutic target. Cancer Treat Rev. 2010;36 Suppl 3:S11-S15. [PubMed] [DOI] |
| 5. | Zhang XY, Varthi M, Sykes SM, Phillips C, Warzecha C, Zhu W, Wyce A, Thorne AW, Berger SL, McMahon SB. The putative cancer stem cell marker USP22 is a subunit of the human SAGA complex required for activated transcription and cell-cycle progression. Mol Cell. 2008;29:102-111. [PubMed] [DOI] |
| 6. | Zhang XY, Pfeiffer HK, Thorne AW, McMahon SB. USP22, an hSAGA subunit and potential cancer stem cell marker, reverses the polycomb-catalyzed ubiquitylation of histone H2A. Cell Cycle. 2008;7:1522-1524. [PubMed] [DOI] |
| 7. | Ramakrishna S, Suresh B, Baek KH. The role of deubiquitinating enzymes in apoptosis. Cell Mol Life Sci. 2011;68:15-26. [PubMed] [DOI] |
| 8. | Grillari J, Grillari-Voglauer R, Jansen-Dürr P. Post-translational modification of cellular proteins by ubiquitin and ubiquitin-like molecules: role in cellular senescence and aging. Adv Exp Med Biol. 2010;694:172-196. [PubMed] [DOI] |
| 9. | Kimura Y, Tanaka K. Regulatory mechanisms involved in the control of ubiquitin homeostasis. J Biochem. 2010;147:793-798. [PubMed] [DOI] |
| 10. | Fang Y, Fu D, Shen XZ. The potential role of ubiquitin c-terminal hydrolases in oncogenesis. Biochim Biophys Acta. 2010;1806:1-6. [PubMed] |
| 11. | Bardag-Gorce F. Effects of ethanol on the proteasome interacting proteins. World J Gastroenterol. 2010;16:1349-1357. [PubMed] [DOI] |
| 12. | Tsukamoto S, Yokosawa H. Inhibition of the ubiquitin-proteasome system by natural products for cancer therapy. Planta Med. 2010;76:1064-1074. [PubMed] [DOI] |
| 13. | Shabek N, Ciechanover A. Degradation of ubiquitin: the fate of the cellular reaper. Cell Cycle. 2010;9:523-530. [PubMed] [DOI] |
| 14. | Katz EJ, Isasa M, Crosas B. A new map to understand deubiquitination. Biochem Soc Trans. 2010;38:21-28. [PubMed] [DOI] |
| 15. | Fujita K, Srinivasula SM. Ubiquitination and TNFR1 signaling. Results Probl Cell Differ. 2009;49:87-114. [PubMed] [DOI] |
| 16. | Finley D. Recognition and processing of ubiquitin-protein conjugates by the proteasome. Annu Rev Biochem. 2009;78:477-513. [PubMed] [DOI] |
| 17. | Reyes-Turcu FE, Ventii KH, Wilkinson KD. Regulation and cellular roles of ubiquitin-specific deubiquitinating enzymes. Annu Rev Biochem. 2009;78:363-397. [PubMed] [DOI] |
| 18. | Hussain S, Zhang Y, Galardy PJ. DUBs and cancer: the role of deubiquitinating enzymes as oncogenes, non-oncogenes and tumor suppressors. Cell Cycle. 2009;8:1688-1697. [PubMed] [DOI] |
| 19. | Nijman SM, Luna-Vargas MP, Velds A, Brummelkamp TR, Dirac AM, Sixma TK, Bernards R. A genomic and functional inventory of deubiquitinating enzymes. Cell. 2005;123:773-786. [PubMed] [DOI] |
| 20. | Lee HJ, Kim MS, Shin JM, Park TJ, Chung HM, Baek KH. The expression patterns of deubiquitinating enzymes, USP22 and Usp22. Gene Expr Patterns. 2006;6:277-284. [PubMed] [DOI] |
| 21. | 骆 杨, 曾 甫清, 顾 朝辉, 汪 良, 王 智宇, 蒋 国松, 肖 行远. 膀胱移行细胞癌中候选肿瘤干细胞标记物USP22 mRNA水平定量分析及其与肿瘤分级的关系. 临床泌尿外科杂志. 2009;24:140-144. |
| 22. | Liu YL, Yang YM, Xu H, Dong XS. Aberrant expression of USP22 is associated with liver metastasis and poor prognosis of colorectal cancer. J Surg Oncol. 2011;103:283-289. [PubMed] [DOI] |
| 24. | Baker SP, Grant PA. The SAGA continues: expanding the cellular role of a transcriptional co-activator complex. Oncogene. 2007;26:5329-5340. [PubMed] [DOI] |
| 25. | Rodríguez-Navarro S. Insights into SAGA function during gene expression. EMBO Rep. 2009;10:843-850. [PubMed] [DOI] |
| 26. | Bhaumik SR. Distinct regulatory mechanisms of eukaryotic transcriptional activation by SAGA and TFIID. Biochim Biophys Acta. 2011;1809:97-108. [PubMed] |
| 27. | Pijnappel WW, Timmers HT. Dubbing SAGA unveils new epigenetic crosstalk. Mol Cell. 2008;29:152-154. [PubMed] [DOI] |
| 28. | Atanassov BS, Evrard YA, Multani AS, Zhang Z, Tora L, Devys D, Chang S, Dent SY. Gcn5 and SAGA regulate shelterin protein turnover and telomere maintenance. Mol Cell. 2009;35:352-364. [PubMed] [DOI] |
| 29. | Zhao Y, Lang G, Ito S, Bonnet J, Metzger E, Sawatsubashi S, Suzuki E, Le Guezennec X, Stunnenberg HG, Krasnov A. A TFTC/STAGA module mediates histone H2A and H2B deubiquitination, coactivates nuclear receptors, and counteracts heterochromatin silencing. Mol Cell. 2008;29:92-101. [PubMed] [DOI] |
| 30. | Frappier L, Verrijzer CP. Gene expression control by protein deubiquitinases. Curr Opin Genet Dev. 2011;21:207-213. [PubMed] [DOI] |