修回日期: 2011-05-28
接受日期: 2011-06-15
在线出版日期: 2011-06-28
目的: 研究结直肠癌组织中基质细胞衍生因子(SDF-1)及其受体(CXCR4)的表达与结直肠癌生物学行为以及与核增殖抗原(PCNA)间的关系, 以探讨SDF-1/CXCR4的表达以及PCNA在结直肠癌侵袭、转移中的生物学意义.
方法: 在结直肠癌组织芯片上, 应用免疫组织化学Envision法检测SDF-1/CXCR4和PCNA的表达水平, 分析SDF-1、CXCR4和PCNA在结直肠癌的表达与患者淋巴结转移状态、肿瘤分化程度的关系及其相互关系.
结果: SDF-1的阳性表达率为60.2%(77/128), CXCR4的阳性表达率为43.8%(56/128). 结直肠癌组织SDF-1及CXCR4的阳性表达率均高于癌旁正常黏膜组织(P<0.01). PCNA的阳性表达率为44.5%(57/128). SDF-1/CXCR4和PCNA与患者淋巴结转移状态、肿瘤分化程度相关(均P<0.05), SDF-1/CXCR4与PCNA之间呈正相关(r = 0.084, P = 0.005; r = 0.087, P = 0.030).
结论: 同时检测结直肠癌组织中的SDF-1/CXCR4和PCNA的表达对判断肿瘤的恶性程度和估计预后有一定意义.
引文著录: 郭云娣, 李小宁, 李明, 何影娟. SDF-1及其受体CXCR4在结直肠癌组织中的表达及与PCNA的关系. 世界华人消化杂志 2011; 19(18): 1959-1962
Revised: May 28, 2011
Accepted: June 15, 2011
Published online: June 28, 2011
AIM: To investigate the correlations of the expression of stromal cell derived factor-1 (SDF-1), CXC chemokine receptor 4 (CXCR4), and proliferating cell nuclear antigen (PCNA) with the clinicobiological parameters of human colorectal carcinoma.
METHODS: The expression of SDF-1/CXCR4 and PCNA proteins in human colorectal carcinoma was measured by immunohistochemistry on tissue microarrays. The relationship of expression of SDF-1/CXCR4 and PCNA proteins with the clinicobiological parameters of human colorectal carcinoma was analyzed.
RESULTS: The positive rates of SDF-1 and CXCR4 expression were significantly higher in colorectal carcinoma than in tumor-adjacent tissue (both P < 0.01). The expression of SDF-1/CXCR4 and PCNA was significantly correlated with lymph node metastasis and tumor differentiation in colorectal carcinoma. The expression of SDF-1/CXCR4 was positively correlated with that of PCNA in colorectal carcinoma (r = 0.084, 0.087; P = 0.005, 0.030).
CONCLUSION: SDF-1/CXCR4 and PCNA may be useful parameters for evaluation of metastasis and prognosis in patients with colorectal carcinoma.
- Citation: Guo YD, Li XN, Li M, He YJ. Expression of stromal cell derived factor-1, CXC chemokine receptor 4 and PCNA proteins in human colorectal carcinoma. Shijie Huaren Xiaohua Zazhi 2011; 19(18): 1959-1962
- URL: https://www.wjgnet.com/1009-3079/full/v19/i18/1959.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i18.1959
结直肠癌的浸润和转移是影响患者生存率和病死率的重要因素, 对结直肠癌浸润、转移相关指标的研究在预测肿瘤预后和指导临床治疗方面具有重要意义. 近年来研究表明[1-3], 基质细胞衍生因子1(stromal cell derived factor-1, SDF-1)及其受体(CXC chemokine receptor 4, CXCR4)在肿瘤中过表达与多种肿瘤的侵袭转移有关. 我们利用组织芯片的优势, 通过检测结直肠癌组织中SDF-1、CXCR4和核增殖抗原(proliferating cell nuclear antigen, PCNA)的表达, 分析了其与结直肠癌相关临床病理指标, 尤其是淋巴结转移之间的关系.
收集选用结直肠癌组织128例, 为苏州市立医院及苏州九龙医院病理科2006-2009年的存档蜡块, 均为住院患者, 有详细的临床资料, 年龄25-89(中位年龄62.5)岁; 其中高中分化114例, 低分化14例; 取同期患者肠癌旁7 cm正常黏膜组织30例为对照组织. 全部患者术前均未接受放疗或化疗, 所有标本均经两位病理专家进行组织病理证实.
1.2.1 动组织芯片制备: 将组织标本经4%甲醛固定、常规石蜡包埋制片, HE染色后, 在显微镜下定位、对应找出石蜡块上标记的肿瘤组织, 自制成10×14组织阵列(每一标本取2块组织芯, 其直径1.6 mm)蜡块2块. 正常组织取自手术残端(选取距肿瘤7 cm以上的肠组织)共30例, 并做成一个独立的组织芯片.
1.2.2 Envision免疫组织化学法: 兔抗人SDF-1多克隆抗体购自美国Santa Cruz公司, 稀释度1:75; 兔抗人CXCR4多克隆抗体购自美国R&D公司, 稀释度1:75; PCNA(工作液)及二抗购自福州迈新公司. 常规石蜡包埋, 4 μm厚连续切片. 采用Envision免疫组织化学法, 实验中以PBS液代替一抗作为阴性对照; 以试剂公司提供的阳性对照片作为阳性对照.
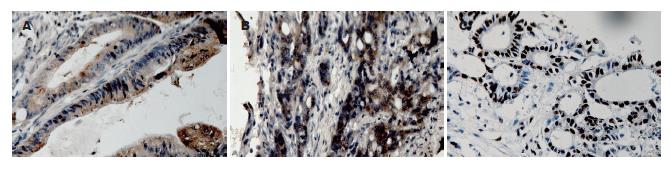
1.2.3 结果判定: SDF-1和CXCR4阳性表达于肿瘤细胞质, 呈黄褐色细颗粒状. 光学显微镜下在低倍镜(40×)下观察其表达较强的区域, 高倍镜(200×)观察3个视野, 计数阳性细胞所占的百分比. 参考文献[4], 阳性细胞超过肿瘤细胞数的10%定义为阳性, 否则为阴性. PCND阳性表达于肿瘤细胞核, 呈黄褐色细颗粒状, 整张切片未见阳性染色细胞为0级(-); 癌细胞核着色细胞25%以下, 为1级; 25%-50%为2级; 50%以上3级, 1-3级为(+).
统计学处理 应用SPSS13.0统计分析软件进行分析. 采用χ2检验分析免疫组织化学结果; 采用Spearman秩相关分析指标之间的相关性, P≤0.05被认为差异有显著性.
30例正常结直肠黏膜组织中表达SDF-1和CXCR4的仅各有1例, 且染色强度较肿瘤细胞的染色弱; SDF-1在结直肠癌中的阳性表达率为60.2%(77/128)(图1A); CXCR4在结直肠癌中的阳性表达为43.8%(56/128)(图1B). 结直肠癌和正常肠黏膜组织中SDF-1和CXCR4的阳性表达情况间差异均有统计学意义(P<0.01).
PCNA在128例结直肠癌中的阳性表达率为44.5%(57/128)(图1C).
在128例结直肠癌中, SDF-1、CXCR4的表达与患者年龄、性别、肿瘤浸润深度无关, 但与肿瘤分化程度、淋巴结转移相关(P<0.05); PCNA的表达与患者年龄、性别无关, 但与分化程度、淋巴结转移、肿瘤浸润深度相关(P<0.05, 表1).
| 临床病理参数 | n | SDF-1阳性 | CXCR4阳性 | PCNA阳性 | ||||||
| % | χ2值 | P值 | % | χ2值 | P值 | % | χ2值 | P值 | ||
| 年龄(岁) | ||||||||||
| <60 | 50 | 58.0 | 44.0 | 42.0 | ||||||
| ≥60 | 78 | 61.5 | 0.046 | 0.830 | 30.8 | 0.034 | 0.854 | 46.2 | 0.034 | 0.645 |
| 性别 | ||||||||||
| 男 | 74 | 66.2 | 45.9 | 41.9 | ||||||
| 女 | 54 | 51.9 | 2.318 | 0.091 | 40.7 | 0.247 | 0.619 | 48.1 | 0.641 | 0.423 |
| 分化程度 | ||||||||||
| 高、中分化 | 114 | 55.3 | 40.4 | 40.4 | ||||||
| 低分化 | 14 | 12.3 | 10.411 | 0.001 | 71.4 | 4.894 | 0.027 | 78.6 | 7.374 | 0.007 |
| 淋巴结转移 | ||||||||||
| 无 | 72 | 44.4 | 30.1 | 33.3 | ||||||
| 有 | 56 | 80.4 | 16.950 | 0.000 | 60.7 | 11.642 | 0.001 | 58.9 | 8.354 | 0.004 |
| 浸润深度 | ||||||||||
| 未达浆膜 | 20 | 65.0 | 45.0 | 15.0 | ||||||
| 浆膜及外 | 108 | 59.2 | 0.232 | 0.630 | 43.5 | 0.015 | 0.902 | 50.0 | 8.369 | 0.004 |
Spearman等级相关分析结果显示, SDF-1和CXCR4在结直肠癌中的表达呈正相关(r = 0.060, P = 0.000); SDF-1和PCNA在结直肠癌中的表达呈正相关(r = 0.084, P = 0.005); CXCR4和PCNA在结直肠癌中的表达亦呈正相关(r = 0.087, P = 0.030).
近年研究表明, 肿瘤细胞可以表达某些趋化因子(chemokines)或趋化因子受体, 并且趋化因子及其受体可能参与肿瘤细胞的发生、发展与侵袭转移过程[5-8]. SDF-1/CXCR4相互作用构成一个细胞信息传递的生物学轴(biological),决定着肿瘤细胞的生长与转移过程[9]. 目前, 肺癌、卵巢癌、乳腺癌、胃癌、白血病等众多肿瘤细胞中均发现有SDF-1/CXCR4的高表达, 并且CXCR4已成为肿瘤诊断与治疗的新靶点, 越来越多受到人们的重视[10-13]. 已有研究表明, SDF-1/CXCR4生物学轴不仅对肿瘤细胞的转移起关键作用[9], 而且与肿瘤细胞的生长也有着密切的联系[3]. 我们以128例结直肠癌和30例正常肠黏膜为研究对象, 在组织芯片上用免疫组化方法检测SDF-1/CXCR4与细胞增殖相关蛋白PCNA的变化, 以阐明SDF-1/CXCR4生物学轴对结直肠癌浸润、转移及与细胞增殖的影响. 结果显示, 在结直肠癌中SDF-1/CXCR4表达高于正常黏膜组织, 且二者显著正相关(P = 0.000), 提示, SDF-1/CXCR4轴可能在结直肠癌的形成和发展过程中起一定的作用. 我们的结果与文献报道相一致[14,15]. 进一步分析, 本组实验显示, SDF-1/CXCR4的表达与结直肠癌分化程度、淋巴结转移状况密切相关, 进一步提示SDF-1/ CXCR4轴极有可能与结直肠癌侵袭和转移有关.
具有高增殖性是肿瘤细胞的生物学特征之一, 本组实验中, PCNA的表达与肿瘤细胞分化程度、浸润深度、淋巴结转移相关, 而SDF-1/CXCR4的表达与PCNA亦呈正相关, 表明, SDF-1/CXCR4轴不但介导了结直肠癌的分化程度及转移, 而且有可能调控着结直肠癌的生长与增殖.
总之, 本研究结果提示了SDF-1/CXCR4轴在人结直肠组织中功能性的高表达, 并且与肿瘤的分化程度、淋巴结转移及PCNA密切相关, SDF-1/CXCR4可能在结直肠癌发生、侵袭转移和肿瘤的增殖中发挥着重要作用. 同时检测人结直肠癌组织中SDF-1/CXCR4以及核增殖指数PCNA的表达, 对判断肿瘤的恶性程度和估计预后具有一定的指导意义.
近年来, 结直肠癌的发病率和死亡率有上升趋势, 对结直肠癌的预防和治疗研究亟待进一步深入. 目前研究显示, 干预趋化因子/受体轴将影响实体肿瘤的生长和转移.
刘宝林, 教授, 中国医科大学附属盛京医院普通外科
Yoshitake等通过免疫组织化学和免疫染色检测60例原发结直肠癌标本和27例相关淋巴结SDF-1和CXCR4表达,结果发现SDF-1和CXCR4的表达与淋巴结转移、肿瘤分期和结直肠癌患者的生存率密切相关.
本文首次采用组织芯片技术, 用免疫组织化学法检测了结直肠癌中SDF-1/CXCR4和PCNA的表达情况.
同时检测结直肠癌组织中的SDF-1/CXCR4和PCNA的表达对判断肿瘤的恶性程度和估计预后有一定意义.
本文设计合理, 研究手段科学, 统计分析可信, 对结直肠癌的增殖及表达研究对临床有一定指导意义.
编辑: 李薇 电编:何基才
| 1. | Ishikawa T, Nakashiro K, Klosek SK, Goda H, Hara S, Uchida D, Hamakawa H. Hypoxia enhances CXCR4 expression by activating HIF-1 in oral squamous cell carcinoma. Oncol Rep. 2009;21:707-712. [PubMed] |
| 2. | Wu Y, Jin M, Xu H, Shimin Z, He S, Wang L, Zhang Y. Clinicopathologic significance of HIF-1α, CXCR4, and VEGF expression in colon cancer. Clin Dev Immunol. 2010;2010. pii:537531. [PubMed] |
| 3. | Ottaiano A, Franco R, Aiello Talamanca A, Liguori G, Tatangelo F, Delrio P, Nasti G, Barletta E, Facchini G, Daniele B. Overexpression of both CXC chemokine receptor 4 and vascular endothelial growth factor proteins predicts early distant relapse in stage II-III colorectal cancer patients. Clin Cancer Res. 2006;12:2795-2803. [PubMed] [DOI] |
| 4. | Takanami I. Overexpression of CCR7 mRNA in nonsmall cell lung cancer: correlation with lymph node metastasis. Int J Cancer. 2003;105:186-189. [PubMed] [DOI] |
| 6. | Wang J, Shiozawa Y, Wang J, Wang Y, Jung Y, Pienta KJ, Mehra R, Loberg R, Taichman RS. The role of CXCR7/RDC1 as a chemokine receptor for CXCL12/SDF-1 in prostate cancer. J Biol Chem. 2008;283:4283-4294. [PubMed] [DOI] |
| 7. | Vandercappellen J, Van Damme J, Struyf S. The role of CXC chemokines and their receptors in cancer. Cancer Lett. 2008;267:226-244. [PubMed] [DOI] |
| 9. | Müller A, Homey B, Soto H, Ge N, Catron D, Buchanan ME, McClanahan T, Murphy E, Yuan W, Wagner SN. Involvement of chemokine receptors in breast cancer metastasis. Nature. 2001;410:50-56. [PubMed] [DOI] |
| 10. | De Clercq E. Potential clinical applications of the CXCR4 antagonist bicyclam AMD3100. Mini Rev Med Chem. 2005;5:805-824. [PubMed] [DOI] |
| 15. | Yoshitake N, Fukui H, Yamagishi H, Sekikawa A, Fujii S, Tomita S, Ichikawa K, Imura J, Hiraishi H, Fujimori T. Expression of SDF-1 alpha and nuclear CXCR4 predicts lymph node metastasis in colorectal cancer. Br J Cancer. 2008;98:1682-1689. [PubMed] [DOI] |