修回日期: 2011-05-26
接受日期: 2011-06-02
在线出版日期: 2011-06-28
目的: 探讨DNA甲基转移酶1(DNMT1)和DNA甲基转移酶3A(DNMT3A)在结直肠正常组织、腺瘤、腺癌中的表达, 及其可能的临床病理意义.
方法: 以免疫组织化学SP法检测DNMT1和DNMT3A在正常结直肠组织、腺瘤、腺癌中的表达. 通过计算染色指数(SI), 评估两者的表达水平与年龄、肿瘤大小、分期、分化等临床病理特征之间的关系. 采用Kaplan-Meier法进行生存分析.
结果: DNMT3A在正常组织和腺瘤中表达明显低于癌组织(SI: 10.5±5.7 vs 20.2±9.9, P<0.05). DNMT1在三者中的表达呈递增趋势, SI分别为10.3±2.7、14.7±6.8、20.1±9.1. 淋巴结转移病例DNMT1表达高于未转移病例(18.1±7.9 vs 12.0±6.3, P<0.05), 浸润深度超过肌层病例DNMT1和DNMT3A表达高于未超过肌层病例, 差异均有统计学意义(20.1±10.1 vs 15.8±7.9; 19.9±8.5 vs 15.4±4.7, 均P<0.05).
结论: DNMT1和DNMT3A是结直肠癌发生的早期事件, 两者共同促进结直肠癌的发生发展, 可能成为结直肠癌治疗的新靶点.
引文著录: 刘铁权, 孙明军, 魏敏杰. DNA甲基转移酶1和3A在结直肠癌组织中的表达及其与临床病理的关系. 世界华人消化杂志 2011; 19(18): 1954-1958
Revised: May 26, 2011
Accepted: June 2, 2011
Published online: June 28, 2011
AIM: To detect the expression of DNA methyltransferase 1 (DNMT1) and DNA methyltransferase 3A (DNMT3A) in colorectal adenoma and carcinoma and to explore their clinicopathological significance.
METHODS: The expression of DNMT1 and DNMT3A in normal colorectal tissue, colorectal adenoma and carcinoma tissue was determined by immunohistochemistry. Immunoreactivity was semiquantitatively evaluated based on a staining index (SI). The correlation between the expression of these epigenetic biomarkers and various clinicopathological factors, including age, tumor size and stage, were analyzed and survival curves were calculated using the Kaplan-Meier method and log-rank tests.
RESULTS: The SI of DNMT1 in normal colorectal tissue, colorectal adenoma and carcinoma was 10.3 ± 2.7, 14.7 ± 6.8, and 20.1 ± 9.1, respectively, showing an upward trend. The expression of DNMT1 was significantly higher in cases with lymph node metastasis than in those without lymph node metastasis (18.1 ± 7.9 vs 12.0 ± 6.3, P < 0.05).
CONCLUSION: Up-regulation of DNMT1 and DNMT3A play a significant role in the occurrence and progression of colorectal carcinoma.
- Citation: Liu TQ, Sun MJ, Wei MJ. Clinicopathological significance of expression of DNA methyltransferases 1 and 3A in colorectal adenoma and carcinoma. Shijie Huaren Xiaohua Zazhi 2011; 19(18): 1954-1958
- URL: https://www.wjgnet.com/1009-3079/full/v19/i18/1954.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i18.1954
结直肠癌是最常见的恶性肿瘤. 世界范围内近20年结直肠癌发病呈现上升趋势[1], 我国每年大约有14万例新发病例, 且发病率城市人口显著高于乡村人口, 严重威胁着人民的生命与健康, 造成大量的医疗消耗. 近十几年的研究表明, 结直肠从正常黏膜到腺瘤, 再发展为进展期结直肠癌, 为一多基因参与、多步骤、多阶段的发生过程, 存在有各种内外因素交互作用导致的癌基因激活及抑癌基因失活等分子事件[2]. 但是, 并非暴露于危险因素的所有个体均患结直肠癌, 说明个体之间存在遗传易感性的差异, 除环境因素外, 一定的遗传背景在这些肿瘤的发生中也起重要作用. 近年研究认为表观遗传修饰通过调控肿瘤相关基因的表达, 在结直肠癌的发生和发展过程中起重要作用. 表观遗传修饰主要包括DNA甲基化修饰、组蛋白的乙酰化和去乙酰修饰、染色质重塑、非编码RNA调控等[3]. DNA甲基化是调节癌基因和抑癌基因表达的重要机制. 而DNA甲基转移酶(DNA methyltransferases, DNMTs)具有调控DNA甲基化的作用, 因此, 对DNA甲基转移酶的研究将为结直肠癌的早期诊断、治疗和预后提供新的思路.
收集中国医科大学附属第一医院结直肠癌手术标本共94例, 同时选取结直肠癌远端经病理证实的正常黏膜50例, 以及经肠镜电切的结直肠腺瘤36例. 所有结直肠癌患者均为第1次手术, 且术前未经放疗、化疗, 术后病理均为腺癌. 其中男54例, 女40例. 年龄36-76岁. 组织分化程度: 高分化35例、中分化30例、低分化29例. 伴淋巴结转移39例, 无淋巴结转移55例. 所有患者随访均满5年, 其中5例失访.
1.2.1 免疫组织化学染色: DNMT1, DNMT3A均购自Santa Cruz生物技术有限公司, 通用型二抗及DAB显色液购自福州迈新生物技术公司. 进行常规免疫组织化学SP法染色. 采用微波修复10 min, DNMT1按照1:100稀释, DNMT3A按1:200稀释, 二抗1:200稀释. 以PBS代替一抗作为阴性对照.
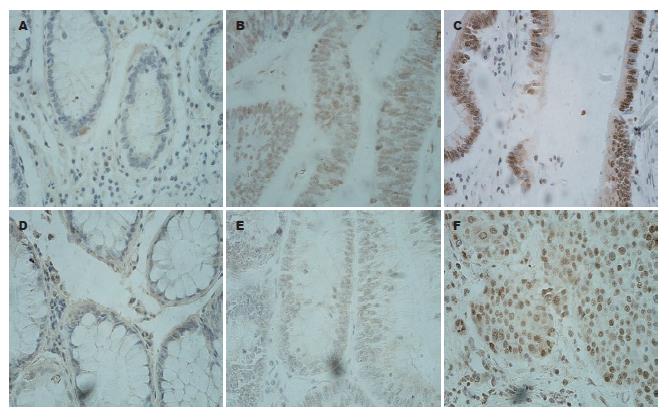
1.2.2 结果判定: DNMT1与DNMT3A均为细胞核阳性表达, 染色为棕黄色颗粒状, 胞质、胞膜均不着色或着色很少. 根据多数细胞的染色状况判定染色结果. 根据细胞核染色强度, 分别记为0, 1, 2, 4, 6分. 根据阳性染色细胞比例评分, 记为1-6分. 以染色强度评分与细胞比例评分的乘积作为染色指数(SI)[3-5].
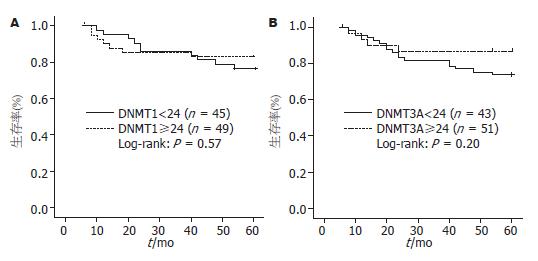
统计学处理 采用SPSS13.0统计软件, 所得数据以mean±SD表示, 各组之间的DNMT染色指数采用t检验或ANOVA方差分析; 以SI的平均值为界限(DNMT1和DNMT3A的SI平均值均为24), 将患者分为两组, 采用Kaplan-Meier法分析DNMT1和DNMT3A表达与生存率的关系, Log-rank检验, P<0.05有统计学意义.
DNMT1表达可见于正常组织, 腺瘤及腺癌组织中, 主要定位于细胞核中, 细胞质中着色很少(图1). 在正常组织中的表达较少(图1A, B); 而在腺瘤和癌组织中的表达逐渐增加(图1C), 三者的SI分别为10.3±2.7, 14.7±6.8, 20.1±9.1, 呈逐渐递增的趋势(P<0.05). DNMT3A表达与DNMT1类似, 可见于正常组织, 腺瘤及癌组织中, 主要定位于细胞核中, 细胞质中着色很少(图1). 在正常组织及腺瘤中表达较少(图1D, 1E); 而在癌组织中的表达明显增加(图1F). 三者的SI分别为10.5±5.7, 11.1±6.0, 20.2±9.9. 癌组织中的表达明显高于正常组织及腺瘤(P<0.01), 但腺瘤和正常组织中的表达没有统计学意义(P>0.05).
在肿瘤浸润不超过肌层的结直肠癌病例中, DNMT1和DNMT3A的表达均低于浸润超过肌层的病例(15.8±7.9 vs 20.1±10.1; 15.4±4.7 vs 19.9±8.5, 均P = 0.04), 差异有统计学意义(P<0.05); 淋巴结转移病例中DNMT1的表达明显高于无淋巴结转移组(18.1±7.9 vs 12.0±6.3, P<0.05); DNMT1和DNMT3A的表达与结直肠癌的其他临床病理特征间, 包括性别、年龄、肿瘤的分化程度、浸润深度以及临床分期间差别均没有统计学意义(表1).
| 临床病理参数 | n | DNMT3A | P值 | DNMT1 | P值 |
| 性别 | |||||
| 男 | 54 | 21.4±10.2 | 20.2±8.1 | ||
| 女 | 40 | 18.9±9.4 | 0.27 | 18.3±8.0 | 0.23 |
| 年龄(岁) | |||||
| ≤60 | 46 | 21.6±10.2 | 19.6±9.0 | ||
| >60 | 48 | 18.9±9.4 | 0.27 | 18.6±7.3 | 0.57 |
| 肿瘤大小(cm) | |||||
| <5 | 43 | 21.9±9.8 | 19.0±8.8 | ||
| ≥5 | 51 | 19.5±9.9 | 0.28 | 19.4±7.8 | 0.20 |
| 分化程度 | |||||
| 高分化 | 35 | 18.1±8.5 | 19.3±7.7 | ||
| 中分化 | 30 | 21.4±10.6 | 17.9±7.6 | ||
| 低分化 | 29 | 21.3±10.3 | 0.35 | 20.3±9.3 | 0.52 |
| 淋巴结转移 | |||||
| 阴性 | 55 | 20.8±9.9 | 12.0±6.3 | ||
| 阳性 | 39 | 19.4±10.1 | 0.54 | 18.1±7.9 | 0.05 |
| 浸润深度 | |||||
| M、SM、MP | 16 | 15.8±7.9 | 15.4±4.7 | ||
| SS、SE、SI | 78 | 20.1±10.1 | 0.04 | 19.9±8.5 | 0.04 |
| TNM分期 | |||||
| Ⅰ | 18 | 18.8±9.4 | 17.5±6.3 | ||
| Ⅱ | 28 | 20.6±10.0 | 20.6±8.8 | ||
| Ⅲ | 44 | 18.6±9.8 | 18.7±8.1 | ||
| Ⅳ | 4 | 27.0±6.0 | 0.38 | 24.0±9.8 | 0.34 |
对患者5年的随访, 分别以DNMT1和DNMT3A的SI平均值为界限, 将患者分为两组. 分析结果显示, DNMT1和DNMT3A高表达组与低表达组生存率几乎相同(图2).
DNA甲基化是目前最重要、也是研究得最清楚的表观遗传修饰形式之一. 真核细胞中唯一的甲基化形式是以S-腺苷甲硫氨酸作为活性甲基供体, 并在DNMTs的催化下, CpG二核苷酸中的胞嘧啶环上C-5位置的氢被活性甲基所取代, 从而转变成5-甲基胞嘧啶(5-mC)[6]. 通过这种甲基化形式, 细胞可以不改变DNA的碱基序列, 而调控基因在不同组织和细胞的表达. 真核生物中存在的甲基转移酶主要包括DNMT1、DNMT3A和DNMT3B. 其中DNMT1起维持甲基化的作用, 在模板链的指导下他能使半甲基化的DNA双链分子上与甲基胞嘧啶相对应的胞嘧啶甲基化[7]; DNMT3A和DNMT3B能在未发生甲基化的DNA双链上进行甲基化修饰[8], 并且不需要模板链的指导. 正常发育的胚胎过程中, 包括基因印迹、X-染色体失活、细胞分化等是需要通过DNMTs蛋白的正确表达, 来引起和维持特定基因的甲基化模式. 如DNMT1基因纯合突变的小鼠胚胎会出现发育异常或死亡[9]. 异常的DNA甲基化则会引发疾病甚至肿瘤的发生, 异常CpG的重新甲基化通常被认为是人类癌症发生的一个早期特征. 一般认为DNA甲基化通过两种途径抑制基因表达, 一是直接阻碍转录因子与甲基化的CPG岛结合, 直接抑制基因表达; 二是通过招募DNA甲基结合蛋白及一些阻碍复合物, 组织转录因子与特定的DNA序列结合, 间接抑制基因表达[10].
结直肠腺瘤是一种目前最重要的癌前病变, 约80%的腺癌由腺瘤发展而来. 随着结直肠镜技术的广泛开展, 其检出率逐渐增加. 内镜下摘除腺瘤降低了结直肠腺癌的发病风险[11]. 我们研究了正常组织、腺瘤组织及癌组织中DNMTs的表达, 显示DNMT1在正常组织腺瘤及癌组织中的表达呈现递增趋势, 差异有统计学意义; DNMT3A在结直肠癌中的表达也明显高于正常黏膜和腺瘤. 腺瘤恶变为腺癌的过程, 是多基因协同作用的结果, 有多个抑癌基因发生沉默或变异, 导致其产物表达减少. 已有研究证实散发性结直肠癌患者肿瘤相关基因启动子区存在不同程度的高甲基化状态, 如APC、P16、hHML1等[12]. Zhao等[13]研究证实P16在正常组织、腺瘤组织、癌组织中的表达存在显著差异, 呈现逐渐减少的现象. Herman等[14]对结直肠癌及正常黏膜组织的p16基因甲基化进行检测, 发现结直肠癌中p16基因存在明显的甲基化, 从而使P16蛋白表达障碍; 在小鼠中使用5ADC抑制DNMT1的活性, 可以减少98%的腺瘤发生[15]. 我们的实验结果在蛋白水平上证实了DNMTs在肿瘤发病中的重要作用: DNMT活性的增加可以使DNA发生异常的甲基化, 导致基因活性改变和染色体不稳定, 从而使细胞周期失控, 发生癌变.
肿瘤浸润转移是多因素参与、多步骤完成的生物化学变化过程. 人们已经逐渐认识到浸润转移不仅与肿瘤细胞有关, 更是肿瘤细胞和肿瘤组织微环境复杂的相互作用的结果, 其过程涉及多个分子作用机制和信号转导途径, 包括细胞和细胞的黏附分子、细胞外基质降解、生长因子、趋化因子和淋巴血管生成因子等. 在肿瘤进展过程中, 相关细胞因子基因的甲基化减少了细胞因子的表达, 促进肿瘤细胞的转移, 包括上皮钙粘连素(E-cadherin)、组织金属蛋白酶抑制因子-3(tissue inhibitor of metal protease, TIMP3). Rhee等[16]证实DNMT1和DNMT3B协同抑制结直肠癌细胞HCT-116中TIMP3的表达, 从而对MMPS的抑制减弱, 增强了对基质的降解; 关志宇等[17]研究发现胃癌中TIMP3启动子存在明显的甲基化, 与正常组织相比有明显差异, 减少TIMP3的表达, 证明TIMP3启动子甲基化是该基因在胃癌中表达缺失的主要原因; Etoh等[18]证实胃癌细胞DNM1表达增加, 使抑癌基因的甲基化, 从而减少CDH1的表达. 通过我们对DNMT1和DNMT3A的表达与临床病理联系的研究, 证实肿瘤浸润深度超过肌层的病例中DNMT1和DNMT3A的表达明显高于浸润不超过肌层的病例, 其差异有统计学意义. 并且伴有淋巴结转移病例的DNMT1表达明显高于无淋巴结转移病例, DNMT3A的表达与淋巴结转移没有相关性. 以上实验结果显示肿瘤细胞中DNMTs的过度表达促进肿瘤细胞的浸润转移.
通过对手术后患者5年的随访, 分析了DNMT1和DNMT3A的表达与生存率的关系. 结果显示两者表达的差异不影响患者的远期生存率. 提示DNMTs的过度表达与疾病的进展不相关. 然而和以往实验一样, 由于早期进行结直肠癌根治手术生存率较晚期明显升高, 且本实验TNMⅠ期和Ⅱ期患者占总数的50%, 中晚期患者例数较少, 因此进行生存率比较可能存在偏倚. DNMTs的表达与肿瘤患者的预后是否相关, 还需要进一步的随访研究.
目前国内关于DNMTs在结直肠正常组织、腺瘤组织、癌组织三者的联合检测还未见报道. 本实验结果证实DNMT1和DNMT3A在结直肠癌的发生进展中发挥不同作用. 虽然作用机制尚不十分明确, 但DNMTs的过度表达会影响一系列抑癌基因的表达, 从而引起上皮细胞的异型增生. 基因突变是不可逆的, 而表观遗传的改变是可以逆转的, 在散发的结直肠癌在表观遗传可能起更主要的作用. 目前正在进行的DNMTs抑制剂基础实验表现出了多种机制的抗肿瘤作用, 因此抗DNMTs是未来肿瘤治疗的一个新靶点. 本实验研究结果对DNMTs抑制剂治疗结直肠癌进一步提供了理论依据.
表观遗传改变是结直肠癌重要发病机制之一, DNA甲基化是其中的一个研究热点. 已有资料表明肿瘤中DNA甲基转移酶和甲基化现象增加, 针对DNA甲基转移酶的成为肿瘤治疗的新靶点. 目前国内对于DNA甲基转移酶在结直肠癌和腺瘤中的表达与意义还未见系统研究.
陈其奎, 教授, 中山大学附属第二医院消化内科
Zhang等研究发现在HCT116细胞中, DNMT3A在高浓度阿霉素作用下表达上调, 同时P21保持低表达; 而在低阿霉素浓度下, P21表达上调.当DNMT3A被沉默以后, 凋亡浓度的DOX下衰老细胞比例增加, 伴有P21的上调. DNMT3A和P21对阿霉素的差异性表达, 提示DNMT3A可能是阿霉素诱导衰老和凋亡效应转换的重要因子.
本试验在国内首次采用免疫组织化学法, 系统地研究了正常大肠组织、腺瘤及大肠癌组织中DNA甲基转移酶的表达.
本试验证实了结直肠癌中组蛋白去乙酰化酶的过度表达, 进一步为结直肠癌的靶向治疗提供了理论依据.
本文选题恰当, 数据可信, 具有一定的理论和临床应用价值.
编辑: 李薇 电编:何基才
| 1. | Jemal A, Siegel R, Ward E, Murray T, Xu J, Thun MJ. Cancer statistics, 2007. CA Cancer J Clin. 2007;57:43-66. [PubMed] [DOI] |
| 2. | Vogelstein B, Kinzler KW. The multistep nature of cancer. Trends Genet. 1993;9:138-141. [PubMed] [DOI] |
| 3. | Egger G, Liang G, Aparicio A, Jones PA. Epigenetics in human disease and prospects for epigenetic therapy. Nature. 2004;429:457-463. [PubMed] [DOI] |
| 4. | Handa K, Yamakawa M, Takeda H, Kimura S, Takahashi T. Expression of cell cycle markers in colorectal carcinoma: superiority of cyclin A as an indicator of poor prognosis. Int J Cancer. 1999;84:225-233. [PubMed] [DOI] |
| 5. | King RJ, Coffer AI, Gilbert J, Lewis K, Nash R, Millis R, Raju S, Taylor RW. Histochemical studies with a monoclonal antibody raised against a partially purified soluble estradiol receptor preparation from human myometrium. Cancer Res. 1985;45:5728-5733. [PubMed] |
| 6. | Cheng X, Blumenthal RM. Mammalian DNA methyltransferases: a structural perspective. Structure. 2008;16:341-350. [PubMed] [DOI] |
| 7. | Chen T, Li E. Establishment and maintenance of DNA methylation patterns in mammals. Curr Top Microbiol Immunol. 2006;301:179-201. [PubMed] [DOI] |
| 8. | Goll MG, Bestor TH. Eukaryotic cytosine methyltransferases. Annu Rev Biochem. 2005;74:481-514. [PubMed] [DOI] |
| 9. | Chung YG, Ratnam S, Chaillet JR, Latham KE. Abnormal regulation of DNA methyltransferase expression in cloned mouse embryos. Biol Reprod. 2003;69:146-153. [PubMed] [DOI] |
| 11. | xWinawer SJ, Zauber AG, Ho MN, O'Brien MJ, Gottlieb LS, Sternberg SS, Waye JD, Schapiro M, Bond JH, Panish JF. Prevention of colorectal cancer by colonoscopic polypectomy. The National Polyp Study Workgroup. N Engl J Med. 1993;329:1977-1981. [PubMed] [DOI] |
| 12. | van Engeland M, Weijenberg MP, Roemen GM, Brink M, de Bruïne AP, Goldbohm RA, van den Brandt PA, Baylin SB, de Goeij AF, Herman JG. Effects of dietary folate and alcohol intake on promoter methylation in sporadic colorectal cancer: the Netherlands cohort study on diet and cancer. Cancer Res. 2003;63:3133-3137. [PubMed] |
| 13. | Zhao P, Mao X, Talbot IC. Aberrant cytological localization of p16 and CDK4 in colorectal epithelia in the normal adenoma carcinoma sequence. World J Gastroenterol. 2006;12:6391-6396. [PubMed] |
| 14. | Herman JG, Graff JR, Myöhänen S, Nelkin BD, Baylin SB. Methylation-specific PCR: a novel PCR assay for methylation status of CpG islands. Proc Natl Acad Sci U S A. 1996;93:9821-9826. [PubMed] [DOI] |
| 15. | Laird PW, Jackson-Grusby L, Fazeli A, Dickinson SL, Jung WE, Li E, Weinberg RA, Jaenisch R. Suppression of intestinal neoplasia by DNA hypomethylation. Cell. 1995;81:197-205. [PubMed] [DOI] |
| 16. | Rhee I, Bachman KE, Park BH, Jair KW, Yen RW, Schuebel KE, Cui H, Feinberg AP, Lengauer C, Kinzler KW. DNMT1 and DNMT3b cooperate to silence genes in human cancer cells. Nature. 2002;416:552-556. [PubMed] [DOI] |
| 18. | Etoh T, Kanai Y, Ushijima S, Nakagawa T, Nakanishi Y, Sasako M, Kitano S, Hirohashi S. Increased DNA methyltransferase 1 (DNMT1) protein expression correlates significantly with poorer tumor differentiation and frequent DNA hypermethylation of multiple CpG islands in gastric cancers. Am J Pathol. 2004;164:689-699. [PubMed] [DOI] |