修回日期: 2011-06-07
接受日期: 2011-06-15
在线出版日期: 2011-06-28
目的: 探讨γ干扰素(IFN-γ)、白介素4(IL-4)、转化生长因子β1(TGF-β1)在家兔直肠不同发育阶段中的表达与意义.
方法: 出生后5、15、25、35、60及90 d家兔60只, 分成6组, 取直肠组织, 用免疫组织化学SABC法和图像分析法对IFN-γ、IL-4、TGF-β1在直肠组织细胞中的定位和表达进行研究.
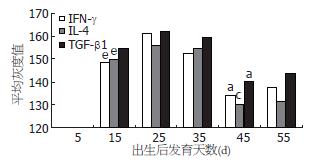
结果: 出生后5 d家兔直肠组织内未见IFN-γ、IL-4和TGF-β1的表达. 生后15 d家兔直肠内可见IFN-γ、IL-4和TGF-β1阳性细胞, 主要分布于上皮, 数量较多. 25-35 d, IFN-γ、IL-4和TGF-β1阳性细胞数量明显减少(P<0.05), 呈单个散在分布. 60 d, IFN-γ、IL-4和TGF-β1阳性细胞数量显著增多(P<0.05), 主要定位于肠腺之间固有层. 黏膜表面上皮偶见阳性细胞浸润; 90 d IFN-γ和TGF-β1阳性细胞数量有所减少(P<0.05). 15-35 d, IFN-γ阳性细胞较IL-4阳性细胞数量多, 60 d后则以IL-4阳性细胞为多. 图像分析结果显示, 家兔直肠IFN-γ、IL-4和TGF-β1阳性细胞的平均灰度值在生后15-25 d增高, 在35 d降低(P<0.05), 以IFN-γ阳性细胞变化最为显著; 35 d后平均灰度值显著降低(P<0.05), 60 d达到最低, 且以IL-4阳性细胞改变最为明显; 90 d IFN-γ和TGF-β1阳性细胞平均灰度值有所下降(P<0.05).
结论: IL-4、IFN-γ和TGF-β1阳性细胞的数量及分布随家兔直肠黏膜发育出现显著变化, 提示3种细胞因子参与家兔直肠黏膜免疫防御功能建立的调节过程.
引文著录: 洪艳, 梁文妹, 李一欣, 谢莉. IFN-γ、IL-4、TGF-β1在不同发育阶段家兔直肠组织中的表达. 世界华人消化杂志 2011; 19(18): 1936-1940
Revised: June 7, 2011
Accepted: June 15, 2011
Published online: June 28, 2011
AIM: To investigate the expression of interferon-γ (IFN-γ), interleukin-4 (IL-4) and transforming growth factor-β1 (TGF-β1) in the rabbit rectum during postnatal development.
METHODS: Sixty rabbits were equally divided into six groups according to postnatal age in days: 5-, 15-, 25-, 35-, 60-, and 90-day groups. The rectum tissue samples were collected to detect the expression of IFN-γ, IL-4 and TGF-β1 by immunohistochemistry.
RESULTS: On day 5, no IFN-γ-, IL-4- or TGF-β1-positive cells were found. On day 15, many IFN-γ-, IL-4- and TGF-β1-positive cells were scattered in the mucosa epithelium of the rectum. The numbers of IFN-γ-, IL-4- and TGF-β1-positive cells decreased obviously on days 25 and 35 (all P < 0.05) but increased significantly on day 60 (all P < 0.05). The majority of positive cells were distributed in the mucosal connective tissue, with few infiltrating into the rectal epithelium. On day 90, the numbers of IFN-γ- and TGF-β1-positive cells decreased gradually (both P < 0.05). The number of IFN-γ-positive cells was higher than that of IL-4-positive cells on days 15 and 35. On days 60 and 90, the number of IL-4-positive cells was higher than that of IFN-γ-positive cells. The mean grey values of IFN-γ-, IL-4- and TGF-β1-positive cells increased from day 15 to day 25, and decreased on day 35, especially prominent in IFN-γ-positive cells (P < 0.05). The mean grey values reached the lowest levels on day 60 (all P < 0.05), especially prominent in IL-4-positive cells. On day 90, the mean grey values of IFN-γ- and TGF-β1-positive cells decreased slightly (both P < 0.05).
CONCLUSION: The numbers of cells positive for IFN-γ, IL-4 or TGF-β1 and the expression levels of these cytokines in the rabbit rectum change obviously during postnatal development, suggesting that these cytokines may participate in regulating the postnatal development of immune defense mechanisms in the mucosa of the rabbit rectum.
- Citation: Hong Y, Liang WM, Li YX, Xie L. Expression of IFN-γ, IL-4 and TGF-β1 in the rabbit rectum during postnatal development. Shijie Huaren Xiaohua Zazhi 2011; 19(18): 1936-1940
- URL: https://www.wjgnet.com/1009-3079/full/v19/i18/1936.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i18.1936
直肠位于消化系末端, 对肠道内细菌和其他抗原物质起着局部免疫的作用, 其黏膜免疫功能与机体自身免疫机制的建立息息相关. 直肠淋巴组织主要包括肠道黏膜上皮及固有层内散在的淋巴细胞, 他们是肠道黏膜免疫系统行使免疫保护功能的效应位点[1]. 辅助性T淋巴细胞(Th细胞)能促进B淋巴细胞、T淋巴细胞和其他免疫细胞的增殖与分化, 协调免疫细胞间的相互作用, 在肠道黏膜免疫功能的调节中起重要作用[2]. 根据Th细胞产生细胞因子的不同分为Th1和Th2效应细胞, Th1细胞和Th2细胞的变化可在一定程度上反映机体的免疫平衡状态. γ-干扰素(interferon-γ, IFN-γ)、白介素-4(interleukin-4, IL-4)是分别由Th1细胞及Th2细胞分泌的细胞因子, 目前通常把IFN-γ和IL-4分别作为Th1细胞及Th2细胞的功能指标[3]. 转化生长因子β(transforming growth factor beta, TGF-β)是一类多功能多肽类生长因子, 几乎体内的每个细胞都产生TGF-β并存在其受体. 近年来发现TGF-β对细胞的生长、分化和免疫功能都有重要的调节作用[4]. 关于T淋巴细胞在肠道的发育, 国内外学者曾对动物肠系膜淋巴结内T淋巴细胞的发育进行研究[5], 对Th细胞亚群分化发育的系统研究资料较少, 关于家兔生后发育不同时期直肠黏膜内T淋巴细胞定位及分布的研究少见报道. 本课题采用免疫组织化学方法对家兔不同发育时期直肠黏膜IFN-γ、IL-4、TGF-β1免疫阳性细胞的定位及分布进行较系统的观察, 旨为直肠黏膜淋巴组织内Th细胞亚群的分化发育提供形态学资料, 并为消化系统免疫防御功能的研究提供形态学基础.
出生后5、15、25、35、60及90 d家兔(健康新西兰大耳兔)各10只, 体质量分别为0.072 kg±0.006 kg、0.151 kg±0.003 kg、0.209 kg±0.021 kg、0.345 kg±0.091 kg、1.210 kg±0.152 kg、2.001 kg±0.093 kg, 由贵阳医学院实验动物中心提供. 经股动脉放血处死后, 迅速于降结肠至肛门之间取直肠组织入Bouin液固定, 梯度酒精脱水, 常规石蜡包埋, 制成4 μm厚连续切片.
1.2.1 免疫组织化学染色(SABC法): 分别显示IFN-γ、IL-4、TGF-β1阳性细胞. 主要步骤: 甲醇-H2O2室温30 min, 正常羊血清(1:50)室温30 min, 第一层抗体4 ℃过夜, 羊抗小鼠IgG 37 ℃ 20 min, SABC复合物37 ℃ 20 min, DAB-H2O2液显色, 苏木精复染胞核, 中性树胶封片. 所用抗体中鼠抗IFN-γ、鼠抗IL-4由北京中杉金桥生物技术有限公司提供, 鼠抗TGF-β1及SABC试剂盒由武汉博士德生物工程公司提供. 方法对照, 以PBS缓冲液代替特异性抗血清, 其余步骤不变.
1.2.2 图像分析: 细胞计数: 随机选取各发育阶段家兔直肠切片3张, 在40倍物镜下, 每张切片随机选取5个视野, 计数IFN-γ、IL-4、TGF-β1阳性细胞数量; 平均灰度值测定: 随机选取各发育阶段家兔直肠切片3张, 在40倍物镜下, 每张切片随机选取5个视野, 用BioMias图像分析系统检测5-HT、SP、NPY阳性细胞的平均灰度值.
统计学处理 所有数据用mean±SD表示, 并采用统计软件SPSS11.5进行单因素的方差分析, 组间两两比较用q检验. P<0.05差异具有显著性.
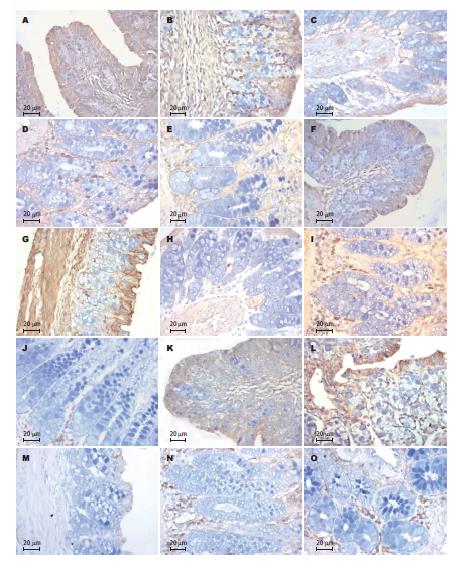
出生后5 d家兔直肠内未见IFN-γ、IL-4和TGF-β1阳性细胞分布. 生后15 d家兔直肠内可见较多IFN-γ、IL-4和TGF-β1阳性细胞, 棕褐色的阳性反应产物表达在胞质内, 主要定位于上皮, 数量以IFN-γ阳性细胞为多. 25-35 d, IFN-γ、IL-4和TGF-β1阳性细胞数量明显减少, 呈单个散在分布. 60 d, IFN-γ、IL-4和TGF-β1阳性细胞数量显著增多, 尤以IL-4阳性细胞数量最多, 免疫染色最强. 主要定位于肠腺之间固有层结缔组织. 黏膜表面上皮偶见阳性细胞浸润. 90 d IFN-γ和TGF-β1阳性细胞数量有所减少(图1). 方法对照切片未见阳性反应细胞.
家兔直肠黏膜生后15 d IFN-γ、IL-4和TGF-β1阳性细胞数量较多, 以IFN-γ阳性细胞数量为多; 25-35 d细胞数量减少(P<0.05); 60 d细胞数量显著上升(P<0.05), 以IL-4阳性细胞最为明显; 90 d IFN-γ和TGF-β1阳性细胞数量下降(P<0.05, 表1). 家兔直肠黏膜出生后15-35 d, IFN-γ、IL-4和TGF-β1的平均灰度值先增高后降低(P<0.05), 以IFN-γ变化最为显著; 35 d后平均灰度值显著降低(P<0.05), 60 d达到最低, 且以IL-4改变最为明显; 90 d IFN-γ和TGF-β1平均灰度值有所下降(P<0.05, 图2).
肠道不仅是消化、吸收营养物质的场所, 而且具有重要的免疫屏障功能. 肠道免疫系统由大量弥散分布在肠黏膜上皮和固有层的免疫细胞、免疫分子以及集合淋巴小结等肠相关性淋巴组织组成[1]. 小肠集合淋巴小结为肠黏膜免疫主要诱导部位, 肠黏膜上皮和固有层为主要效应部位. T、B淋巴细胞在淋巴小结诱导后, 分化、成熟, 并移行到黏膜效应部位. 直肠黏膜内淋巴细胞作为黏膜免疫系统的一部分, 对肠道内细菌和其他抗原物质发挥免疫效应功能[2]. Th1/Th2细胞及其细胞因子网络的调节对维持机体正常的免疫功能至关重要. Th1细胞主要引起T淋巴细胞介导的细胞毒作用和细胞免疫, Th2细胞主要功能为促进体液免疫反应. 研究证实, Th1/Th2细胞能相互拮抗, Th1细胞通过分泌IFN-γ抑制Th2极化, Th2细胞也能通过分泌IL-4限制Th1型反应. IFN-γ与IL-4分别是典型的Th1和Th2型细胞因子, 目前通常把IFN-γ和IL-4分别作为Th1细胞及Th2细胞的功能指标[6]. 关于T淋巴细胞的生后发育, 高娟等用RT-PCR方法检测正常SD大鼠不同发育时期派氏结中的淋巴细胞IL-4 mRNA、IFN-γ mRNA及IL-2 mRNA的表达水平, 结果显示5 wk时IFN-γ mRNA和IL-2 mRNA表达显著低于3 wk, 表明断乳前后是派氏结中淋巴细胞发育活化重要时期[7]. 李小为等通过免疫组织化学方法研究了CD3+、CD4+和CD8+淋巴细胞在鸡直肠中的定位分布以及数量变化规律, 结果表明随着日龄的增长, T淋巴细胞的数量持续增多, 并以CD4+淋巴细胞居多, 多数位于黏膜固有层. 说明鸡出壳后初期直肠的体液免疫逐渐增强, 并在21日龄时达到成熟水平[8].
本研究结果表明家兔直肠黏膜IL-4、IFN-γ和TGF-β1的表达在生后35 d显著增高, 可能与家兔35 d左右断乳, 开始由母乳喂养转变为饲料喂养, 肠道黏膜接触外源性抗原种类显著增加有关[9]. 从实验结果看, 断乳后(60 d)IFN-γ、IL-4阳性细胞的数量急剧增多, 提示在此时期, Th1和Th2细胞不管在数目还是功能上都出现显著增强趋势, 这一点与上述学者的研究结果相符, 可以推测在抗原刺激下大量T淋巴细胞不断增殖分化形成不同的功能亚群, 以抵抗外来抗原的侵袭, 弥补系统免疫不成熟的不足. 但90 d IFN-γ阳性细胞数量开始下降, IL-4阳性细胞数量仍维持较高水平; 研究结果还显示在家兔断乳后IL-4阳性细胞数量较IFN-γ阳性细胞明显增多. 提示Th2细胞在家兔直肠黏膜淋巴细胞断乳后发育中(尤其90 d)占有一定优势. IL-4和TGF-β促进B淋巴细胞发生IgA类型转换, 从而促进黏膜免疫应答的发生. IFN-γ通过拮抗IL-4 抑制IgA抗体的分泌[10]. Little等用免疫组织化学和流式细胞仪检测鼠鞭虫易感性和防御性小鼠大肠黏膜上皮及固有层淋巴细胞的表型特征的改变, 结果表明防御性小鼠淋巴细胞呈现Th2型急性炎症反应以驱逐鞭虫, 易感性小鼠呈现慢性感染的Th1型反应[11]. 直肠由于长期接触大量病原微生物抗原使淋巴细胞迅速增殖分化, 并逐渐出现Th2细胞因子优势表达, 推测正常生理状态下家兔直肠黏膜免疫防御功能以Th2型反应为主.
TGF-β是一种高度多效性、多功能性的生长与分化因子. 通过调节细胞的增殖、分化和凋亡, 在脊椎动物的发育中起重要作用[4]. 最新研究显示某些口服抗原(如卵蛋白)可诱导肠道免疫组织分化出一种特殊类型的Th3细胞, 主要通过高表达TGF-β下调抗原递呈细胞及Thl细胞的活性, 起免疫抑制作用[12,13]. 张丽等[14]研究IFN-γ对兔盆腔术中照射后直肠组织的病理变化和TGF-β含量的影响, 结果表明IFN-γ能明显抑制TGF-β mRNA的表达. 本实验结果显示TGF-β1的表达也于60 d显著增高, 90 d有所下降. 推测IFN-γ对TGF-β1的表达可能具有明显的抑制作用, 而IFN-γ的表达降低也可能与TGF-β1导致的免疫抑制作用有关.
研究显示, 肠上皮间淋巴细胞与固有层淋巴细胞所含细胞类型有明显差异. 肠上皮间淋巴细胞为特殊的T淋巴细胞群, 其来源、分化成熟场所、细胞表型等均与胸腺分化成熟的T淋巴细胞有明显不同[15]. 大肠黏膜上皮间淋巴细胞类型与小肠有明显差异, CD8+ T淋巴细胞和CD4+ T淋巴细胞数量基本一致, 固有层T淋巴细胞以CD4+ T淋巴细胞为主, CD8+ T淋巴细胞较少[11]. 本研究结果表明生后15 d家兔直肠黏膜上皮内可见较多IL-4、IFN-γ阳性细胞, 且以IFN-γ阳性细胞为多, 但随后细胞数量明显减少, 60 d细胞数量增多但主要分布在固有层. 提示家兔直肠发育早期上皮内淋巴细胞有Th细胞的分布, 且以Th1细胞占优势, 但随日龄的增长, 细胞数量逐渐减少. 上皮间淋巴细胞在有病毒感染、体外刺激和寄生虫感染引起的肠道疾病中起重要的免疫防御和免疫调节作用[16], 淋巴细胞的增多一方面表明该部分组织的发育程度, 另一方面表明伴随组织发育出现的免疫防御作用的形成. 而固有层的T淋巴细胞以CD4+ T淋巴细胞为主. 固有层内Th细胞增多可能有利于肠道对外来抗原刺激产生适度的免疫应答, 为家兔直肠黏膜免疫防御功能的建立提供必须的效应细胞.
直肠位于消化系末端, 对肠道内细菌和其他抗原物质起着局部免疫的作用, 其黏膜免疫功能与机体自身免疫机制的建立息息相关. 直肠淋巴组织主要包括肠道黏膜上皮及固有层内散在的淋巴细胞, 他们是肠道黏膜免疫系统行使免疫保护功能的效应位点.
赵春玲, 副教授, 潍坊医学院细胞生物学教研室
张丽等研究IFN-γ对兔盆腔术中照射后直肠组织的病理变化和TGF-β含量的影响, 结果表明IFN-γ能明显抑制TGF-β mRNA的表达.
IL-4、IFN-γ和TGF-β1阳性细胞的数量及分布随家兔直肠黏膜发育出现显著变化, 提示3种细胞因子参与家兔直肠黏膜免疫防御功能建立的调节过程.
本文选题较新颖, 实验设计合理, 为研究消化系统的免疫防御功能提供实验基础.
编辑: 曹丽鸥 电编:何基才
| 1. | Iijima H, Takahashi I, Kiyono H. Mucosal immune network in the gut for the control of infectious diseases. Rev Med Virol. 2001;11:117-133. [PubMed] [DOI] |
| 2. | Svensson M, Russell K, Mack M, Else KJ. CD4+ T-cell localization to the large intestinal mucosa during Trichuris muris infection is mediated by G alpha i-coupled receptors but is CCR6- and CXCR3-independent. Immunology. 2010;129:257-267. [PubMed] [DOI] |
| 3. | Pinto RA, Arredondo SM, Bono MR, Gaggero AA, Díaz PV. T helper 1/T helper 2 cytokine imbalance in respiratory syncytial virus infection is associated with increased endogenous plasma cortisol. Pediatrics. 2006;117:e878-e886. [PubMed] [DOI] |
| 4. | Feagins LA. Role of transforming growth factor-β in inflammatory bowel disease and colitis-associated colon cancer. Inflamm Bowel Dis. 2010;16:1963-1968. [PubMed] [DOI] |
| 5. | Spencer J, Dillon SB, Isaacson PG, MacDonald TT. T cell subclasses in fetal human ileum. Clin Exp Immunol. 1986;65:553-558. [PubMed] |
| 10. | Estes DM. Regulation of IgA responses in cattle, humans and mice. Vet Immunol Immunopathol. 2010;138:312-317. [PubMed] [DOI] |
| 11. | Little MC, Bell LV, Cliffe LJ, Else KJ. The characterization of intraepithelial lymphocytes, lamina propria leukocytes, and isolated lymphoid follicles in the large intestine of mice infected with the intestinal nematode parasite Trichuris muris. J Immunol. 2005;175:6713-6722. [PubMed] |
| 13. | Hong S, Lee HJ, Kim SJ, Hahm KB. Connection between inflammation and carcinogenesis in gastrointestinal tract: focus on TGF-beta signaling. World J Gastroenterol. 2010;16:2080-2093. [PubMed] [DOI] |
| 14. | 张 丽, 王 华, 王 娟, 杨 蕴一, 刘 孜. IFN-γ对兔盆腔术中照射后直肠组织TGF-β1 mRNA含量的影响. 西安交通大学学报(医学版). 2010;31:617-620. |
| 15. | 吕 昌龙, 祁 赞梅, 方 芳, 刘 军, 那 立新, 吕 超, 李 宗喜. 实验性消化道溃疡的iIEL及其亚群(Thy1-)的TH1型细胞因子水平变化及细胞毒活性. 中华微生物学和免疫学杂志. 2003;23:717-720. |
| 16. | 朱 清仙, 邓 锋, 江 鹏飞, 曾 慧红, 邹 江洪. 人胎大肠和小肠上皮内淋巴细胞的比较分析. 中国体视学与图像分析. 2004;9:84-87. |