修回日期: 2011-06-23
接受日期: 2011-06-15
在线出版日期: 2011-06-28
目的: 探讨小鼠小肠慢性不全性肠梗阻导致自发性节律性收缩运动、电活动变化与Cajal间质细胞(ICC)表型转化的关系.
方法: 通过外科手术方法在小鼠回肠套入硅胶管, 建立小鼠不全性肠梗阻模型. 利用苏木精-伊红(H&E)染色, 研究小肠平滑肌层形态学改变; 利用常规生理和电生理技术观察环行平滑肌肌条自发性节律性收缩和慢波变化规律; 利用全层平滑肌免疫组织化学方法, 观察ICC表型标志酪氨酸激酶受体(c-kit)表达的变化.
结果: 小鼠不全性肠梗阻模型形成后14 d, 梗阻近端肠管显著扩张、小肠平滑肌层明显增生肥厚; 小肠平滑肌自发性节律性收缩节律紊乱、幅度不规则、频率变慢; 平滑肌静息膜电位去极化、慢波幅度变小、频率变慢; ICC表型标志c-kit表达显著减弱、甚至消失.
结论: 小鼠不全性肠梗阻导致机械和电活动紊乱与ICC表型转化导致的ICC数量减少和网络破坏有关. 该模型为进一步研究ICC表型改变的细胞/分子机理提供了一个良好的实验模型.
引文著录: 郭新, 刘东海, 黄旭, 陆红丽, 吴贻松, 韩燕飞, 许文燮. 小鼠不全性肠梗阻对Cajal间质细胞表型的影响. 世界华人消化杂志 2011; 19(18): 1886-1891
Revised: June 23, 2011
Accepted: June 15, 2011
Published online: June 28, 2011
AIM: To investigate changes in mechanic and electrical activities in intestinal smooth muscle and the phenotypes of interstitial cells of Cajal (ICC) in mice with partial intestinal obstruction.
METHODS: A mouse model of partial mechanical ileal obstruction was induced by surgery. The histochemical technique was used to investigate morphological changes in the distended intestinal regions of model mice 14 d after surgical induction. Mechanic and electric activities were recorded in normal and distended intestinal circular muscle using conventional physiological and intracellular recording techniques. The expression of c-kit, an ICC phenotype marker, was examined by fluorescent immunohistochemistry.
RESULTS: Fourteen days after surgical induction, there was an increase in intestinal diameter and hypertrophy of the tunica muscularis. Decreased frequency and altered rhythm of spontaneous contractions of intestinal smooth muscle were noted. The amplitude and frequency of slow waves and resting membrane potential decreased significantly. The expression of ICC was significantly down-regulated.
CONCLUSION: The changes in spontaneous rhythmic contractions and the slow waves are associated with the phenotype alterations of ICC in mice with partial intestinal obstruction.
- Citation: Guo X, Liu DH, Huang X, Lu HL, Wu YS, Han YF, Xu WX. Phenotype alterations of interstitial cells of Cajal in mice with partial intestinal obstruction. Shijie Huaren Xiaohua Zazhi 2011; 19(18): 1886-1891
- URL: https://www.wjgnet.com/1009-3079/full/v19/i18/1886.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i18.1886
肠梗阻是临床腹部外科的常见病、多发病, 任何原因引起的肠内容物通过障碍均可导致肠梗阻, 导致梗阻以上的肠管扩张, 进一步引起肠道和全身的病理生理变化; 其大致可分为机械性(器质性)和动力性(功能性)两大类[1-3]. 肠梗阻给患者带来极大的痛苦, 严重威胁患者的健康和生命. 肠梗阻的基础和临床研究一直是广大科研工作者研究的热点和难点[4-6]. Cajal间质细胞(interstitial cell of Cajal, ICC)是近年研究中被确认的胃肠平滑肌自律性运动的起搏细胞, 他发动和控制基本电节律或慢波的频率、幅度等, 对胃肠运动起着非常关键性作用[7,8]. 很多研究已经证实[9-11], 临床上许多治疗较为困难的胃肠动力障碍性疾病, 例如糖尿病性胃轻瘫、慢传输型便秘、假性肠梗阻、先天性巨结肠等, 均可见胃肠壁ICC明显减少, ICC网络的完整性被破坏. ICC的表型标志是酪氨酸激酶受体(c-kit), 当ICC失去c-kit信号时, 成熟的ICC的表型可转化成平滑肌细胞或者成纤维细胞表型, 使ICC的起搏、传导功能丧失[12-14]. 学者们对梗阻后肠管的形态学改变已经进行过系统的研究, 那么, 梗阻后肠管形态学改变与其收缩功能、慢波、电-机械收缩偶联的关系会发生怎样变化?ICC的表型是否会发生改变?本研究拟通过外科手术方法建立小鼠不全性肠梗阻模型, 研究其形态、收缩功能、慢波和ICC表型标志c-kit的改变, 阐明慢性不全性肠梗阻小肠形态、功能和慢波的改变与ICC表型转化的关系. 为进一步研究ICC表型转化的细胞/分子机理建立稳定的实验动物模型.
ICR♂5周龄小鼠, 由中国科学院实验动物中心提供. 体质量30 g±2 g. kreb液(mmol/L), pH值为7.3-7.4, 其组成: NaCl 118.5; KCl 4.5; MgCl2 1.2; NaHCO3 23.8; KH2PO4 1.2; Glucose 11.0; CaCl2 2.4. 磷酸盐缓冲液即PBS缓冲液(mmol/L), pH值为7.2-7.4, 其组成: NaCl 137; KCl 2.7; Na2HPO4 4.3; KH2PO4 1.4 mmol/L. c-kit多克隆抗体(rabbit)(sc-5535; Santa Cruz Biotechnology, Santa Cruz, CA, USA)、异硫氰酸荧光(FITC-488)标记的二抗(Santa Cruz Biotechnology, Santa Cruz, CA, USA)、SMUP-E生理记录仪(成都仪器设备厂)、Duo-773微电极放大器(WPI, USA).
1.2.1 外科手术建立不全性肠梗阻模型: 小鼠(n = 30)予苯巴比妥钠(33 mg/kg)腹腔注射麻醉, 消毒、铺巾, 取下腹正中切口1.5 cm进腹, 将位于左下腹的回盲部肠管轻轻提出切口, 逆行探查回肠约2-4 cm, 选择无肠系膜血管区域作为拟梗阻部位, 余肠管无扭曲还纳; 剪开肠系膜约1.0 cm大小. 将准备好的自制缩窄环(6 mm长硅胶管, 外径5 mm, 内径4 mm, 纵行剪开, 消毒备用)套入肠管, 肠管无扭曲、卡压、系膜血管血供良好, 原位予"0"号丝线硅胶管外打结固定. 重新探查无出血、肠管血供良好, 肠管无扭曲、无成角还纳. 分层缝合切口, 再次消毒, 完成手术, 对照组硅胶管外不予丝线打结. 术后正常喂养, 14 d后予颈椎脱位的方法处死小鼠, 取近端50 mm肠管做实验[15].
1.2.2 慢性不全性肠梗阻梗阻近端肠管形态学研究: 大体标本检测肠管外周长度, 计算肠管直径, 常规苏木精-伊红染色法, 即H&E染色法处理肠管, 光镜下分析平滑肌层厚度和细胞的数量变化.
1.2.3 观察环行平滑肌自发收缩: 检测其环行肌收缩运动规律. 在对照组和小肠不全性肠梗阻动物模型第14天, 从离梗阻部位50 mm处取出1-2 cm的肠管, 立即置入持续供氧的kreb液中, 在解剖显微镜下仔细剥除黏膜和黏膜下层制作平滑肌层环行肌标本(1 mm×0.3 mm), 在kreb液水浴槽中连接换能器, 37 ℃、950 mL/L O2、50 mL/L CO2和1.5 g的张力条件下平衡60 min, 利用生理记录仪记录其自发性收缩频率和幅度.
1.2.4 观察环行肌慢波: 按上述方法取对照组和梗阻的小鼠小肠, 制作平滑肌组织标本(3×5 mm), 浆膜面向下, 在kreb液水浴槽中, 37 ℃、950 mL/L O2、50 mL/L CO2条件下至少平衡60 min. 采用40-80 MΩ左右的玻璃微电极, 电极内为3 mol/L KCl, 将电极插入细胞内, 利用Duo-773微电极放大器记录小肠平滑肌基本电节律.
1.2.5 小肠平滑肌全层c-kit免疫组织化学研究: 按上述方法取对照组和梗阻的小鼠小肠, 制作平滑肌组织标本(5 mm×5 mm), 将平滑肌标本牵拉至110%, 予4 ℃丙酮固定10 min, 予PBS液泡洗3 h, 在室温下孵育含0.3% Triton X-100的10%羊血清1 h, 封闭非特异性抗原, 再用PBS冲洗3次每次15 min; 检测组织中ICC, c-kit抗体(1:100)孵育4 ℃过夜, 再用PBS冲洗半天, 然后加入FITC标记的二抗(1:200)在常温下作用2 h; 最后PBS冲洗冲洗半天, 予1:1甘油/PBS液封片. 在激光共聚焦显微镜下观察组织间ICC.
统计学处理 所有统计数据用mean±SD来表示. 实验结果采用同体对照的t检验, 具有显著性差异的标准为aP<0.05, bP<0.01.
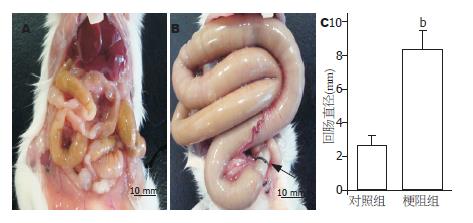
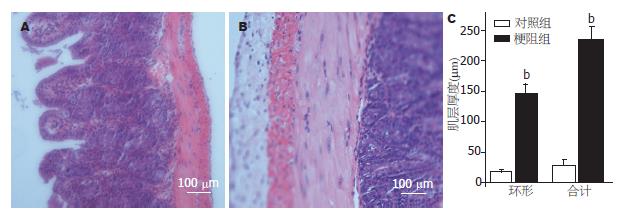
回肠部与套入硅胶管后14 d, 小鼠腹部会明显彭隆. 打开腹腔, 肉眼观可见梗阻部位上端肠管明显扩张、僵硬, 肠管系膜缘侧血管增多(图1). 梗阻后, 肠内容物无法通过梗阻处, 早期梗阻上端肠管平滑肌代偿性增生, 14 d时, 梗阻肠管处于失代偿期. 对照组小肠无明显变化. 检测梗阻后回肠直径明显大于对照组, 如图1C. H&E染色结果显示平滑肌层明显变厚、细胞增大(图2). 分析显示, 梗阻后无论是环行肌还是纵行肌均明显增厚.
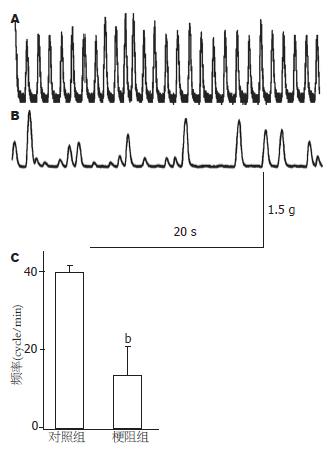
小鼠小肠不全性梗阻14 d后比较观察正常小鼠和梗阻小鼠小肠环行平滑肌自发性收缩功能. 结果表明, 梗阻小肠环行平滑肌自发性收缩节律紊乱、不规则和频率明显减慢, 幅度不规则(图3). 从功能学角度提示, ICC的起搏和传导功能均受到损害.
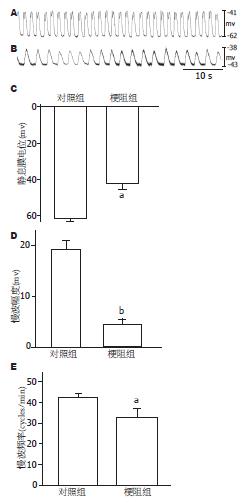
慢波是胃肠道平滑肌自发节律性收缩的控制波, 最近研究表明, 慢波就是起源于ICC, 既然梗阻导致小肠平滑肌自发收缩节律紊乱, 我们进一步观察了梗阻小肠平滑肌慢波. 实验结果表明, 梗阻后14 d, 慢波静息膜电位发生去极化、慢波幅度变低、频率变慢(图4). 从电生理角度提示, ICC的起搏和传导功能均受到损害.
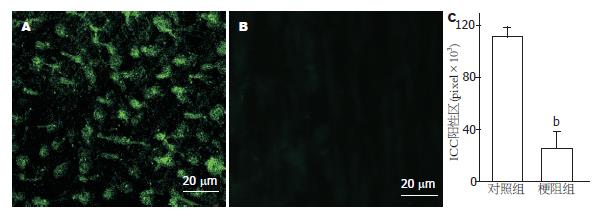
目前国际上通用的ICC的表型标志蛋白是c-kit, 当ICC失去c-kit信号时, 成熟的ICC表型可转化成平滑肌或者成纤维细胞表型, 导致ICC的起搏、传导功能丧失. 我们通过全层平滑肌免疫组织化学染色并共聚焦显微镜薄层扫描, 研究ICC表型标志c-kit的变化, 梗阻后c-kit的表达明显减少甚至消失. 在形态学角度说明, 梗阻引起小肠ICC表型发生变化(图5).
早期的学者Gabella等[3-5]就对梗阻后豚鼠和大鼠的肠平滑肌层的变化进行过系统研究, 发现梗阻近端肠管发生增生、肥厚, Chang等[16]在研究小鼠不全性肠梗阻ICC慢波变化时亦有同样的发现. 我们的实验结果与他们的观察相吻合, 梗阻后梗阻近端肠管扩张, 肠管壁发生增生肥厚. H&E染色结果显示环行肌层和纵行肌层平滑肌细胞数量增多, 体积变大. 以往研究表明, 在细胞/分子水平距梗阻部位50 mm以内没有明显差异[15], 故我们亦选择距梗阻部位近端50 mm内作为研究对象.
基本电节律是消化道平滑肌细胞以静息膜电位为基础产生的节律缓慢的自发性去极化, 又称为慢波电位. 近年的研究表明, 引起胃肠平滑肌自动节律性运动的起搏细胞是位于纵行肌和环行肌之间的ICC, 他们是一种兼有成纤维细胞和平滑肌细胞特性的间质细胞, 可分为ICC-MY和ICC-IM两类, 其中ICC-MY是起搏细胞, 其自发性产生的节律性电活动, 称为起搏电流(pacemaker current)[17,18]. 因此, ICC作为一类特殊的细胞, 已成为胃肠动力学领域的一个新的研究方向. ICC是胃肠自律性运动的起搏细胞, 因此ICC生理学功能以及ICC与胃肠动力相关性疾病的关系研究已经成为国内外学者关注的研究热点.
我们的实验结果表明, 梗阻14 d后平滑肌自发性收缩节律紊乱、不规则和频率明显减慢, 幅度不规则, 结果与Won等[19]研究结果吻合. 我们还观察到, 慢波静息膜电位发生去极化、慢波幅度变低、频率变慢, 这些结果同Chang等[16]的研究结果相吻合. 这些结果提示, 梗阻引起的小肠平滑肌机械和电活动紊乱与ICC受损害有关. c-kit作为ICC表型标志, 目前已为广大学者所接受[12-14]. 为了进一步探讨梗阻引起的小肠运动障碍与ICC之间的关系, 我们进一步利用免疫荧光化学方法观察了梗阻小肠壁ICC标志蛋白c-kit表达情况. 结果表明, 梗阻14 d的小鼠小肠壁c-kit表达减少、甚至消失. 以上结果提示, 梗阻发生后首先引起梗阻小肠平滑肌结构重建, 导致平滑肌异常增生和肥厚, 并伴有ICC表型转化. ICC表型转化导致ICC数量减少、网络破坏引起ICC起搏功能异常, 最终诱发平滑肌机械和电活动异常. 可见, 研究ICC表型转化的意义对胃肠动力障碍性疾病的病理生理机制具有重要意义[20]. 我们下一步将进一步研究梗阻引起的平滑肌结构重建如何导致ICC表型转化以及影响ICC表型转化的细胞/分子机制.
总之, 本研究通过外科手术的方法建立的小鼠不全性肠梗阻实验模型方法可行, 其形态和功能改变显著便于研究. 梗阻后14 d, 梗阻部位近端肠管扩张, 平滑肌增生、肥厚; 梗阻小肠平滑肌自发性节律性收缩节律紊乱、频率变慢; 基本电节律静息膜电位发生去极化, 且幅度变小、频率变慢; 同时, ICC表型标志c-kit表达减少、甚至消失, 即ICC表型发生转化. 清楚地显示, ICC表型转化与平滑肌功能改变的紧密关系, 体现肠平滑肌电-机械收缩偶联异常导致进一步的肠运动功能紊乱. 本文建立的小鼠不全性小肠梗阻模型为进一步研究ICC表型转化的细胞/分子机制研究, 提供了理想的实验模型, 为下一步研究打下了坚实的基础.
肠梗阻是临床腹部外科的常见病、多发病, 梗阻后的肠管发生形态学、功能上的改变. 研究表明, 引起胃肠平滑肌慢波的起搏细胞是位于纵行肌和环行肌之间的Cajal间质细胞(ICC), 其表型标志为酪氨酸激酶受体(c-kit).
朱亮, 副教授, 大连医科大学生理教研室
ICC作为一类特殊的细胞, 已成为胃肠动力学领域的一个新的研究方向. ICC是胃肠自律性运动的起搏细胞, 因此ICC生理学功能以及ICC与胃肠动力相关性疾病的关系研究已经成为国内外学者关注的研究热点.
本文利用外科手术方法成功建立了小鼠不全性肠梗阻动物模型, 研究其形态、功能、慢波和ICC表型标志c-kit的变化规律. 研究表明, 慢性不全性肠梗阻发生小肠形态学的肥厚、增生. 功能和慢波的改变与ICC表型转化密切相关.
本文结果显示, 慢性不全性肠梗阻发生小肠形态学的改变, 功能和慢波的改变与ICC表型转化密切相关. 该模型为进一步研究ICC表型改变的细胞/分子机理提供了一个良好的实验模型.
本文创新性较好, 有重要的基础研究意义和临床借鉴价值.
编辑: 曹丽鸥 电编:李薇
| 1. | Lapointe R. Chronic idiopathic intestinal pseudo-obstruction treated by near total small bowel resection: a 20-year experience. J Gastrointest Surg. 2010;14:1937-1942. [PubMed] [DOI] |
| 2. | Prommegger R, Marksteiner J, Wetscher G, Tschmelitsch J, Eder U, Fischer-Colbrie R, Saria A, Bodner E. Obstructive ileus of large bowel is associated with low tissue levels of neuropeptides in prestenotic bowel segment. Dig Dis Sci. 1997;42:1513-1518. [PubMed] [DOI] |
| 3. | Gabella G. Hypertrophy of visceral smooth muscle. Anat Embryol (Berl). 1990;182:409-424. [PubMed] [DOI] |
| 4. | Bertoni S, Gabella G. Hypertrophy of mucosa and serosa in the obstructed intestine of rats. J Anat. 2001;199:725-734. [PubMed] [DOI] |
| 5. | Gabella G. Hypertrophy of intestinal smooth muscle. Cell Tissue Res. 1975;163:199-214. [PubMed] [DOI] |
| 6. | Storkholm JH, Zhao J, Villadsen GE, Hager H, Jensen SL, Gregersen H. Biomechanical remodeling of the chronically obstructed Guinea pig small intestine. Dig Dis Sci. 2007;52:336-346. [PubMed] [DOI] |
| 7. | Owyang C, Hasler WL. Physiology and pathophysiology of the interstitial cells of Cajal: from bench to bedside. VI. Pathogenesis and therapeutic approaches to human gastric dysrhythmias. Am J Physiol Gastrointest Liver Physiol. 2002;283:G8-G15. [PubMed] |
| 8. | Ward SM, Sanders KM, Hirst GD. Role of interstitial cells of Cajal in neural control of gastrointestinal smooth muscles. Neurogastroenterol Motil. 2004;16 Suppl 1:112-117. [PubMed] [DOI] |
| 9. | 李 宇航, 王 庆国, 陈 萌, 杨 美娟, 赵 丽云, 李 丽娜, 张 冬梅, 王 丹. 大鼠胃电节律失常模型胃肌间Cajal间质细胞含量的变化. 世界华人消化杂志. 2004;12:639-641. [DOI] |
| 10. | 罗 云, 林 琳, 张 红杰, 李 学良, 吴 高珏, 王 美峰. 糖尿病慢传输运动结肠Cajal间质细胞和干细胞因子的变化. 世界华人消化杂志. 2007;15:458-463. [DOI] |
| 11. | Horváth VJ, Vittal H, Lörincz A, Chen H, Almeida-Porada G, Redelman D, Ordög T. Reduced stem cell factor links smooth myopathy and loss of interstitial cells of cajal in murine diabetic gastroparesis. Gastroenterology. 2006;130:759-770. [PubMed] [DOI] |
| 12. | Huizinga JD, Thuneberg L, Klüppel M, Malysz J, Mikkelsen HB, Bernstein A. W/kit gene required for interstitial cells of Cajal and for intestinal pacemaker activity. Nature. 1995;373:347-349. [PubMed] [DOI] |
| 13. | Beckett EA, Ro S, Bayguinov Y, Sanders KM, Ward SM. Kit signaling is essential for development and maintenance of interstitial cells of Cajal and electrical rhythmicity in the embryonic gastrointestinal tract. Dev Dyn. 2007;236:60-72. [PubMed] [DOI] |
| 14. | Sanders KM, Ward SM. Kit mutants and gastrointestinal physiology. J Physiol. 2007;578:33-42. [PubMed] [DOI] |
| 15. | Chen J, Chen H, Sanders KM, Perrino BA. Regulation of SRF/CArG-dependent gene transcription during chronic partial obstruction of murine small intestine. Neurogastroenterol Motil. 2008;20:829-842. [PubMed] [DOI] |
| 16. | Chang IY, Glasgow NJ, Takayama I, Horiguchi K, Sanders KM, Ward SM. Loss of interstitial cells of Cajal and development of electrical dysfunction in murine small bowel obstruction. J Physiol. 2001;536:555-568. [PubMed] [DOI] |
| 18. | Ro S, Park C, Jin J, Zheng H, Blair PJ, Redelman D, Ward SM, Yan W, Sanders KM. A model to study the phenotypic changes of interstitial cells of Cajal in gastrointestinal diseases. Gastroenterology. 2010;138:1068-1078.e1-2. [PubMed] |
| 19. | Won KJ, Suzuki T, Hori M, Ozaki H. Motility disorder in experimentally obstructed intestine: relationship between muscularis inflammation and disruption of the ICC network. Neurogastroenterol Motil. 2006;18:53-61. [PubMed] [DOI] |
| 20. | MacDonald JA. Smooth muscle phenotypic plasticity in mechanical obstruction of the small intestine. Neurogastroenterol Motil. 2008;20:737-740. [PubMed] [DOI] |