修回日期: 2011-05-21
接受日期: 2011-06-02
在线出版日期: 2011-06-28
目的: 探讨金黄益胆颗粒对重症急性胰腺炎(SAP)大鼠胰腺组织中细胞间黏附分子1(ICAM-1)、转化生长因子β1(TGF-β1)表达的影响.
方法: 清洁级SD♂大鼠54只, 随机分为对照组、模型组、治疗组, 每组18只, 各组又分为2 h组、6 h组及12 h组3个时间段组, 每个时间段组6只大鼠. 5%牛磺胆酸钠逆行注射建立SAP大鼠动物模型. 行胰腺组织镜下病理评分, 免疫组织化学SP两步法检测胰腺组织中ICAM-1、TGF-β1蛋白的表达.
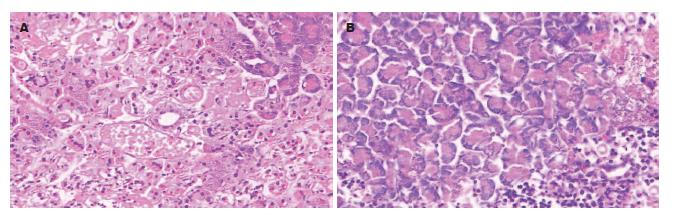
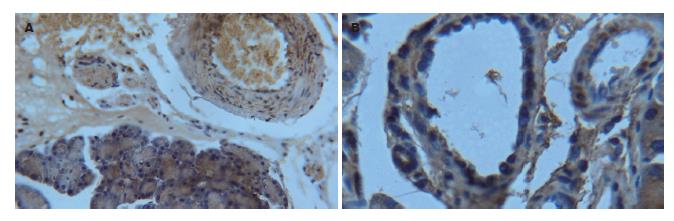
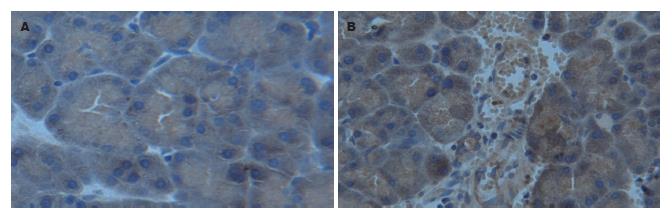
结果: Schmidt胰腺组织镜下评分显示, 与模型组比较, 造模后6 h、12 h, 治疗组大鼠胰腺组织的病理损害程度明显减轻(10.33±0.82 vs 14.00±0.63, P = 0.000; 9.67±0.82 vs 15.33±0.52, P = 0.000). 治疗组12 h后ICAM-1阳性细胞表达明显减少(3.67±0.76 vs 6.40±0.72, P = 0.000). 治疗组6 h和12 h后TGF-β1表达明显增强(3.77±0.78 vs 0.60±1.00; 5.17±1.42 vs 2.23±1.01, 均P = 0.000).
结论: 金黄益胆颗粒能够降低ICAM-1的表达, 升高TGF-β1的表达, 显著改善早期SAP大鼠胰腺组织的病理损害程度.
引文著录: 张秀平, 曹立瀛, 刘四清, 付庆江, 郭振武. 金黄益胆颗粒对重症急性胰腺炎大鼠胰腺组织中ICAM-1、TGF-β1表达的影响. 世界华人消化杂志 2011; 19(18): 1880-1885
Revised: May 21, 2011
Accepted: June 2, 2011
Published online: June 28, 2011
AIM: To investigate the effect of Jinhuangyidan on the expression of intercellular cell adhesion molecule-1 (ICAM-1) and transforming growth factor-β1 (TGF-β1) in the pancreas tissue of rats with severe acute pancreatitis (SAP).
METHODS: Fifty-four male SD rats were randomly and equally divided into control group, model group and treatment group. SAP was induced in rats by retrograde injection of 5% taurocholic acid. Each group was further divided into three subgroups for testing at 2, 6 and 12 h after injection. Pathological changes in the pancreas were scored, and expression of ICAM-1 and TGF-β1 proteins in the pancreas was detected by immunohistochemistry.
RESULTS: Compared to the model group, pancreatic damage was significantly mitigated in the treatment group at 6 and 12 h (10.33 ± 0.82 vs 14.00 ± 0.63; 9.67 ± 0.82 vs 15.33 ± 0.52; both P = 0.000); the expression of ICAM-1 decreased significantly at 12 h (3.67 ± 0.76 vs 6.40 ± 0.72, P = 0.000); and the expression of TGF-β1 significantly increased at 6 and 12 h (3.77 ± 0.78 vs 0.60 ± 1.00, P = 0.00; 5.17 ± 1.42 vs 2.23 ± 1.01, both P = 0.000).
CONCLUSION: Jinhuangyidan can significantly improve early pancreatic pathological damage possibly by reducing ICAM-1 expression and increasing TGF-β1 expression in SAP in rats.
- Citation: Zhang XP, Cao LY, Liu SQ, Fu QJ, Guo ZW. Jinhuangyidan down-regulates ICAM-1 expression but up-regulates TGF-β1 expression in severe acute pancreatitis in rats. Shijie Huaren Xiaohua Zazhi 2011; 19(18): 1880-1885
- URL: https://www.wjgnet.com/1009-3079/full/v19/i18/1880.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i18.1880
重症急性胰腺炎(severe acute pancreatitis, SAP)起病急, 进展快, 发病机制尚不清楚. 近年来人们认识到细胞因子在SAP进展过程发挥着重要作用, 在这一过程中, 有细胞间黏附分子-1(intercellular adhesion molecule-1, ICAM-1)、转化生长因子-β1(transforming growth factor-β1, TGF-β1)的参与, 并且二者在炎症性疾病过程中具有一定的关联性[1]. 金黄益胆颗粒具有疏肝理气, 利胆清热, 健脾和胃, 活血化瘀等功效, 对SAP有治疗作用, 但其机制尚不完全清楚, 为此本实验采用大鼠SAP模型, 应用金黄益胆颗粒进行干预, 探讨金黄益胆颗粒对SAP大鼠胰腺组织中ICAM-1、TGF-β1表达的影响.
健康SD♂大鼠54只, 购于北京华阜康生物科技股份有限公司[许可证号: SCXK(京) 2009-0004], 于河北省中西医结合肝胆病研究所动物实验室饲养8 wk, 室温23 ℃±1 ℃, 使用河北联合大学实验动物中心提供的标准普通饲料喂饲, 自由饮水. 大鼠体质量286.16 g±16.50 g.
1.2.1 分组及造模: 大鼠54只, 随机分为对照组、模型组及治疗组, 每组18只, 各组又分为2、6及12 h 3个时间组, 每个时间组6只大鼠. SAP模型制备参照Aho法[2], 并置入空肠营养管. 模型组大鼠经空肠营养管给予生理盐水10 mL/kg, 1次/6 h, 治疗组给予25%金黄益胆颗粒溶液10 mL/kg, 1次/6 h, 对照组大鼠开腹后在空气中暴露3 min后关腹.
1.2.2 标本采集: 分别于预定时间段开腹, 取大鼠胰腺组织, 常规HE染色, 行镜下病理评分[3].
1.2.3 免疫组织化学法: 免疫组织化学(SP两步法)检测胰腺组织ICAM-1、TGF-β1的表达. ICAM-1、TGF-β1兔抗鼠多克隆一抗工作液浓度为1:50, 二抗工作液采用过氧化物酶标记的链酶卵白素染色试剂盒.
1.2.4 免疫组织化学结果判断: 随机观察 5个高倍视野(40×10), 分别判断阳性细胞率积分(N): 0分, <5%; 1分, <5%-9%; 2分, 10%-19%; 3分, 20%-50%; 4分, >50%; 及阳性细胞着色强度(F):细胞质或胞核染色以均匀一致的淡黄色为0分; 稍深的点线状着色为1分; 散在棕色点线状着色折旋光性较弱为2分; 棕色点线状着色、折光强为3分; 广泛棕褐色短棒状着色、颗粒样着色、折旋光性强为4分; 最终阳性积分(T): T = N+F.
统计学处理 实验数据应用SPSS13.0软件包进行统计分析. 数据用mean±SD表示, 采用方差分析, P<0.05为差异有统计学意义.
模型组与治疗组均有不同程度充血、水肿、炎症细胞浸润、小叶结构破坏及坏死, 治疗组6、12 h胰腺病理损害程度有所减轻, 差异有明显显著性(P<0.01, 表1, 图1).
2.2.1 ICAM-1阳性细胞的表达: 对照组胰腺组织中无或仅有少量ICAM-1阳性细胞表达. 模型组和治疗组各时间段均可见ICAM-1阳性细胞表达于血管内皮细胞及胰腺腺泡细胞, 治疗组12 h后ICAM-1阳性细胞表达明显减少, 差异有明显显著性(P<0.01, 表2, 图2).
2.2.2 TGF-β1阳性细胞的表达: 对照组大鼠胰腺组织无TGF-β1阳性细胞表达. 模型组与治疗组各时间段均可见胰腺腺泡细胞内有TGF-β1表达, 并进行性增高. 治疗组各时间段TGF-β1表达明显增强, 以12 h后最显著性(P<0.01, 表3, 图3).
SAP发病急、进展快、病情重, 常并发全身炎症反应综合征(systemic inflammatory response syndrome, SIRS)和多器官功能障碍综合征(multiple organ dysfunction syndrome, MODS)[4,5], 严重威胁着患者的生命. 由于SAP的发病机制尚不清楚, 患者死亡率高, 因此带来沉重的社会和经济负担[6]. 目前大量研究显示细胞因子在介导SAP局部及全身损伤的过程中发挥着重要作用, 其升高的程度与SAP病情的严重程度相关[7-9], 而抑制细胞因子的产生和释放, 则可以缓解SAP的病情、降低病死率[10]. 虽然针对细胞因子的治疗是有益的, 但是单纯应用特异性的细胞因子抑制剂并没有取得令人满意的效果[11]. 近年来大量实践证明中药可经多途径、多靶点作用于全身各组织、器官, 能够通过调节细胞因子的产生, 减轻胰腺及其他组织、器官的损伤而发挥积极的治疗作用[12-14].
ICAM-1是一种细胞表面跨膜糖蛋白, 他能在多种细胞表面表达, 但以在血管内皮细胞表达最强, 通过介导细胞间和细胞外基质间的黏附, 参与多种炎症反应和免疫过程. 急性胰腺炎(acute pancreatitis, AP)时ICAM-1表达显著上调[15-17]. 中性粒细胞自循环血液中游出并在炎症区域募集, 是AP时胰腺损伤及导致MODS的中心环节, 而ICAM-1在介导中性粒细胞稳定黏附和穿越内皮细胞, 并向炎症区游出、募集过程中起重要作用[18,19]. 有研究显示ICAM-1的表达水平与SAP病情相关[20,21]. SAP时肺组织中ICAM-1的高表达可以导致急性肺损伤, 肠黏膜中表达过高损伤肠道黏膜屏障功能, 引起肠道细菌移位, 并导致肠源性内毒素血症的发生[22]. 此外, ICAM-1诱导的白细胞-内皮细胞相互作用可导致或加胰腺重微循环障碍. 许多研究均提示中药可以通过抑制ICAM-1表达进而减轻SAP的病理损害程度. 李青[23]认为大黄可以降低AP患者血清C-反应蛋白和ICAM-1表达水平而缓解病情. Xiping等[24]认为丹参可以通过抑制ICAM-1、TLR4及NF-κB的表达进而达对SAP的治疗作用. 本研究提示治疗组大鼠胰腺组织的病理损害程度减轻、ICAM-1的表达降低, 提示金黄益胆颗粒能够降低SAP大鼠胰腺组织ICAM-1的表达, 抑制炎症反应.
机体组织细胞在受到损伤的同时存在着对抗损伤及自我修复的机制. TGF-β1是细胞生长的双向调节剂, 能调节细胞生长、分化、基质产生和凋亡. 多项研究提示细胞因子TGF-β1可能参与AP自身再生修复机制[25]. Friess等[26]研究发现TGF-β1可能通过自分泌和旁分泌形式刺激并结合特异性信号受体TGFβ-RI和TGFβ-RII, 参与AP后胰腺组织的修复和再生过程. TGF-β1趋化成纤维细胞、单核细胞向损伤部位迁移, 进而促使这些细胞产生和分泌TGF-β1和胞外基质成分, 参与胰腺修复和再生的发生、发展. 此外, TGF-β1能抑制淋巴细胞增殖, 拮抗炎症性细胞因子对免疫相关细胞的作用, 抑制单核细胞合成、释放致炎症介质, 如TNF-α、IL-1、IL-6, 且呈明显的量效关系[27], 并与AP时胰腺细胞的凋亡相关[28]. 有研究显示大黄可能通过诱导细胞因子TGF-β1基因表达增强, 增加胰组织DNA合成和蛋白含量, 参与胰腺组织的再生和修复[29]. 复方丹参可以影响急性坏死性胰腺炎时TGF-β1的产生[30]. 本研究结果显示: 模型组与治疗组各时间段均可见胰腺腺泡细胞及导管上皮细胞内有TGF-β1表达, 但治疗组各时间段TGF-β1表达明显增强, 以12 h后最显著性, 提示金黄益胆颗粒可通过升高TGF-β1的表达, 抑制炎症反应并实现胰腺组织的自我修复.
金黄益胆颗粒(原胆胰和胃冲剂)为河北省中西医结合肝胆病研究所郭振武教授等根据肝、胆、胰疾病既有少阳之邪, 又有阳明之实, 以"大柴胡汤"为基础, 运用现代科学技术, 对其进行药理分析, 筛选与加减组方研制而成. 其主要组成为: 大黄、黄连、黄芩、柴胡、枳壳、香附、木香、郁金、金钱草、陈皮及元胡等11味中药, 具有疏肝理气, 利胆清热, 健脾和胃, 活血化瘀等综合功效. 方中大黄、柴胡等具有抑制胰酶分泌、降低胆道压力、保护肠黏膜功能、防止肠道内细菌移位、同时调控炎症介质的产生与释放、活血化瘀、提高机体免疫力等作用. 大黄可以降低SAP时血清ICAM-1的表达水平[23], 升高TGF-β1的表达[29]. 黄芩的主要成分黄芩苷可抑制IL-1β诱导的ICAM-1的表达[31].
前期研究证实, 金黄益胆颗粒可降低SAP时TNF-α、IL-6、MDA、ET等损伤性因子, 升高SOD、sIg-A等保护性因子, 增强肠黏膜氧自由基清除能力, 提高肠黏膜免疫机能, 减少细菌移位的发生和内毒素的释放[32,33]. 胃肠道功能衰竭是MODS的始动器官, 胃肠道功能的维护与调治是防治MODS的重要措施与环节, 而金黄益胆颗粒能有效地促进胃肠道功能的恢复, 防止胃肠道功能的衰竭[34]. SAP时产生的大量氧自由基激活NF-κB, 导致TNF-α表达增加, TNF-α通过上调ICAM-1表达, 使炎症细胞在组织局部大量聚集, 从而引发胰腺局部及胰外器官损伤[35]. 金黄益胆颗粒可经多途径、多靶点作用于全身各组织器官, 通过降低氧自由基及TNF-α等促炎因子的表达, 进而减少ICAM-1的生成, 升高TGF-β1的表达, 抑制炎症反应, 促进受损的胰腺组织自我修复, 达到对SAP的治疗作用.
感谢李英俊、张瑞霞、张永健、马向明、华克雷及赵立新同志在本实验中给予的大力帮助.
重症急性胰腺炎(SAP)起病急、进展快、病情重、死亡率高, 但其发病机制尚不完全清楚. 近年来各种学说均有不同程度的进展, 尤其是细胞因子学说为目前研究的热点. 在针对SAP的治疗中, 中药以其独特的优势备受关注.
陈建杰, 主任医师, 上海中医药大学附属曙光医院(东部)肝病科
李青认为大黄可以降低AP患者血清C-反应蛋白和ICAM-1表达水平. Xiping等认为丹参可以通过抑制ICAM-1、TLR4及NF-κB的表达进而达对SAP时多器官的保护、治疗作用.
本研究以本课题组自行研制的具有国家专利的新药: 金黄益胆颗粒为干预因素, 观察其对SAP的治疗作用, 并探讨其作用机制.
本研究进一步丰富了金黄益胆颗粒治疗重症急性胰腺炎的作用机制, 为其临床应用奠定了理论基础.
本文实验设计合理可靠, 结果可信, 具有一定的科学性和创新性.
编辑: 曹丽鸥 电编:何基才
| 1. | 张 三元. TGF-β及ICAM-1在泌尿生殖道炎症组织中的表达及两者关联性分析. 中国中西医结合肾病杂志. 2008;9:720-721. |
| 2. | Aho HJ, Koskensalo SM, Nevalainen TJ. Experimental pancreatitis in the rat. Sodium taurocholate-induced acute haemorrhagic pancreatitis. Scand J Gastroenterol. 1980;15:411-416. [PubMed] [DOI] |
| 3. | Schmidt J, Rattner DW, Lewandrowski K, Compton CC, Mandavilli U, Knoefel WT, Warshaw AL. A better model of acute pancreatitis for evaluating therapy. Ann Surg. 1992;215:44-56. [PubMed] [DOI] |
| 4. | Chan YC, Leung PS. Acute pancreatitis: animal models and recent advances in basic research. Pancreas. 2007;34:1-14. [PubMed] [DOI] |
| 5. | Sun B, Dong CG, Wang G, Jiang HC, Meng QH, Li J, Liu J, Wu LF. [Analysis of fatal risk factors for severe acute pancreatitis: a report of 141 cases]. Zhonghua Waike Zazhi. 2007;45:1619-1622. [PubMed] |
| 6. | Bai Y, Liu Y, Jia L, Jiang H, Ji M, Lv N, Huang K, Zou X, Li Y, Tang C. Severe acute pancreatitis in China: etiology and mortality in 1976 patients. Pancreas. 2007;35:232-237. [PubMed] [DOI] |
| 7. | Perejaslov A, Chooklin S, Bihalskyy I. Implication of interleukin 18 and intercellular adhesion molecule (ICAM)-1 in acute pancreatitis. Hepatogastroenterology. 2008;55:1806-1813. [PubMed] |
| 8. | Martín MA, Saracíbar E, Santamaría A, Arranz E, Garrote JA, Almaraz A, del Olmo ML, García-Pajares F, Fernández-Orcajo P, Velicia R. [Interleukin 18 (IL-18) and other immunological parameters as markers of severity in acute pancreatitis]. Rev Esp Enferm Dig. 2008;100:768-773. [PubMed] |
| 9. | Zyromski NJ, Mathur A, Pitt HA, Lu D, Gripe JT, Walker JJ, Yancey K, Wade TE, Swartz-Basile DA. A murine model of obesity implicates the adipokine milieu in the pathogenesis of severe acute pancreatitis. Am J Physiol Gastrointest Liver Physiol. 2008;295:G552-G558. [PubMed] [DOI] |
| 10. | Bhatia M, Hegde A. Treatment with antileukinate, a CXCR2 chemokine receptor antagonist, protects mice against acute pancreatitis and associated lung injury. Regul Pept. 2007;138:40-48. [PubMed] [DOI] |
| 11. | Rau BM, Krüger CM, Schilling MK. Anti-cytokine strategies in acute pancreatitis: pathophysiological insights and clinical implications. Rocz Akad Med Bialymst. 2005;50:106-115. [PubMed] |
| 17. | Sun W, Watanabe Y, Wang ZQ. Expression and significance of ICAM-1 and its counter receptors LFA-1 and Mac-1 in experimental acute pancreatitis of rats. World J Gastroenterol. 2006;12:5005-5009. [PubMed] |
| 18. | Hartwig W, Werner J, Warshaw AL, Antoniu B, Castillo CF, Gebhard MM, Uhl W, Büchler MW. Membrane-bound ICAM-1 is upregulated by trypsin and contributes to leukocyte migration in acute pancreatitis. Am J Physiol Gastrointest Liver Physiol. 2004;287:G1194-G1199. [PubMed] [DOI] |
| 22. | van Minnen LP, Blom M, Timmerman HM, Visser MR, Gooszen HG, Akkermans LM. The use of animal models to study bacterial translocation during acute pancreatitis. J Gastrointest Surg. 2007;11:682-689. [PubMed] [DOI] |
| 23. | 李 青. 大黄对重症急性胰腺炎患者血清C反应蛋白和细胞间黏附分子-1的影响. 实用临床医学(江西). 2010;11:18-20, 22. |
| 24. | Xiping Z, Dijiong W, Jianfeng L, Qihui C, Jing Y, Penghui J, Meijuan Y, Ninni Z. Effects of Salvia miltiorrhizae on ICAM-1, TLR4, NF-kappaB and Bax proteins expression in multiple organs of rats with severe acute pancreatitis or obstructive jaundice. Inflammation. 2009;32:218-232. [PubMed] [DOI] |
| 25. | Konturek PC, Dembiński A, Warzecha Z, Ceranowicz P, Konturek SJ, Stachura J, Hahn EG. Expression of transforming growth factor-beta 1 and epidermal growth factor in caerulein-induced pancreatitis in rat. J Physiol Pharmacol. 1997;48:59-72. [PubMed] |
| 26. | Friess H, Lu Z, Riesle E, Uhl W, Bründler AM, Horvath L, Gold LI, Korc M, Büchler MW. Enhanced expression of TGF-betas and their receptors in human acute pancreatitis. Ann Surg. 1998;227:95-104. [PubMed] [DOI] |
| 27. | Hawkins DL, MacKay RJ, MacKay SL, Moldawer LL. Human interleukin 10 suppresses production of inflammatory mediators by LPS-stimulated equine peritoneal macrophages. Vet Immunol Immunopathol. 1998;66:1-10. [PubMed] [DOI] |
| 28. | Nagashio Y, Ueno H, Imamura M, Asaumi H, Watanabe S, Yamaguchi T, Taguchi M, Tashiro M, Otsuki M. Inhibition of transforming growth factor beta decreases pancreatic fibrosis and protects the pancreas against chronic injury in mice. Lab Invest. 2004;84:1610-1618. [PubMed] [DOI] |
| 30. | 许 利剑, 张 明顺, 汪 宝林. 复方丹参对实验性急性坏死性胰腺炎细胞因子的影响. 南京医科大学学报(自然科学版). 2008;28:71-74. |
| 32. | 曹 立瀛, 刘 四清, 王 保强, 李 勇, 郭 振武. 胆胰和胃冲剂对大鼠急性胰腺炎早期小肠粘膜抗氧化损伤的保护. 中国中西医结合外科杂志. 2002;8:150-152. |
| 33. | 安 新, 郭 振武. 胆胰和胃冲剂抗自由基损害的临床观察. 中国中西医结合外科杂志. 2000;6:247-248. |
| 34. | 王 文鸽, 刘 四清, 曹 立瀛, 付 庆江. 中西医结合治疗胆源性急性胰腺炎72例. 中国中医基础医学杂志. 2008;14:717-718. |