修回日期: 2011-06-18
接受日期: 2011-06-21
在线出版日期: 2011-06-28
目的: 研究在人肝细胞L-02中乙型肝炎病毒X蛋白(HBx)对环氧化酶2(COX-2)表达的影响.
方法: 构建HBx基因表达载体pIRES2-AcGFP-HBx, 转染入人肝细胞L-02中, RT-PCR和Western blot检测HBx对COX-2表达的影响; 通过细胞生长曲线和细胞周期变化, 检测HBx蛋白对细胞分裂增殖的作用. 同时将含有COX-2启动子核心片段的荧光素酶报告载体pGL3-COX-2转染入上述转染细胞, 检测细胞荧光素酶荧光值以观察HBx蛋白对COX-2启动子活性的影响.
结果: RT-PCR结果显示仅在HBx基因转染组细胞中有HBx mRNA的表达, 且该组细胞中COX-2 mRNA相对表达量显著高于空载体对照组和空白对照组(0.76±0.12 vs 0.28±0.04, 0.25±0.03, 均P<0.01); Western blot结果显示, 仅HBx基因转染组可见HBx蛋白有明显印迹条带, 且该组细胞中COX-2蛋白免疫印迹较两对照组深; 细胞生长曲线测定表明HBx基因转染组细胞在第3、4、5天的生长较两对照组显著加快(P<0.05); 细胞周期测定显示与两对照组相比, HBx基因转染组G0-G1期比例显著降低, S期和G2-M期比例显著增加(P<0.05). HBx基因转染组COX-2启动子荧光素酶荧光值显著高于空载体对照组和空白对照组(1 675.2± 84.9 vs 657.7± 34.7, 739.3± 45.3, 均P<0.05).
结论: HBx蛋白可增强人肝L-02细胞中COX-2的表达水平, 对L-02细胞分裂增殖、生长有明显促进作用; HBx蛋白可通过提高COX-2启动子的活性以增强COX-2的表达.
引文著录: 靳梦杰, 刘慧涛, 赵国强. 乙型肝炎病毒X蛋白对人肝L-02细胞中COX-2表达的影响. 世界华人消化杂志 2011; 19(18): 1874-1879
Revised: June 18, 2011
Accepted: June 21, 2011
Published online: June 28, 2011
AIM: To investigate the effect of hepatitis B virus X protein (HBx) on COX-2 expression in human liver cell line L-02.
METHODS: HBx expression vector pIRES2-AcGFP-HBx was constructed and transfected into L-02 cells. The expression of COX-2 mRNA and protein was detected by RT-PCR and Western blot, respectively. The effect of HBx protein on cell division and proliferation was evaluated by plotting cell growth curve and analyzing cell cycle. Moreover, pGL3-COX-2 plasmid, in which the COX-2 promoter has been linked to the luciferase reporter gene, was transfected into L-02 cells and luciferase activities were measured.
RESULTS: RT-PCR results revealed that HBx mRNA was expressed only in cells transfected with the HBx gene, and that COX-2 mRNA expression in cells transfected with the HBx gene was higher than that in cells untranfected or transfected with an empty vector (0.76 ± 0.12 vs 0.28 ± 0.04, 0.25 ± 0.03, both P < 0.01). Western blot analysis showed that HBx protein was expressed only in cells transfected with the HBx gene, and COX-2 protein expression in this group was higher than that in the two control groups. The proliferation of cells transfected with the HBx gene was faster than that of control cells (both P < 0.05). The numbers of cells in S and G2-M phases significantly increased while those in G0-G1 phase decreased in cells transfected with the HBx gene compared to control cells (all P < 0.05). The luciferase activity in cells transfected with the HBx gene was higher than that in control cells (1 675.2 ± 84.9 vs 657.7 ± 34.7, 739.3 ± 45.3, both P < 0.05).
CONCLUSION: HBx protein can enhance COX-2 expression by up-regulating the activity of COX-2 promoter and promote cell growth, division and proliferation in human liver cell line L-02.
- Citation: Jin MJ, Liu HT, Zhao GQ. Hepatitis B virus X protein enhances COX-2 expression in human liver cell line L-02. Shijie Huaren Xiaohua Zazhi 2011; 19(18): 1874-1879
- URL: https://www.wjgnet.com/1009-3079/full/v19/i18/1874.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i18.1874
乙型肝炎病毒(hepatitis B virus, HBV)感染不仅可引起急、慢性肝炎, 而且与肝硬化、肝癌的发生密切相关. HBV含4个开放读码框, 即S、C、P和X, 其中X基因与HBV的致癌作用密切, 可编码17 000 Da的X蛋白, 即HBx蛋白(hepatitis B virus x protein, HBx), 能导致肝细胞癌的发生[1], 具有反式激活功能, 可调节细胞凋亡、抑制细胞DNA的修复、干扰细胞有丝分裂和细胞周期进程等. 环氧化酶(cyclooxygenase, COX)是前列腺素(prostaglandin, PGs)合成过程中的限速酶, 包括两种同工酶COX-1和COX-2, 可将花生四烯酸转变为PGH2[2,3]. COX-1在大多数细胞中持续表达, 参与维持机体的正常生理功能, 而COX-2在正常组织中通常不表达, 只在受促有丝分裂原、细胞因子和其他因素刺激的细胞中才被诱导表达[4]. 近年发现, 花生四烯酸代谢产物与肿瘤发生密切相关[5-10]. 在HBV阳性的慢性肝炎、肝硬化和肝癌患者肝组织中COX-2的表达明显高于正常组织或癌旁正常组织, 且与HBx蛋白促肝癌转移作用有关[11], 提示COX-2过度表达在HBV致病过程中起一定作用. 为进一步阐明COX-2在HBx蛋白诱发肝癌过程中的作用, 本研究首先将HBx基因转染入人肝细胞L-02细胞观察HBx蛋白对L-02细胞中COX-2表达及细胞生长曲线、细胞周期的影响; 同时将COX-2启动子的荧光素酶报告基因表达载体转染入上述HBx基因转染细胞中, 以期为HBx促进COX-2表达的机制提供一些实验依据.
pIRES2-AcGFP载体(Clontech公司); pGL3-Control报告基因载体, E1500荧光检测试剂盒(Promega公司); 含有COX-2启动子核心片段的荧光素酶报告载体pGL3-COX-2(美国NIH职慧军博士惠赠); 脂质体LipofectamineTM 2000, G418(Invitrogen公司); 鼠抗人COX-2单克隆抗体、辣根过氧化物酶标记的山羊抗鼠抗体(Santa Cruz公司); 人肝细胞L-02(中国科学院上海细胞库); 本实验所用引物(表1)均由上海生工公司合成, HBx扩增引物的上下游分别添加BglⅡ(AGATCT)和EcoRⅠ(GAATTC)酶切位点.
| 引物 | 碱基序列 | 扩增片段(bp) |
| HBx | HBV-F 5'ACAAGATCTATGGCTGCTAGGCTGTGCT3' | |
| HBV-R 5'ATCGAATTCTTAGGCAGAGGGGAAAAAGT3' | 465 | |
| COX-2 | COX-F 5'GGAGACCAGCAAGTATTGTCC3' | |
| COX-R 5'GACCATTCCTTCTCCAGGTAT3' | 517 | |
| β-actin | B-F 5'TATCCCTGTACGCCTCTGGC3' | |
| B-R 5'AGTCCAGGGCGACGTAGCAC3' | 249 |
1.2.1 HBx基因的扩增及克隆: 以HBsAg(+)、HBeAg(+)、抗HBc(+)患者全血中的HBV DNA为模板用引物HBV-F/HBV-R进行PCR扩增HBx序列, 扩增产物用BglⅡ/ EcoRⅠ双酶切, 胶回收纯化, T4连接酶将其与线性双黏载体pIRES2-AcGFP连接, 常规方法转化, 对重组子pIRES2-AcGFP-HBx进行PCR鉴定及双酶切鉴定, 并送上海生工公司测序分析.
1.2.2 细胞转染: 按照LipofectamineTM操作说明书, 脂质体包裹重组质粒pIRES2-AcGFP-HBx转染L-02细胞(HBx基因转染组), G418筛选阳性克隆(筛选浓度800 mg/L, 稳定转染后细胞扩大培养时浓度200 mg/L); 另设转染载体pIRES2-AcGFP的细胞为空载体对照组、未转染细胞为空白对照组.
1.2.3 RT-PCR检测HBx、COX-2的表达: 上述3组细胞分别提取mRNA并逆转录为cDNA后, 分别以HBx、COX-2和β-actin的引物PCR扩增, 以HBx/COX-2基因和β-actin内参照基因电泳条带吸光度值的比值, 作为HBx/COX-2 mRNA相对表达量.
1.2.4 Western blot检测HBx、COX-2的表达: 上述3组细胞转染48 h后收集蛋白, 用BCA测定蛋白浓度; SDS-PAGE电泳后转醋酸纤维膜, 鼠抗人COX-2单克隆抗体为一抗(1:200), 辣根过氧化物酶标记的山羊抗鼠IgG为二抗(1:3 000), 化学发光法检测.
1.2.5 细胞生长曲线: 上述3组细胞分别接种96孔培养板, 接种后1-7 d内采用MTT方法, 分别测定各孔吸光度(A)值, 每组细胞均设置5个复孔, 结果均取平均值.
1.2.6 细胞周期: 取相同数量的各组细胞, 乙醇固定后PI染色, 用300目尼龙网过滤样品后上机测试, 采用Cell Quest软件分析图像.
1.2.7 HBx蛋白对COX-2基因启动子的影响: 脂质体包裹pGL3-COX-2和pGL3-Control荧光素酶报告基因质粒, 分别转染HBx基因转染组、空载体对照组和空白对照组细胞; 按照E1500荧光检测试剂盒说明书进行操作, Glomex荧光检测仪分别检测各组细胞的荧光素酶荧光值.
统计学处理 各组数据均采用SPSS12.0统计软件进行单因素方差分析, 检验标准以P<0.05为差异有显著性, P<0.01为差异有非常显著性.
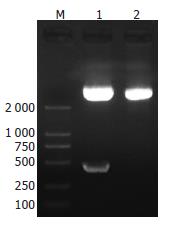
对HBV DNA以HBV-F/HBV-R为引物PCR后, 扩增产物电泳可见465 bp处有明亮条带, 与目的基因HBx一致; 用BglⅡ/EcoRⅠ双酶切重组子pIRES2-AcGFP-HBx后电泳可见465 bp片段, 与插入目的基因一致(图1); 测序结果表明该插入序列与GenBank中HBx序列完全一致.
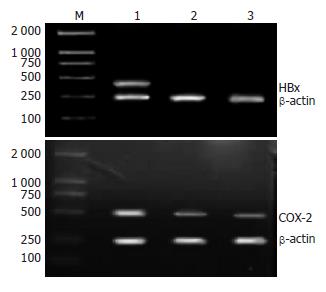
RT-PCR结果表明仅在HBx基因转染组细胞中有HBx mRNA的表达, 且该组细胞中COX-2 mRNA相对表达量高于空载体对照组和空白对照组, 统计学分析差异非常显著(0.76±0.12 vs 0.28±0.04, 0.25±0.03, P<0.01), 说明在HBx mRNA表达的L-02细胞中COX-2 mRNA表达显著升高(图2).
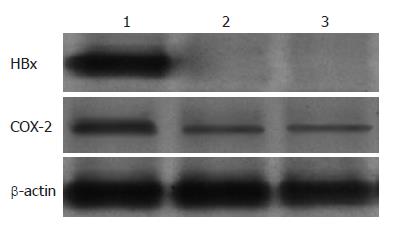
HBx基因转染组可见HBx蛋白有明显印迹条带, 说明pIRES2-AcGFP-HBx已成功转染入L-02细胞, 且HBx蛋白高效表达, 而空载体对照组和空白对照组未见HBx蛋白印迹条带. 3组细胞均可见COX-2蛋白免疫印迹, 但以HBx基因转染组COX-2蛋白免疫印迹最深(图3), 说明在HBx蛋白表达的L-02细胞中COX-2蛋白表达显著升高.
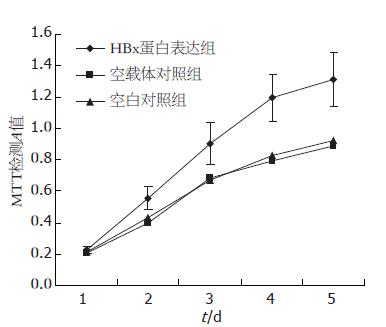
HBx基因转染组细胞在第3、4、5天生长显著加快, 与空载体对照组和空白对照组测定结果比较差异均有显著性(P<0.05), 说明HBx的转染使COX-2蛋白表达升高后对L-02细胞生长有显著促进作用(图4).
空载体对照组与空白对照组经统计学分析差异无显著性(P>0.05); 而HBx基因转染组与2个对照组比较, G0-G1期比例显著降低, S期和G2-M期比例显著增加, 差性有显著性(P<0.05, 表2), 说明HBx蛋白可促进L-02细胞分裂增殖.
HBx基因转染组COX-2启动子荧光素酶荧光值高于空载体对照组和空白对照组, 统计学分析差异显著(1 675.2±84.9 vs 657.7±34.7, 739.3±45.3, P<0.05), 表明HBx蛋白对COX-2启动子活性有显著提高作用.
流行病学和分子生物学研究表明长期HBV慢性感染是导致肝细胞肝癌的一个主要因素[12,13]. HBV基因组DNA有4个部分重叠的开放读框(S、C、P和X), 其中X开放读框编码的HBx在肝细胞肝癌的发生发展中起着重要作用[14-16].
HBx参与HBV的复制, 是具有反式激活作用的多功能转录调节因子, 能阻断抑癌基因p53的功能, 可通过激活癌基因与细胞因子基因启动子而调节细胞的生长、分化[17-19]; 通过RNA干扰降低肝癌细胞HBX表达水平, 可明显抑制肝癌细胞的增殖, 改变细胞生长周期[20-22]. 但HBx促进肝癌发生的详细机制尚存不明之处. 近来发现, 花生四烯酸代谢产物与肿瘤的发生存在有密切的联系[5-7], COX-2作为花生四烯酸三类代谢酶中的一种[23], 在许多肿瘤细胞中过表达, 与肿瘤的发生、发展、浸润、转移密切相关, 在肝炎、肝硬变和肝癌组织中表达水平上调[24,25], 与HBx蛋白促进肝癌增殖、转移作用相关[11,26-28]. 多项研究结果表明COX-2的特异性抑制剂可有效地降低肿瘤的发生和转移[11,29-31].
为研究COX-2在HBx诱导肝癌中的作用, 本研究将HBx基因的重组载体pIRES2-AcGFP-HBx转染到了肝细胞L-02中, RT-PCR和Westren blot结果表明HBx基因转染细胞中COX-2基因的mRNA和蛋白表达均显著增加, 细胞生长加速, S期和G2-M期比例显著增加, 表明HBx蛋白可通过加强COX-2基因的表达促进细胞的分裂增殖和生长. 与Benn等[32]报道HBx基因可下调肝细胞的G0/G1和G2/M检测点状态, 促进细胞增殖, 以及Madden等[33]报道HBx可以提高细胞周期依赖激酶CDK2和CDC2的活性水平相一致, 并与Wang等[34]报道稳定转染HBX基因的肝癌细胞H7402-X中COX-2基因表达明显上调的结果相符.
但是HBx蛋白促进COX-2基因的表达的机制未明, 由于启动子对基因的表达起重要作用, 那么是否HBx可通过提高COX-2启动子活性增强其表达? 为此本研究将含COX-2启动子的荧光素酶报告基因表达载体转染入了HBx转染细胞, 通过检测报告基因荧光素酶的荧光素值可敏感地反映COX-2启动子的活性, 结果显示HBx蛋白对COX-2启动子活性有显著提高作用, 表明提高COX-2启动子活性是HBx蛋白使其表达增强的机制之一, 继而通过COX-2所介导的花生四烯酸代谢可促进肝癌细胞和肝细胞增殖, 从而在肝癌细胞的发生发展中发挥重要作用.
HBV感染与肝癌的发生密切相关. HBx蛋白在肝癌的发生发展中起着重要的作用, 参与肝细胞的增殖和转化. COX-2在HBV阳性的慢性肝炎、肝硬化和肝癌患者肝组织中表达明显高于正常组织或癌旁正常组织, 与HBx蛋白促肝癌转移作用有关, 提示COX-2过度表达在HBV致病过程中起一定作用. HBx可能以某种或某些机制影响COX-2的表达.
胡国信, 副教授, 南昌大学第一附属医院感染内科
HBx参与HBV的复制, 是具有反式激活作用的多功能转录调节因子, 能阻断抑癌基因p53的功能, 可通过激活癌基因与细胞因子基因启动子而调节细胞的生长、分化; 通过RNA干扰降低肝癌细胞HBX表达水平, 可明显抑制肝癌细胞的增殖, 改变细胞生长周期. 但HBx促进肝癌发生的详细机制尚存不明之处.
Benn等报道HBx基因可下调肝细胞的G0/G1和G2/M检测点状态, 促进细胞增殖; Madden等报道HBx可以提高细胞周期依赖激酶CDK2和CDC2的活性水平; Wang等报道稳定转染HBx基因的肝癌细胞H7402-X中COX-2基因表达明显上调, 这些均与本研究结果一致.
本研究证实HBx蛋白可通过提高COX-2启动子的活性这种机制增强人肝L-02细胞中COX-2的表达水平, 并对L-02细胞分裂增殖、生长有明显促进作用.
本文数据可信, 内容详实, 其科学性、创新性和可读性基本能反映我国肝病临床和基础研究的先进水平.
编辑: 李薇 电编:何基才
| 2. | Rahman MA, Dhar DK, Yamaguchi E, Maruyama S, Sato T, Hayashi H, Ono T, Yamanoi A, Kohno H, Nagasue N. Coexpression of inducible nitric oxide synthase and COX-2 in hepatocellular carcinoma and surrounding liver: possible involvement of COX-2 in the angiogenesis of hepatitis C virus-positive cases. Clin Cancer Res. 2001;7:1325-1332. [PubMed] |
| 3. | Dansako H, Naganuma A, Nakamura T, Ikeda F, Nozaki A, Kato N. Differential activation of interferon-inducible genes by hepatitis C virus core protein mediated by the interferon stimulated response element. Virus Res. 2003;97:17-30. [PubMed] [DOI] |
| 4. | Murakami M, Matsumoto R, Austen KF, Arm JP. Prostaglandin endoperoxide synthase-1 and -2 couple to different transmembrane stimuli to generate prostaglandin D2 in mouse bone marrow-derived mast cells. J Biol Chem. 1994;269:22269-22275. [PubMed] |
| 5. | Lim K, Han C, Xu L, Isse K, Demetris AJ, Wu T. Cyclooxygenase-2-derived prostaglandin E2 activates beta-catenin in human cholangiocarcinoma cells: evidence for inhibition of these signaling pathways by omega 3 polyunsaturated fatty acids. Cancer Res. 2008;68:553-560. [PubMed] [DOI] |
| 6. | Pidgeon GP, Lysaght J, Krishnamoorthy S, Reynolds JV, O'Byrne K, Nie D, Honn KV. Lipoxygenase metabolism: roles in tumor progression and survival. Cancer Metastasis Rev. 2007;26:503-524. [PubMed] [DOI] |
| 7. | Nassar A, Radhakrishnan A, Cabrero IA, Cotsonis G, Cohen C. COX-2 expression in invasive breast cancer: correlation with prognostic parameters and outcome. Appl Immunohistochem Mol Morphol. 2007;15:255-259. [PubMed] [DOI] |
| 8. | Kim JG, Chae YS, Sohn SK, Moon JH, Ryoo HM, Bae SH, Kum Y, Jeon SW, Lim KH, Kang BM. Prostaglandin synthase 2/cyclooxygenase 2 (PTGS2/COX2) 8473T& gt; C polymorphism associated with prognosis for patients with colorectal cancer treated with capecitabine and oxaliplatin. Cancer Chemother Pharmacol. 2009;64:953-960. [PubMed] [DOI] |
| 9. | Abril J, de Heredia ML, González L, Clèries R, Nadal M, Condom E, Aguiló F, Gómez-Zaera M, Nunes V. Altered expression of 12S/MT-RNR1, MT-CO2/COX2, and MT-ATP6 mitochondrial genes in prostate cancer. Prostate. 2008;68:1086-1096. [PubMed] [DOI] |
| 10. | Hou L, Grillo P, Zhu ZZ, Lissowska J, Yeager M, Zatonski W, Zhu G, Baccarelli A, Chanock SJ, Fraumeni JF. COX1 and COX2 polymorphisms and gastric cancer risk in a Polish population. Anticancer Res. 2007;27:4243-4247. [PubMed] |
| 11. | Lara-Pezzi E, Gómez-Gaviro MV, Gálvez BG, Mira E, Iñiguez MA, Fresno M, Martínez-A C, Arroyo AG, López-Cabrera M. The hepatitis B virus X protein promotes tumor cell invasion by inducing membrane-type matrix metalloproteinase-1 and cyclooxygenase-2 expression. J Clin Invest. 2002;110:1831-1838. [PubMed] |
| 12. | Assrir N, Soussan P, Kremsdorf D, Rossignol JM. Role of the hepatitis B virus proteins in pro- and anti-apoptotic processes. Front Biosci. 2010;15:12-24. [PubMed] [DOI] |
| 14. | Hou Z, Liu G, Zheng F, Tan D. HBx gene inducing hepatocellular carcinoma in vivo and its mechanism. Zhongnan Daxue Xuebao Yixueban. 2009;34:282-288. [PubMed] |
| 15. | Wei W, Huang W, Pan Y, Zhu F, Wu J. Functional switch of viral protein HBx on cell apoptosis, transformation, and tumorigenesis in association with oncoprotein Ras. Cancer Lett. 2006;244:119-128. [PubMed] [DOI] |
| 16. | Feitelson MA, Lee J. Hepatitis B virus integration, fragile sites, and hepatocarcinogenesis. Cancer Lett. 2007;252:157-170. [PubMed] [DOI] |
| 17. | Park US, Park SK, Lee YI, Park JG, Lee YI. Hepatitis B virus-X protein upregulates the expression of p21waf1/cip1 and prolongs G1--> S transition via a p53-independent pathway in human hepatoma cells. Oncogene. 2000;19:3384-3394. [PubMed] [DOI] |
| 18. | Chan DW, Ng IO. Knock-down of hepatitis B virus X protein reduces the tumorigenicity of hepatocellular carcinoma cells. J Pathol. 2006;208:372-380. [PubMed] [DOI] |
| 19. | Liu Q, Chen J, Liu L, Zhang J, Wang D, Ma L, He Y, Liu Y, Liu Z, Wu J. The X protein of hepatitis B virus inhibits apoptosis in hepatoma cells through enhancing the methionine adenosyltransferase 2A gene expression and reducing S-adenosylmethionine production. J Biol Chem. 2011;286:17168-17180. [PubMed] [DOI] |
| 21. | Shin D, Kim SI, Kim M, Park M. Efficient inhibition of hepatitis B virus replication by small interfering RNAs targeted to the viral X gene in mice. Virus Res. 2006;119:146-153. [PubMed] [DOI] |
| 22. | Cheng AS, Wong N, Tse AM, Chan KY, Chan KK, Sung JJ, Chan HL. RNA interference targeting HBx suppresses tumor growth and enhances cisplatin chemosensitivity in human hepatocellular carcinoma. Cancer Lett. 2007;253:43-52. [PubMed] [DOI] |
| 23. | Patel S, Chiplunkar S. Role of cyclooxygenase-2 in tumor progression and immune regulation in lung cancer. Indian J Biochem Biophys. 2007;44:419-428. [PubMed] |
| 24. | Cheng AS, Chan HL, Leung WK, To KF, Go MY, Chan JY, Liew CT, Sung JJ. Expression of HBx and COX-2 in chronic hepatitis B, cirrhosis and hepatocellular carcinoma: implication of HBx in upregulation of COX-2. Mod Pathol. 2004;17:1169-1179. [PubMed] [DOI] |
| 25. | 孙 长宇, 张 贤强, 杨 观瑞. 肝细胞癌组织中乙型肝炎病毒X基因、COX-2及MMP-9的表达. 郑州大学学报(医学版). 2009;44:96-99. |
| 26. | 徐 付卿, 山 长亮, 叶 丽虹, 张 晓东. COX-2在乙肝病毒X蛋白(HBx)促进肝癌细胞和肝细胞增殖中的作用. 中国生物化学与分子生物学报. 2008;24:968-972. |
| 27. | Liu KG, Shao XL, Xie HH, Xu L, Zhao H, Guo ZH, Li L, Liu J. [The expression of hepatitis B virus X protein and cyclooxygenase-2 in hepatitis B virus-related hepatocellular carcinoma: correlation with microangiogenesis and metastasis, and what is the possible mechanism]. Zhonghua Ganzangbing Zazhi. 2010;18:831-836. [PubMed] |
| 28. | Cheng AS, Yu J, Lai PB, Chan HL, Sung JJ. COX-2 mediates hepatitis B virus X protein abrogation of p53-induced apoptosis. Biochem Biophys Res Commun. 2008;374:175-180. [PubMed] [DOI] |
| 29. | Glunde K, Jie C, Bhujwalla ZM. Mechanisms of indomethacin-induced alterations in the choline phospholipid metabolism of breast cancer cells. Neoplasia. 2006;8:758-771. [PubMed] [DOI] |
| 30. | Kundu N, Walser TC, Ma X, Fulton AM. Cyclooxygenase inhibitors modulate NK activities that control metastatic disease. Cancer Immunol Immunother. 2005;54:981-987. [PubMed] [DOI] |
| 31. | Kundu N, Fulton AM. Selective cyclooxygenase (COX)-1 or COX-2 inhibitors control metastatic disease in a murine model of breast cancer. Cancer Res. 2002;62:2343-2346. [PubMed] |
| 32. | Benn J, Schneider RJ. Hepatitis B virus HBx protein deregulates cell cycle checkpoint controls. Proc Natl Acad Sci U S A. 1995;92:11215-11219. [PubMed] [DOI] |
| 33. | Madden CR, Slagle BL. Stimulation of cellular proliferation by hepatitis B virus X protein. Dis Markers. 2001;17:153-157. [PubMed] |
| 34. | Wang FZ, Sha L, Zhang WY, Wu LY, Qiao L, Li N, Zhang XD, Ye LH. Involvement of hepatitis B X-interacting protein (HBXIP) in proliferation regulation of cells. Acta Pharmacol Sin. 2007;28:431-438. [PubMed] [DOI] |