修回日期: 2011-05-18
接受日期: 2011-05-24
在线出版日期: 2011-06-08
目的: 研究模拟高原低压低氧环境下大鼠血清和胃黏膜中Ghrelin表达的变化, 探讨高原环境对消化系统功能的影响.
方法: 30只Sprague-Dawley大鼠随机均分为海平面对照组、3 000和5 000 m模型组; 采用小动物低压舱模拟不同海拔高度, 舱内停留时间为24 h. 应用ELISA方法测定各组动物动血清中Ghrelin的浓度; 用免疫组织化学方法观察大鼠胃黏膜组织中Ghrelin的定位与表达, 并比较各组动物间胃黏膜Ghrelin免疫反应阳性细胞密度的差异.
结果: 与海平面对照组相比, 3 000 m和5 000 m模型组大鼠血清Ghrelin浓度(μg/L)明显低于地面对照组(7.45±1.33, 6.87±1.32 vs 9.31±1.65; P<0.05或0.01). Ghrelin免疫反应阳性细胞分布于大鼠胃腺X/A细胞和内分泌细胞、阳性物质定位于细胞质. 与海平面对照组相比, 3 000 m和5 000 m模型组大鼠胃黏膜Ghrelin阳性细胞密度显著降低(103.9±9.55, 97.7±11.22 vs 119.9±11.96; P<0.01或0.001).
结论: 模拟高原的低压低氧环境可致大鼠血清Ghrelin水平下降, 胃黏膜Ghrelin分泌减少, Ghrelin可能参与模拟低压低氧环境中机体消化功能紊乱的调节.
引文著录: 孙正启, 廉会娟, 赵洁, 张金山. 模拟高原低压低氧对大鼠血清和胃黏膜Ghrelin表达的影响. 世界华人消化杂志 2011; 19(16): 1726-1730
Revised: May 18, 2011
Accepted: May 24, 2011
Published online: June 8, 2011
AIM: To investigate the effect of simulated high-altitude hypobaric hypoxia on serum and gastric levels of ghrelin in rats and to provide experimental evidence regarding the effect of high-altitude hypobaric hypoxia environment on digestive system function.
METHODS: Thirty Sprague-Dawley rats were randomly divided into three groups and exposed to ground level (control group) and a simulated altitude of 3 000 m and 5 000 m for 24 hours, respectively. ELISA was used to detect serum ghrelin levels, while the localization and expression of ghrelin in rat gastric mucosa were detected by immunohistochemistry. The density of gastric mucosal ghrelin immunoreactive cells in gastric mucosa was compared among each group.
RESULTS: Serum ghrelin concentrations in rats exposed to a simulated altitude of 3000 m and 5000 m were significantly lower than that in control rats (7.45 μg/L ± 1.33 μg/L, 6.87 μg/L ± 1.32 μg/L vs 9.31 μg/L ± 1.65 μg/L; P < 0.05, 0.01). Ghrelin immunoreactive cells were distributed in the X/A-like cells and endocrine cells of the fundic gastric glands, and the positive staining signals were mainly located in the cytoplasm. The integrated optical density of ghrelin immunoreactive cells in rats exposed to a simulated altitude of 3000 m and 5000 m was significantly lower than that in control rats (103.9 ± 9.55, 97.7 ± 11.22 vs 119.9 ± 11.96; both P < 0.01).
CONCLUSION: Simulated acute hypobaric hypoxia reduces serum and gastric levels of ghrelin in rats, suggesting that ghrelin might be involved in the regulation of digestive system dysfunction in hypobaric hypoxia environment.
- Citation: Sun ZQ, Lian HJ, Zhao J, Zhang JS. Simulated high-altitude hypobaric hypoxia decreases serum and gastric levels of ghrelin in rats. Shijie Huaren Xiaohua Zazhi 2011; 19(16): 1726-1730
- URL: https://www.wjgnet.com/1009-3079/full/v19/i16/1726.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i16.1726
高原环境作为一种环境因子, 具有低压、低氧、高辐射、气候多变等气候、地理特点, 可引起机体的应激反应, 是导致各种高原适应不全和急性高原疾病的重要原因. 正常人进入海拔5 000 m以上高原地区数小时内可发生急性高原病, 表现为厌食、恶心、呕吐、头痛和乏力等高原反应. 高原医学研究尚处于较为基础阶段, 目前对高原肺水肿、高原脑水肿等高原病研究的较多, 制定了相应的诊断和治疗标准. 然而, 其对消化系统功能影响的研究较少, 有文献报道, 模拟5 000 m及10 000 m低压低氧时, 小肠和阑尾黏膜中生长抑素含量显著升高, 而生长抑素可抑制多种胃肠激素的分泌, 抑制胃肠运动和胆囊收缩[1,2]. Ghrelin是近年来新发现的一种由28个氨基酸残基组成的脑肠肽激素, 主要由胃底部黏膜泌酸腺X/A细胞合成并分泌入血[3,4]. Ghrelin是一种生长激素释放促分泌素受体(growth hormone secretagogue receptor, GHSR)的内源性配体, 其主要功能包括促进生长激素释放、刺激食欲及摄食行为和促进胃肠蠕动等. 鉴于Ghrelin对消化系统功能的重要作用, 以及高原环境可影响消化系功能, 因而推测Ghrelin在高原病消化系反应中可能发挥一定作用. 为此本研究通过建立模拟高原低压低氧动物模型, 探讨高原低压低氧环境对大鼠血清和胃黏膜组织中Ghrelin水平的影响, 以期为进一步探讨高原环境下消化系统功能的变化及其机制提供实验依据.
健康♂Sprague-Dawley大鼠30只(中国人民解放军第四军医大学训练部实验动物中心提供), 体质量210-230 g, 动物饲养与实验过程均遵守本校实验动物饲养与使用的规定. 动物低压舱由中国人民解放军第四军医大学基础部病理学与病理生理学教研室提供; 大鼠血清Ghrelin检测ELISA试剂盒购自ADL(Adlitteram Diagnostic Laboratories)公司; 兔抗Ghrelin多克隆抗体购自博士德生物工程公司; 生物素标记的羊抗兔IgG和免疫组织化学ABC试剂盒购自Vector公司; DAB为Sigma公司产品.
1.2.1 分组与造模: 按随机原则将30只大鼠分为3组, 即地面对照组、3 000 m和5 000 m模型组, 每组10只. 各组大鼠均在相同的小动物低压舱环境内适应性饲养1 wk(每天放置40 min), 其间动物可自由进食和饮水. 采用小动物低压舱模拟不同海拔高度的减压方法, 模拟不同低氧条件, 模拟海拔高度分别为3 000 m和5 000 m; 每次将模型组动物2只放入低压舱内, 自由饮水, 匀速减压至相应模拟海拔高度, 舱内停留时间为24 h.
1.2.2 大鼠血清和胃黏膜组织石蜡切片制备: 模型制作完成后, 将对照组和各实验组大鼠用4%戊巴比妥钠腹腔注射麻醉下, 立即开胸暴露心脏, 左心室内取血4 mL, 迅速将血4 ℃冰箱内静置1 h, 3 500 r/m离心15 min取上清液, 置于-70 ℃冰箱保存待测. 然后开腹暴露出胃, 取胃窦和体部组织, 用4 ℃生理盐水洗去血液及胃内容物, 入Bouin's液固定24 h后, 常规脱水、石蜡包埋、制成厚5 µm切片, 分别裱贴于预先用氨丙基三乙羟基硅烷(3-aminopropyltriethoxy-silane, APES, Sigma公司)处理过的载玻片上, 并将对照组和各实验组动物胃组织切片裱贴于同一载玻片上, 于37 ℃恒温箱考干备用.
1.2.3 大鼠血清Ghrelin水平检测: 应用ELISA方法测定各组动物动血清中Ghrelin水平. 主要检测步骤如下: (1)于空白微孔内依次滴加标准品或血清样品100 μL; (2)于标准品或样品孔中加入酶标记液50 μL; (3)37 ℃孵育反应60 min; (4)洗板机清洗5次, 每次静置20 s; (5)在标准品或样品孔中加入底物A、B液各50 μL; (6)37 ℃下避光孵育反应15 min; (7)每孔内加入终止液50 μL, 终止反应; (8)轻轻混匀, 30 min内用酶标仪检测各孔的A值(450 nm滤色片).
1.2.4 大鼠免疫组织化学染色: 用免疫组织化学方法观察大鼠胃黏膜组织中Ghrelin的定位与表达, 并比较各组动物间胃黏膜Ghrelin免疫反应阳性细胞密度的差异. 按免疫组织化学ABC染色程序进行染色, 取制备好的石蜡切片入二甲苯脱蜡10 min×2次, 无水乙醇漂洗5 min×2次. 新鲜甲醇配制的3 mL/L双氧水漂洗30 min, 以消除内源性过氧化物酶. 0.01 mol/L PBS(pH7.3)漂洗5 min×3次. 用15 mL/L正常羊血清封闭30 min; 甩去正常羊血清后, 滴加第一抗体(兔抗Ghrelin, 1:200), 4 ℃冰箱内孵育过夜; PBS漂洗5 min×3次, 滴加生物素标记的羊抗兔IgG(1:400), 室温2 h; PBS漂洗5 min×3次, 滴加ABC复合物1 h(1:200); PBS漂洗5 min×3次, DAB H2O2显色8-15 min; 常规脱水、透明、DPX封片. 用正常兔血清替代Ghrelin抗体作为第一抗体进行染色作为阴性对照实验.
1.2.5 胃黏膜细胞密度计数: Ghrelin阳性染色主要位于固有层腺体内, 为棕黄色颗粒沉积, 每例动物选取5张切片, 在光学显微镜下, 以16D目镜测微网于高倍视野(×200)下计数免疫反应阳性细胞数, 每张切片随机计算10个网格, 取平均值代表阳性反应细胞密度, 用统计学方法比较两组的差异.
统计学处理 实验数据均以mean±SD表示, 用两组间t检验进行统计学分析, P<0.05为统计学显著差异的标准.
模拟低压低氧环境可降低大鼠血循环中Ghrelin水平. 在低压舱中模拟海拔3 000 m模型组大鼠血清中Ghrelin水平低于海平面对照组, 差异具有统计学意义(P<0.05); 而模拟海拔5 000 m模型组大鼠血清中Ghrelin水平进一步下降, 显著低于海平面对照组(P<0.01, 表1).
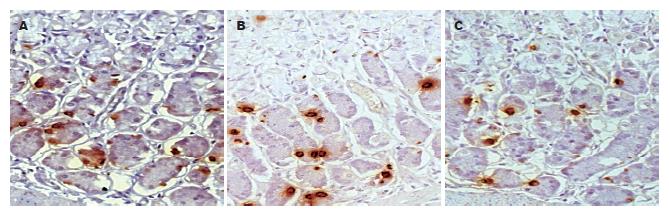
Ghrelin免疫反应阳性细胞定位于胃底泌酸腺颈部和基底部的X/A样细胞, 阳性产物呈棕黄色高密度颗粒状, 分布于胞质和胞膜, 细胞核未见阳性物质沉着, 对比明显, 背景清晰. 用正常兔血清替代一抗的阴性对照切片未见特异性着色. 模拟高原低压低氧组与海平面对照组大鼠胃黏膜内Ghrelin蛋白的分布基本一致, 但低压低氧组Ghrelin免疫反应阳性细胞数较海平面对照组明显减少(图1). 与海平面对照组相比, 3 000 m和5 000 m模型组大鼠胃黏膜中Ghrelin阳性细胞密度均有显著降低、统计学相差非常显著(P<0.01, P<0.001, 表1).
已有的研究表明[5-7], 急进高原人员最常见的早期反应是胃肠道症状, 恶心、呕吐和食欲减退发生率可达60%, 这表明高原环境可严重影响消化系统的正常功能. 急性高原反应的消化系症状, 常在发病初期急骤, 首先是中枢神经系统缺氧水肿, 累及下丘脑, 引起植物神经功能紊乱; 其次是由于胃肠黏膜因缺氧, 影响了其消化、吸收及胃肠蠕动功能. 急性低氧可使多种胃肠道激素、胃酸和胃泌素的分泌量减少, 后者可能与机体为了适应低氧环境, 表现为交感神经兴奋性增高有关[8].
胃肠道黏膜内存在大量的内分泌细胞, 其分泌的多种胃肠激素参与维持机体内稳态. Ghrelin是日本学者Kojima等[3]于1999年首先从大鼠和人的胃黏膜中发现的一种GHSR的内源性配体, 除了促进生长激素释放外, Ghrelin还参与诸多生理和病理过程, 如摄食调节、能量稳态、刺激胃酸分泌、调节细胞增殖和存活、调节炎症和免疫反应等[9]. 给大鼠静脉注射Ghrelin有增加胃酸分泌、刺激食欲和增强胃动力的作用, 这种作用可被阿托品或双侧迷走神经切断所阻断, 但不能被组胺H2受体拮抗剂阻断[10], 这提示Ghrelin可能参与了迷走神经对胃肠功能的中枢调节过程.
本研究结果表明, 模拟低压低氧环境可显著降低大鼠血清Ghrelin水平, 同时胃黏膜Ghrelin免疫阳性细胞数亦明显减少, 这提示胃黏膜Ghrelin分泌减少导致其血清水平降低. 本结果可部分解释急进高原地区时常见的恶心、呕吐和食欲减退等胃肠道症状. 暴露于低压低氧环境导致的消化系反应是多因素作用的结果, 包括中枢神经系统、肠神经系统和胃肠激素的调节. 杨春敏等[11]的研究发现, 急性低压低氧可抑制大鼠的胃排空和小肠推进运动, 同时伴有血浆胃动素水平降低和NO浓度升高; 故我们认为, 肠神经系统NO合成增加与胃动素减少共同参与了对胃肠运动的抑制. 另有研究表明[8,12], 模拟高原环境可下调下丘脑食欲调节中枢内增食欲素(orexin, OX)mRNA的表达; 同时神经肽Y(neuropeptide Y, NPY)分泌减少, 导致NPY的食欲促进作用减弱. 我们认为, 高原急性低压低氧后下丘脑内OX和NPY表达降低可能是大鼠食欲减退的重要原因之一. 下丘脑室旁核内含Ghrelin的神经元与表达NPY和OX的神经元之间存在信息交换, 即Ghrelin神经元促进含NPY神经元的NPY释放, 进而刺激OX的释放[13]. 瘦素是另一种与食欲和摄食行为调节相关的激素, 其作用与Ghrelin相反, 即瘦素可抑制食欲和摄食行为[14]. Zaccaria等[15]检测了12名健康男性高原(5 050 m)低氧暴露15-20 d后血清瘦素水平, 发现他们的体质量指数和瘦素水平均明显下降, 说明瘦素与高原低氧的内分泌和代谢适应有关. Tschöp等[16]的研究发现, 高原环境中暴露20 h的人群血浆瘦素水平升高, 并伴有食欲减退.
总之, 摄食调节中枢位于下丘脑内, 形成复杂的"食欲调节网络", 通过各种食欲调节因子的信号传递作用, 对机体的食欲和摄食行为进行综合调控. 这一网络中包涵多种食欲促进因子(如增食欲素、NPY和Ghrelin等)和食欲抑制因子(瘦素和胰岛素等), Ghrelin作为该调节网络中的一种食欲促进因子, 可能与其他食欲调节因子协同作用, 共同参与高原低压低氧环境中消化系反应的发生和调节. 进一步探讨高原环境下Ghrelin与其他食欲调节肽之间的相互作用, 将有助于阐明高原低压低氧引起消化系功能紊乱的机制, 并将为高原性胃肠道的临床控制提供理论依据.
高原环境可导致机体发生一系列变化, 包括厌食、恶心、呕吐、头痛和乏力等症状. 其中消化系反应是高原反应的重要方面, 但至今对高原低氧环境下消化系统病理、生理变化的机制研究甚少. Ghrelin是一种生长激素释放促分泌素受体的内源性配体, 主要功能包括促进生长激素释放、刺激食欲及摄食行为和促进胃肠蠕动等. 由于Ghrelin对消化系统功能的重要作用, 以及高原环境可影响消化系功能, 因而推测Ghrelin在高原病消化系反应中可能发挥重要作用.
任超世, 研究员, 中国医学科学院生物医学工程研究所
Tschöp等的研究发现, 高原环境中暴露20 h的人群血浆瘦素水平升高, 并伴有食欲减退.
本研究首次观察了模拟高原低压低氧环境下大鼠血清和胃黏膜Ghrelin的变化, 发现模拟高原环境可致大鼠血清和胃黏膜Ghrelin水平降低, 这为深入研究Ghrelin在高原环境下消化系反应的机制提供了理论基础.
目前高原医学研究尚处于较为基础阶段, 在急性高原病、高原肺水肿和高原脑水肿领域取得了一些进展, 但在高原条件下消化系反应的研究较少, 探讨Ghrelin在高原病的作用机制, 有可能找出预防和治疗高原消化病药物的新靶点.
本文为高原环境对消化系统功能的影响研究提供了实验资料, 具有较好的参考价值.
编辑: 李薇 电编:何基才
| 1. | Wu ZJ, Zhong XJ, Sun YP, Xu G, Xu KG, Tian GQ. Effects of acute hypobaric hypoxia on the distribution of somatostatin contents in lower gastrointestinal tract of rats. Space Med Med Eng (Beijing). 2000;13:55-57. |
| 2. | Anand AC, Sashindran VK, Mohan L. Gastrointestinal problems at high altitude. Trop Gastroenterol. 2006;27:147-153. [PubMed] |
| 3. | Kojima M, Hosoda H, Date Y, Nakazato M, Matsuo H, Kangawa K. Ghrelin is a growth-hormone-releasing acylated peptide from stomach. Nature. 1999;402:656-660. [PubMed] [DOI] |
| 4. | Kojima M, Kangawa K. Ghrelin: structure and function. Physiol Rev. 2005;85:495-522. [PubMed] [DOI] |
| 5. | Lippl FJ, Neubauer S, Schipfer S, Lichter N, Tufman A, Otto B, Fischer R. Hypobaric hypoxia causes body weight reduction in obese subjects. Obesity (Silver Spring). 2010;18:675-681. [PubMed] [DOI] |
| 6. | Raff H. Total and active ghrelin in developing rats during hypoxia. Endocrine. 2003;21:159-161. [PubMed] [DOI] |
| 9. | Kristenssson E, Sundqvist M, Astin M, Kjerling M, Mattsson H, Dornonville de la Cour C, Håkanson R, Lindström E. Acute psychological stress raises plasma ghrelin in the rat. Regul Pept. 2006;134:114-117. [PubMed] [DOI] |
| 10. | Ariyasu H, Takaya K, Tagami T, Ogawa Y, Hosoda K, Akamizu T, Suda M, Koh T, Natsui K, Toyooka S. Stomach is a major source of circulating ghrelin, and feeding state determines plasma ghrelin-like immunoreactivity levels in humans. J Clin Endocrinol Metab. 2001;86:4753-4758. [PubMed] [DOI] |
| 13. | Hou Z, Miao Y, Gao L, Pan H, Zhu S. Ghrelin-containing neuron in cerebral cortex and hypothalamus linked with the DVC of brainstem in rat. Regul Pept. 2006;134:126-131. [PubMed] [DOI] |
| 14. | Chaiban JT, Bitar FF, Azar ST. Effect of chronic hypoxia on leptin, insulin, adiponectin, and ghrelin. Metabolism. 2008;57:1019-1022. [PubMed] [DOI] |
| 15. | Zaccaria M, Ermolao A, Bonvicini P, Travain G, Varnier M. Decreased serum leptin levels during prolonged high altitude exposure. Eur J Appl Physiol. 2004;92:249-253. [PubMed] [DOI] |