修回日期: 2011-04-29
接受日期: 2011-05-05
在线出版日期: 2011-05-28
目的: 探讨MMP-3和VEGF蛋白在胰腺癌组织中的表达及其与胰腺癌临床病理特征、预后及胰腺癌组织中血管新生的关系.
方法: 用免疫组织化学检测了56例手术切除的胰腺癌组织和正常胰腺组织中MMP-3、VEGF的蛋白表达和微血管密度, 并请相关专业人员进行微血管密度计数分析.
结果: 在56例胰腺癌标本中有42例MMP-3 (75.00%)和38例VEGF(67.85%)蛋白的表达阳性, 明显高于正常胰腺组织. MMP-3和VEGF的阳性表达呈正相关(χ2 = 30.42, P<0.01). MMP-3在临床分期较晚和有淋巴结转移的胰腺癌中呈高表达. 56例胰腺癌组织中的微血管密度与MMP-3、VEGF蛋白的阳性表达有关(tVEGF =3.67, P<0.01; tMMP-3 = 3.05, P<0.01).
结论: MMP-3和VEGF可能通过相互促进的表达, 促进胰腺癌组织中新生血管的形成, 可能在胰腺癌的发生发展中起到重要作用. MMP-3对预测肿瘤的早期转移有一定的临床意义. 而VEGF的相对低表达与临床所见胰腺癌在增强CT的低密度低动脉供血可能有关联.
引文著录: 李春龙, 崔云甫, 杜雪飞, 邰升. MMP-3和VEGF在胰腺癌中的表达及临床意义. 世界华人消化杂志 2011; 19(15): 1574-1578
Revised: April 29, 2011
Accepted: May 5, 2011
Published online: May 28, 2011
AIM: To investigate the expression of vascular endothelial growth factor (VEGF) and matrix metalloproteinases-3 (MMP-3) in pancreatic carcinoma (PC) and to analyze their relationship with tumor angiogenesis, invasion and metastasis.
METHODS: The protein expression of VEGF and MMP-3 and microvessel density (MVD) were detected by immunohistochemistry in 56 PC specimens and 56 normal pancreatic tissue specimens.
RESULTS: The positive rates of both MMP-3 and VEGF were significantly higher in PC than in normal pancreatic tissue (75.00% vs 3.57%, 67.85% vs 1.78%, both P < 0.01). There was a positive correlation between the expression of VEGF and that of MMP-3. Higher expression of MMP-3 was detected in late-stage PC and PC with lymph node metastasis. The expression of VEGF was correlated with clinical stage (P < 0.05). MVD was correlated with expression of MMP-3 and VEGF in PC (both P < 0.05).
CONCLUSION: MMP-3 and VEGF may promote tumor angiogenesis and play an important role in the development and progression of PC. Detection of MMP-3 expression could be used to predict early metastasis of PC. Lower expression of VEGF may be related to lower arterial blood supply in PC.
- Citation: Li CL, Cui YF, Du XF, Tai S. Clinical significance of matrix metalloproteinases-3 and vascular endothelial growth factor expression in pancreatic carcinoma. Shijie Huaren Xiaohua Zazhi 2011; 19(15): 1574-1578
- URL: https://www.wjgnet.com/1009-3079/full/v19/i15/1574.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i15.1574
血管内皮生长因子(vascular endothelial growth factor, VEGF)是目前已知最重要的促血管生成因子之一, 基质金属蛋白酶3(matrix metalloproteinases-3, MMP-3)是一种与肿瘤侵袭和转移密切相关的蛋白酶, 他与血管形成过程中基底膜的降解关系密切[1]. 血管生成(angiogenesis)与肿瘤的生长和转移密切相关, 微血管密度(microvessel density, MVD)则是反映肿瘤组织血管生成情况的一项客观指标[2]. 本试验选取56例胰腺癌及其周围正常组织标本, 应用免疫组织化学方法检测VEGF、MMP-3表达和MVD计数, 以探讨VEGF、MMP-3与胰腺癌血管形成和临床的关系.
2004-01/2008-07哈尔滨医科大学第一附属医院和第二附属医院普外科住院治疗的胰腺癌患者56例. 入选标准: (1)病理确诊; (2)手术切除病变; (3)术前未行放、化疗; (4)病历资料完整. 同时记录56例胰腺癌临床病理资料, 有淋巴结转移27例, 无淋巴结转移29例.
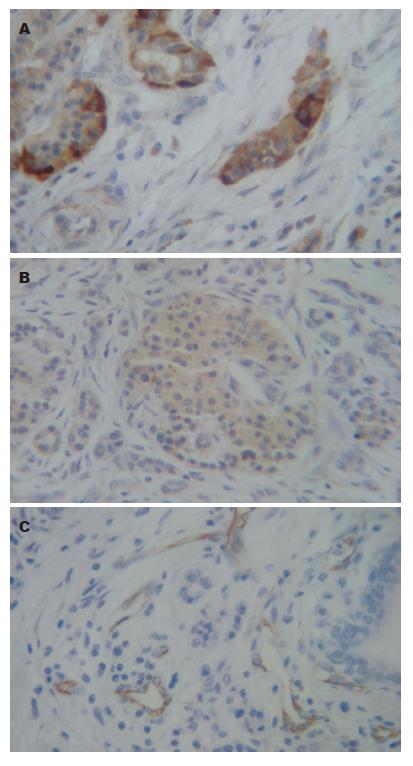
调出所有患者存档病理蜡块, 各制成4张4 μm的切片, 1张常规HE染色, 3张行免疫组织化学染色. 免疫组织化学染色按北京中山试剂公司生产的试剂盒说明书操作. 用已知阳性切片作阳性对照, 用PBS代替一抗作阴性对照. VEGF、MMP-3阳性判断参考Volm等[3]的方法, 以胰腺组织肿瘤细胞或腺上皮细胞胞质中出现明显的黄色或棕黄色颗粒为阳性. 按400倍视野阳性细胞百分值(0%: 0分; 1%-25%: 1分; 26%-50%: 2分; >50%: 3分)和细胞着色强度(阴性: 0分; 淡黄色: 1分; 棕黄色: 2分; 棕褐色: 3分)评分. 两分值相加, 0-2分为阴性(-), 3-4分为弱阳性(+), 5-6分为强阳性(++). 肿瘤MVD测定参考Weidner等[4]的方法, 首先在100倍视野下挑选CD31阳性最高区域, 然后计数5个200倍视野的CD31阳性微血管数, 取平均值. CD31阳性判断是以血管内皮细胞胞质内出现明显的黄色或棕黄色颗粒为阳性. 免疫组织化学结果的判定均由专业病理工作者在不知道实验分组的情况下作出.
统计学处理 数据以mean±SD表示, 弱阳性和强阳性均计为阳性, 使用SPSS13.0统计软件处理数据, 应用t检验、χ2检验、Fisher确切概率法, P<0.05有统计学意义.
微血管分布不均, 而正常组织分布较少(图1). 56例胰腺癌标本中, VEGF蛋白阳性表达在癌组织、正常组织中分别为38例(67.85%)、1例(1.78%), MMP-3蛋白阳性表达在癌组织、正常组织中分别为42例(75.00%)、2例(3.57%), VEGF、MMP-3蛋白阳性表达在淋巴转移阳性组分别为21例(77.77%)、26例(96.29%), 胰腺癌VEGF阳性组MVD平均值为36.31±5.16、阴性组MVD平均值为20.50±1.73, 胰腺癌MMP-3阳性组MVD平均值为35.89±7.28、阴性组MVD平均值为20.21±1.91. MMP-3、VEGF表达阳性率癌组织显著高于正常组织, 差异均有统计学意义(χ2VEGF = 50.98, P<0.01, χ2MMP-3 = 28.46, P<0.01, 表1).
| VEGF | χ2值 | P值 | MMP-3 | χ2值 | P值 | |||
| + | - | + | - | |||||
| 癌组织 | 38 | 18 | 50.98 | <0.01 | 42 | 14 | 28.46 | <0.01 |
| 正常组织 | 1 | 55 | 2 | 54 | ||||
胰腺癌VEGF、MMP-3阳性组与阴性组MVD平均值比较, 差异均有统计学意义(tVEGF = 3.67, P<0.01, tMMP-3 = 3.05, P<0.01, 表2). 胰腺癌组织中MMP-3和 VEGF蛋白的阳性表达呈正相关(χ2 = 30.42, P<0.01). 胰腺癌组织中VEGF、MMP-3表达阳性率在性别、年龄、肿瘤大小、肿瘤部位、病理分级方面无明显差异(P>0.05, 表3); MMP-3表达阳性率在临床分期和淋巴结转移方面有明显差异(P<0.05, 表3); VEGF的表达阳性率在临床分期方面有明显差异(P<0.05, 表3).
| n | MVD | t值 | P值 | ||
| VEGF | + | 38 | 36.31±5.16 | 3.67 | <0.01 |
| - | 18 | 20.50±1.73 | |||
| MMP-3 | + | 42 | 35.89±7.28 | 3.05 | <0.01 |
| - | 14 | 20.21±1.91 |
| VEGF | MMP-3 | |||
| 阳性率(%) | P值 | 阳性率(%) | P值 | |
| 性别 | ||||
| 男 | 66.67 | >0.05 | 76.19 | >0.05 |
| 女 | 71.42 | 71.42 | ||
| 年龄(岁) | ||||
| ≥60 | 67.50 | >0.05 | 72.50 | >0.05 |
| <60 | 68.75 | 81.25 | ||
| 肿瘤大小(cm) | ||||
| ≥2.5 | 65.62 | >0.05 | 84.37 | >0.05 |
| <2.5 | 70.83 | 62.50 | ||
| 肿瘤部位 | ||||
| 胰头 | 70.21 | >0.05 | 72.34 | >0.05 |
| 胰体尾 | 55.55 | 88.89 | ||
| 病理分级 | ||||
| 高分化 | 66.67 | >0.05 | 77.78 | >0.05 |
| 中低分化 | 68.42 | 73.68 | ||
| 临床分期 | ||||
| Ⅰ+Ⅱ | 36.84 | <0.05 | 31.58 | <0.05 |
| Ⅲ+Ⅳ | 83.78 | 97.29 | ||
| 淋巴结转移 | ||||
| 阴性 | 58.62 | >0.05 | 55.17 | <0.05 |
| 阳性 | 77.77 | 96.29 | ||
由于胰腺癌恶性度及转移发生率高, 大多数胰腺癌患者切除术后预后较差. 据Yeo等[5]报道, 美国胰腺癌5年生存率有15%, 国内李志伟等[6]报道胰头癌5年生存率<3.8%, 作为预后较差的消化系恶性肿瘤之一. 我们对胰腺癌的了解还知之甚少, 亟待进一步加以阐释, 对其特性加以分析以期改善预后. 肿瘤的生长离不开微血管的形成, 但胰腺癌却在临床增强CT中表现为低密度影[7], 其有别于其他恶性肿瘤, 由此推论胰腺癌对动脉供血的依赖低于其他肿瘤, 因此其预后应该好于其他肿瘤如结肠癌、肝癌等, 但临床实践告诉我们其预后远不如其他动脉血供依赖高的肿瘤[8], 其原因我们认为: 其一, 与胰腺癌位置隐蔽不易早期发现有关; 其二, 胰腺癌分泌的细胞因子的质和量可能有别于其他肿瘤, 从而造成了早期的淋巴转移, 而使其预后低于其他恶性肿瘤. 淋巴转移通路是胰腺癌细胞最主要的转移方式之一[9]. 胰腺癌的分化程度和淋巴转移直接影响患者的预后, 胰腺癌细胞低分化和淋巴道转移使胰腺癌生存时间平均缩短0.91年[5], 提示胰腺癌的预后与淋巴结转移和淋巴管浸润密切相关. 同时Bogoevski等[10]研究胰腺癌淋巴结阳性个数与胰腺癌预后成负相关性, 说明淋巴结有无转移是判断胰腺癌预后的重要指标, 本研究提示MMP-3与淋巴结转移有相关性, MMP-3有望成为判断胰腺癌预后的检测指标.
VEGF是目前所知最关键的促进血管新生的生长因子, 在胰腺癌的研究中发现VEGF与MVD密切相关[11,12], 并且VEGF呈高表达和肿瘤新生血管丰富的患者早期复发率较高, 预后差[13]. Tang等[14]报道在胰腺癌中VEGF的表达率为80.4%, Northern blot表明胰腺癌细胞的VEGF总RNA表达是正常细胞的2.2倍. 本研究也发现在胰腺癌组织中存在VEGF异常高表达, 并与MVD有关, VEGF高表达者MVD也较高, 临床病理分期晚的病例VEGF水平明显高于早期的病例.
MMP是以酶原的形式从胞内分泌到胞外, 进而经一系列蛋白酶级联而激活[15]. 这个胶原蛋白结构域可被MMP-3、MMP-2或者次氯酸裂解[16-18]. MMP-3可能是MMP-9最有效的激活剂[19-21], 进而MMP-9可通过释放VEGF以参与血管生成[22,23]. 有研究表明, 缺氧可诱导肿瘤细胞及正常细胞VEGF的表达增强2-50倍, 从而刺激肿瘤血管的形成[24]. 其作用机制及诱导途径也是我们以后研究胰腺癌发生、转移的一个重要方向. 本实验结果表明MMP-3、VEGF在癌组织中的表达平均水平高于正常组织中的表达, 提示MMP-3、VEGF与胰腺癌的发生可能相关, 并且在胰腺癌组织中MMP-3和VEGF蛋白的阳性表达有一定的相关性.
本实验还提示MMP-3、VEGF与MVD的多少相关, 而MVD是反映肿瘤组织血管生成情况的一项客观指标, Yancopoulos等[25]证明肿瘤生长依赖于血管生成, 当瘤体直径超过1-2 mm时, 必须依赖新生血管提供养分. Nagakawa等[26]研究表明, 肿瘤微血管的形态和数量与肝转移存在联系. 肝转移组的单位面积内侵犯型微血管和破坏型微血管数量显著高于非转移组. Ikeda等报道高MVD值的患者局部复发和远处转移的发生率也显著高于低MVD值者, 微血管数量明显增加, 形态扭曲增粗, 分支不规则, 有异常的网状血管结构, 其基底膜不完整, 通透性增高[27,28]. 肿瘤的生长和转移与血管生成有关, 肿瘤细胞自原发部位脱落后浸透组织基底膜, 进而借助结构不完整的新生血管进入血循环或淋巴循环[29], MMP-3可能协同VEGF促进胰腺癌血管形成, 因此, MMP-3在胰腺癌血管形成中可能起重要作用. 本研究结果表明, MMP-3的表达与胰腺癌有无淋巴结转移有相关性, 表明MMP-3在胰腺癌转移过程中起重要作用, 有可能为胰腺癌抗血管形成治疗提供新的靶蛋白, 为胰腺癌治疗探索一种新的途径. 实验结果还显示, MMP-3、VEGF的表达与胰腺癌的临床分期密切相关, 而胰腺癌的临床分期与预后密切相关, 这提示MMP-3、VEGF表达的高低与胰腺癌的预后密切相关. 因此, 我们可以通过检测MMP-3和VEGF蛋白表达来判断胰腺癌患者的预后. 本实验提示MMP-3和VEGF在胰腺癌发生转移中可能有一定的关系, 二者大体保持同步的变化. 总之, 对MMP-3和VEGF更深入的研究, 有助于对胰腺癌生长、浸润和转移机制的进一步认识, 最终为胰腺癌的诊断、治疗和预后评价提供重要帮助.
由于胰腺癌恶性度及转移发生率高, 大多数胰腺癌患者切除术后预后较差. 美国胰腺癌5年生存率有15%, 国内有研究报道胰头癌5年生存率<3.8%, 作为预后较差的消化系恶性肿瘤之一, 亟待进一步加以阐释, 对其特性加以分析以期改善预后, MMP-3有望成为胰腺癌早期诊断及判断预后的重要指标.
刘海林, 主任医师, 上海交通大学医学院附属第九人民医院消化科
关于胰腺癌的早期诊断、预后评估的相关研究较多, 但国内外关于胰腺癌与MMP-3的相关研究罕有报道, 此方面的研究有望对胰腺癌的早期诊断、预后评估提供新的生物标志.
Yancopoulos等证明肿瘤生长依赖于血管生成, 当瘤体直径超过l-2 mm时, 必须依赖新生血管提供养分. Nagakawa等研究表明, 肿瘤微血管的形态和数量与肝转移存在联系. 肝转移组的单位面积内侵犯型微血管和破坏型微血管数量显著高于非转移组.
关于胰腺癌与MMP-3关系的相关研究有望对胰腺癌的早期诊断、预后评估提供新的生物标志.
本研究设计合理, 具有一定的学术价值.
编辑: 曹丽鸥 电编:何基才
| 1. | Gress TM, Müller-Pillasch F, Lerch MM, Friess H, Büchler M, Adler G. Expression and in-situ localization of genes coding for extracellular matrix proteins and extracellular matrix degrading proteases in pancreatic cancer. Int J Cancer. 1995;62:407-413. [PubMed] [DOI] |
| 2. | Hui L, Desen W, Zhizhong P, Lijing C, Xiaojun W, Zhenhai L, Tai K. Expression and Biological Significance of Leptin, Leptin Receptor, VEGF, and CD34 in Colorectal Carcinoma. Cell Biochem Biophys. 2010; Dec 16. [Epub ahead of print]. [PubMed] |
| 3. | Volm M, Koomägi R, Mattern J. Prognostic value of vascular endothelial growth factor and its receptor Flt-1 in squamous cell lung cancer. Int J Cancer. 1997;74:64-68. [PubMed] [DOI] |
| 4. | Weidner N, Semple JP, Welch WR, Folkman J. Tumor angiogenesis and metastasis--correlation in invasive breast carcinoma. N Engl J Med. 1991;324:1-8. [PubMed] [DOI] |
| 5. | Yeo CJ, Sohn TA, Cameron JL, Hruban RH, Lillemoe KD, Pitt HA. Periampullary adenocarcinoma: analysis of 5-year survivors. Ann Surg. 1998;227:821-831. [PubMed] [DOI] |
| 7. | Maschuw K, Fendrich V, Langer P, Volland C, Ramaswamy A, Bartsch DK. Impact of CT-based diagnostic imaging on management and outcome of nonfunctioning pancreatic tumors. Langenbecks Arch Surg. 2011; Feb 12. [Epub ahead of print]. [PubMed] |
| 8. | Schmid RM. [Pancreatic cancer]. Praxis (Bern 1994). 2006;95:1709-1712. [PubMed] |
| 10. | Bogoevski D, Yekebas EF, Schurr P, Kaifi JT, Kutup A, Erbersdobler A, Pantel K, Izbicki JR. Mode of spread in the early phase of lymphatic metastasis in pancreatic ductal adenocarcinoma: prognostic significance of nodal microinvolvement. Ann Surg. 2004;240:993-1000; discussion 1000-1001. [PubMed] [DOI] |
| 13. | Niedergethmann M, Hildenbrand R, Wostbrock B, Hartel M, Sturm JW, Richter A, Post S. High expression of vascular endothelial growth factor predicts early recurrence and poor prognosis after curative resection for ductal adenocarcinoma of the pancreas. Pancreas. 2002;25:122-129. [PubMed] [DOI] |
| 14. | Tang RF, Itakura J, Aikawa T, Matsuda K, Fujii H, Korc M, Matsumoto Y. Overexpression of lymphangiogenic growth factor VEGF-C in human pancreatic cancer. Pancreas. 2001;22:285-292. [PubMed] [DOI] |
| 15. | Moon PC, Weaver J, Brooks CN. Review of matrix metalloproteinases' effect on the hybrid dentin bond layer stability and chlorhexidine clinical use to prevent bond failure. Open Dent J. 2010;4:147-152. [PubMed] [DOI] |
| 16. | De Sanctis P, Elmakky A, Farina A, Caramelli E, Seracchioli R, Mabrouk M, Mignemi G, Venturoli S, Villa G, Guerrini M. Matrix metalloproteinase-3 mRNA: a promising peripheral blood marker for diagnosis of endometriosis. Gynecol Obstet Invest. 2011;71:118-123. [PubMed] [DOI] |
| 17. | Lakemeier S, Braun J, Efe T, Foelsch C, Archontidou-Aprin E, Fuchs-Winkelmann S, Paletta JR, Schofer MD. Expression of matrix metalloproteinases 1, 3, and 9 in differing extents of tendon retraction in the torn rotator cuff. Knee Surg Sports Traumatol Arthrosc. 2011; Jan 11. [Epub ahead of print]. [PubMed] |
| 18. | Current evidence on the relationship between four polymorphisms in the matrix metalloproteinases (MMP) gene and breast cancer risk: a meta-analysis. Breast Cancer Res Treat. 2010; Dec 15. [Epub ahead of print]. [PubMed] |
| 19. | Inatomi O, Andoh A, Yagi Y, Ogawa A, Hata K, Shiomi H, Tani T, Takayanagi A, Shimizu N, Fujiyama Y. Matrix metalloproteinase-3 secretion from human pancreatic periacinar myofibroblasts in response to inflammatory mediators. Pancreas. 2007;34:126-132. [PubMed] [DOI] |
| 20. | Hayashi T, Fleming MV, Stetler-Stevenson WG, Liotta LA, Moss J, Ferrans VJ, Travis WD. Immunohistochemical study of matrix metalloproteinases (MMPs) and their tissue inhibitors (TIMPs) in pulmonary lymphangioleiomyomatosis (LAM). Hum Pathol. 1997;28:1071-1078. [PubMed] [DOI] |
| 21. | Kawut SM, Barr RG, Johnson WC, Chahal H, Tandri H, Jain A, Bristow MR, Kizer JR, Bagiella E, Lima JA. Matrix metalloproteinase-9 and plasminogen activator inhibitor-1 are associated with right ventricular structure and function: the MESA-RV Study. Biomarkers. 2010;15:731-738. [PubMed] [DOI] |
| 22. | Funel N, Costa F, Pettinari L, Taddeo A, Sala A, Chiriva-Internati M, Cobos E, Colombo G, Milzani A, Campani D. Ukrain affects pancreas cancer cell phenotype in vitro by targeting MMP-9 and intra-/extracellular SPARC expression. Pancreatology. 2010;10:545-552. [PubMed] [DOI] |
| 23. | Wang GW, Wang MQ, Wang XJ, Yu SB, Liu XD, Jiao K. Changes in the expression of MMP-3, MMP-9, TIMP-1 and aggrecan in the condylar cartilage of rats induced by experimentally created disordered occlusion. Arch Oral Biol. 2010;55:887-895. [PubMed] [DOI] |
| 24. | Büchler P, Reber HA, Büchler M, Shrinkante S, Büchler MW, Friess H, Semenza GL, Hines OJ. Hypoxia-inducible factor 1 regulates vascular endothelial growth factor expression in human pancreatic cancer. Pancreas. 2003;26:56-64. [PubMed] [DOI] |
| 25. | Yancopoulos GD, Davis S, Gale NW, Rudge JS, Wiegand SJ, Holash J. Vascular-specific growth factors and blood vessel formation. Nature. 2000;407:242-248. [PubMed] [DOI] |
| 26. | Nagakawa Y, Aoki T, Kasuya K, Tsuchida A, Koyanagi Y. Histologic features of venous invasion, expression of vascular endothelial growth factor and matrix metalloproteinase-2 and matrix metalloproteinase-9, and the relation with liver metastasis in pancreatic cancer. Pancreas. 2002;24:169-178. [PubMed] [DOI] |
| 27. | Ikeda N, Adachi M, Taki T, Huang C, Hashida H, Takabayashi A, Sho M, Nakajima Y, Kanehiro H, Hisanaga M. Prognostic significance of angiogenesis in human pancreatic cancer. Br J Cancer. 1999;79:1553-1563. [PubMed] [DOI] |
| 28. | Folkman J. The role of angiogenesis in tumor growth. Semin Cancer Biol. 1992;3:65-71. [PubMed] |
| 29. | Esposito I, Menicagli M, Funel N, Bergmann F, Boggi U, Mosca F, Bevilacqua G, Campani D. Inflammatory cells contribute to the generation of an angiogenic phenotype in pancreatic ductal adenocarcinoma. J Clin Pathol. 2004;57:630-636. [PubMed] [DOI] |
| 30. | Moilanen M, Sorsa T, Stenman M, Nyberg P, Lindy O, Vesterinen J, Paju A, Konttinen YT, Stenman UH, Salo T. Tumor-associated trypsinogen-2 (trypsinogen-2) activates procollagenases (MMP-1, -8, -13) and stromelysin-1 (MMP-3) and degrades type I collagen. Biochemistry. 2003;42:5414-5420. [PubMed] [DOI] |