修回日期: 2011-04-20
接受日期: 2011-05-05
在线出版日期: 2011-05-28
目的: 探讨原位肝移植中经下腔静脉逆行灌注对移植肝缺血再灌注损伤的影响.
方法: 36例大鼠肝移植随机分为3组, 每组12例. 门静脉组即经门静脉顺行灌注, 肝动脉+门静脉组即同时开放肝动脉及门静脉顺行灌注, 下腔静脉组即先吻合下腔静脉后开放逆行灌注, 然后吻合门静脉及肝动脉. 分别检测术后1、6及24 h的血清转氨酶、移植肝病理变化及肝细胞凋亡.
结果: 逆灌注组的肝酶学水平及肝细胞凋亡指数明显低于顺行灌注组, 移植肝的病理变化亦轻于逆灌注组, 而门静脉+肝动脉组肝组织病变最重, 肝细胞凋亡指数最大. 门静脉+肝动脉组血清转氨酶水平也最高, 移植后24 h, 门静脉+肝动脉组与门静脉组及下腔静脉组比较, 差异显著(2 564.1 U/L±410.3 U/L vs 1 801.6 U/L±324.5 U/L, 968.4 U/L±221.5 U/L, P = 0.003, 0.000).
结论: 与传统的顺行灌注相比, 经下腔静脉逆灌注可以减轻移植肝缺血再灌注损伤.
引文著录: 刘其雨, 李立, 李晓延, 陈刚, 赵英鹏, 白建华, 朱新锋. 逆灌注对移植肝缺血再灌注损伤的影响. 世界华人消化杂志 2011; 19(15): 1550-1554
Revised: April 20, 2011
Accepted: May 5, 2011
Published online: May 28, 2011
AIM: To evaluate the influence of retrograde reperfusion on ischemia/reperfusion injury in a rat model of liver transplantation.
METHODS: Thirty-six male Sprague-Dawley rats undergoing orthoptic liver transplantation were divided into three groups (n = 12 for each group): group 1, antegrade reperfusion via the portal vein; group 2, antegrade reperfusion simultaneously via the portal vein and hepatic artery; group 3: retrograde reperfusion via the vena cava. Serum parameters were determined 1, 6 and 24 h after operation. Liver samples were taken for histological assessment. Cell apoptotic index was determined.
RESULTS: Rats of group 3 showed significantly lower serum level of aspartate aminotransferase compared to groups 1 and 2 (968.4 U/L ± 221.5 U/L vs 1 801.6 U/L ± 324.5 U/L, 2 564.1 U/L ± 410.3 U/L, P = 0.003, 0.000). Serum level of aspartate aminotransferase was significantly lower in group 1 than in group 2. The liver of rats of group 3 showed significantly less leukocytic infiltrates compared to groups 1 and group 2. The apoptotic index was lower in group 3 than in group 1 and 2.
CONCLUSION: Retrograde reperfusion leads to a lower level of ischemia/reperfusion injury than antegrade reperfusion in rats undergoing liver transplantation.
- Citation: Liu QY, Li L, Li XY, Chen G, Zhao YP, Bai JH, Zhu XF. Liver graft injury induced by ischemia and reperfusion secondary to retrograde reperfusion. Shijie Huaren Xiaohua Zazhi 2011; 19(15): 1550-1554
- URL: https://www.wjgnet.com/1009-3079/full/v19/i15/1550.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i15.1550
目前, 肝移植已然成为治疗终末期肝病的标准方法[1-3], 但移植肝无功能及复苏后综合征等并发症仍困扰着临床医生[4,5], 其中缺血再灌注损伤是其发生的主要原因[6-8]. 移植肝缺血再灌注损伤的有效防治能够改善术后移植肝脏功能, 提高肝移植成功率, 是目前肝移植领域研究热点之一[9-11]. 原位肝移植中常规的肝脏灌注方法是采用顺行灌注, 即在完成血管吻合后首先开放门静脉或/和肝动脉, 然后开放下腔静脉. 本文旨在比较在原位肝移植中常规顺行灌注和逆行灌注对移植肝缺血再灌注损伤的影响.
供、受体均选用健康近交系SD大鼠(购自昆明医学院动物研究所), 供体雌雄不拘, 受体选用♂大鼠; 受体大鼠体质量250-300 g, 略大于供体(相差20 g左右). 清洁饲养, 术前6 h禁食, 自由饮用糖水. 采用低流量乙醚持续吸入麻醉. 显微手术器械、双目手术显微镜、无菌医用无损伤缝合针线、自制聚乙烯门静脉套管、自制腹腔弹力拉钩、自制双层修肝盒、电子天平、手术台、电热板.
1.2.1 分组: 32例大鼠肝移植随机分为3组, 门静脉组、肝动脉+门静脉组、下腔静脉组3组, 每组12例. 其中前2组均为顺行灌注组, 后1组为逆行灌注组.
1.2.2 手术: 按照常规"双套管法"大鼠原位肝移植术式[12], 肝上下腔静脉使用两针7-0的prolene分别连续缝合其前后壁, 肝下下腔静脉及门静脉使用袖套套管吻合、胆总管使用支撑管吻合, 肝动脉吻合结合显微技术使用"三针袖套法". (1)门静脉组手术方法: 依次吻合供、受体肝上下腔静脉、肝下下腔静脉、门静脉, 然后依次开放门静脉、肝上下腔静脉、肝下下腔静脉, 最后吻合肝动脉并开放; (2)肝动脉+门静脉组手术方法: 依次吻合供受体肝上下腔静脉、肝下下腔静脉、门静脉、肝动脉, 最后依次开放门静脉、肝动脉、肝上下腔静脉、肝下下腔静脉; (3)下腔静脉组手术方法: 完成供、受体肝上下下腔静脉吻合后, 在吻合门静脉前先开放肝上、肝下下腔静脉, 使下腔静脉的血逆行灌注肝脏, 然后依次吻合门静脉、肝动脉并依次开放.
1.2.3 指标的检测: (1)各组按实验设计分别于再灌注1、6、24 h后, 经下腔静脉采血. 血清谷草转氨酶水平(U/L)应用酶耦联测定法在全自动生化分析仪上测; (2)光镜下观察组织病理学改变; (3)按照说明采用Annexin V-FITC/PI双染法(试剂盒购自上海ACT基因公司)于流式细胞仪上检测细胞的早期凋亡, 分析Annexin V-FITC阳性而PI阴性的细胞百分比.
统计学处理 实验数据以mean±SD表示, 采用方差分析及多个均数间的两两比较的方法进行统计学处理分析, P<0.05认为有统计学意义. 所有处理均采用SPSS17.0统计软件包.
移植后1 h各组血清谷草转氨酶即有明显升高, 至移植后6 h各组转氨酶持续升高, 其中门静脉+肝动脉组最高, 门静脉组次之, 下腔静脉组最低; 至移植后24 h, 各组转氨酶较前有所下降, 其中下腔静脉组最低(表1).
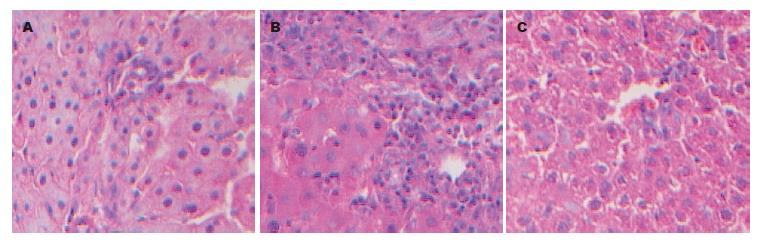
移植后1 h, 各组肝细胞具有轻度水肿, 随着时间的延长, 病变不断加重, 渐渐出现炎性细胞的浸润, 至移植后24 h, 汇管区见到大量炎性细胞浸润, 其中门静脉+肝动脉组最重, 门静脉组次之, 而下腔静脉组最轻(图1).
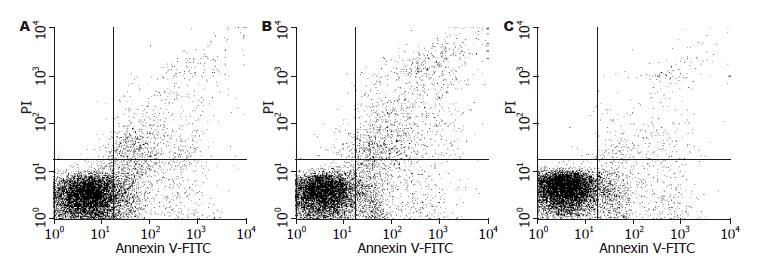
肝移植早期即有肝细胞的凋亡, 至6 h到达高峰, 且随着时间延长死亡细胞逐渐增多; 同时间点的活细胞数下腔静脉组最多, 门静脉组次之, 门静脉+肝动脉组最少; 而凋亡及坏死细胞则相反(图2).
在临床肝移植中, 供肝要依次接受冷缺血、复温热缺血和再灌注三个损伤过程. 在无肝期期间, 由于肝脏温度升高可出现新肝复温缺血损伤, 而复温缺血损伤是导致早期移植肝功能不良的最重要的危险因素[13-15]. 临床肝移植中肝脏的缺血再灌注损伤是造成术后移植肝功能不良的主要因素之一, 严重者可发展成原发性移植肝无功能[16-18]. 因此, 移植肝的血流灌注对术后移植物的存活率至关重要[19-21].
Kniepeiss等[22]还发现肝脏逆行灌注可减轻再灌注后全身血液动力学紊乱, 称之为再灌注后综合征: 包括全身低血压和肺动脉高压. 常规门静脉正向灌注方法再灌注后综合征发生率高达30%, 而逆灌注法可有效降低再灌注后综合征的发生率(3.6%), 并可以减少高钾血症、肺动脉高压、右心功能衰竭等. Matevossian等[23]及国内学者陈皓[24]等也发现原位肝移植中经门静脉逆灌注可以降低术后早期肝酶学水平, 并进一步改善移植后早期的肝功能. 至于, 逆灌注是否可以引起缺血性胆道狭窄仍有争议, Heidenhain等[25]认为逆灌注虽然有利于肝细胞, 但会损伤胆管上皮细胞, 引起缺血性胆道损伤; 而国内学者江艺等[26]通过86例肝移植的回顾性分析, 发现下腔静脉逆灌注法并没有增加肝移植术后胆道并发症的发生率, 这尚有待于进一步实验临床的前瞻性研究.
本研究发现, 逆灌注移植后即有血清转氨酶的升高, 随着时间的延长并不断升高, 但到了24 h出现了下降, 说明在移植后早期肝功能变化最为明显, 供肝得到灌注后, 肝功能渐渐得到恢复. 此外, 门静脉+肝动脉组的血清转氨酶明显高于门静脉组, 无肝期时间延长是其主要原因, 复温缺血时间延长是引起早期移植肝功能不良的重要潜在因素. 尽量缩短无肝期, 尽早再灌注, 可减少移植肝缺血再灌注损伤, 而经下腔静脉逆行灌注可以缩短无肝期时间, 减轻缺血再灌注损伤, 进一步保护移植肝.
肝细胞的变性和坏死是缺血再灌注损伤时各类临床表现的基础. 肝脏的缺血再灌注损伤的病理过程已基本清楚[27-29]. 在复流早期, 内皮细胞肿胀、血管收缩、白细胞内陷及血小板移行进入肝血窦, 最终导致肝窦微循环受损. 由于缺血引起细胞能量不足, 主动跨膜转运障碍导致细胞水肿, 使内皮细胞和Kuffer细胞肿胀. 白细胞迁移速率降低和滞留导致了肝窦内腔的狭窄. 白细胞与内皮细胞相互作用的机率显著增加, 滞留的白细胞虽然不能完全闭塞肝窦内腔, 但进一步妨碍了肝窦微循环网络的通畅. 这些改变明显延长了缺氧时间, 甚至复流再灌注后, 肝脏仍有部分区域处于缺血状态. 这一过程随后的结果是Kuffer细胞和中性粒细胞的激活, 产生细胞因子如TNF-α、IL-1等和氧自由基进一步加重了肝组织损伤[30-32].
本研究发现, 移植后24 h, 门静脉+肝动脉组可见大量炎性细胞浸润, 伴有肝细胞坏死; 其中, 门静脉+肝动脉组坏死细胞所占比例最高, 而下腔静脉组中活细胞所占比例最高, 逆灌注法减轻移植肝缺血再灌注损伤的机制可能是: (1)含氧量很低的下腔静脉血对肝脏低压灌注减少了氧自由基的大量爆发; (2)缩短了无肝期, 减少了机体产生酸性物质、LPS及细胞因子TNF-α、IL-1, 同时使一部分的酸性物质、LPS及细胞因子对移植肝的损伤; (3)逆灌注冲洗了冷保存时期移植肝进行无氧代谢产生的有毒物质, 从而减轻再灌注损伤[33].
总之, 经典原位肝移植中经下腔静脉逆行灌注, 可以减轻移植肝的缺血再灌注损伤, 进一步改善移植术后的肝功能.
临床肝移植术中的缺血再灌注损伤是影响术后移植物功能及存活率的重要因素, 其中缺血再灌注损伤与移植过程中的灌注方法有关, 经下腔静脉逆行灌注可以减轻缺血再灌注损伤, 以进一步改善术后的移植肝功能, 本文旨在动物实验基础上阐述其可能的机制.
陈积圣, 教授, 中山大学孙逸仙纪念医院肝胆外科
经典的灌注方法是经门静脉或(和)的顺行灌注, 而经下腔静脉逆行灌注的研究甚少, 且其对减轻缺血再灌注损伤的机制较复杂.
Kniepeiss等发现肝脏逆行灌注可减轻再灌注后全身血液动力学紊乱: 包括全身低血压和肺动脉高压. 常规门静脉正向灌注方法再灌注后综合征发生率高达30%, 而逆灌注法可有效降低再灌注后综合征的发生率(3.6%).
本研究通过大鼠肝移植模型的逆行灌注, 并应用Annexin V-FITC/PI双染法检测肝组织的细胞凋亡等, 进一步探讨其可能的保护机制.
本研究证明肝移植经下腔静脉逆行灌注可以抑制肝细胞的早期凋亡, 以减轻缺血再灌注损伤, 最终保护移植物的功能.
本研究选题先进, 分组科学, 结果可靠, 对临床有重要参考意义.
编辑: 李薇 电编:何基才
| 1. | Merion RM. Current status and future of liver transplantation. Semin Liver Dis. 2010;30:411-421. [PubMed] [DOI] |
| 2. | Marudanayagam R, Shanmugam V, Sandhu B, Gunson BK, Mirza DF, Mayer D, Buckels J, Bramhall SR. Liver retransplantation in adults: a single-centre, 25-year experience. HPB (Oxford). 2010;12:217-224. [PubMed] |
| 3. | Tan HH, Martin P. Management of end-stage liver disease in chronic hepatitis B. Clin Liver Dis. 2010;14:477-493. [PubMed] [DOI] |
| 4. | Movahedi Z, Holt CD, Saab S. Liver transplant: a primer. Exp Clin Transplant. 2010;8:83-90. [PubMed] |
| 5. | Miyazaki ET, Dos Santos R, Miyazaki MC, Domingos NM, Felicio HC, Rocha MF, Arroyo PC, Duca WJ, Silva RF, Silva RC. Patients on the waiting list for liver transplantation: caregiver burden and stress. Liver Transpl. 2010;16:1164-1168. [PubMed] [DOI] |
| 6. | Kuriyama N, Isaji S, Hamada T, Kishiwada M, Ohsawa I, Usui M, Sakurai H, Tabata M, Suzuki K, Uemoto S. Activated protein C prevents hepatic ischaemia-reperfusion injury in rats. Liver Int. 2009;29:299-307. [PubMed] [DOI] |
| 7. | Junnarkar SP, Tapuria N, Dutt N, Fuller B, Seifalian AM, Davidson BR. Bucillamine improves hepatic microcirculation and reduces hepatocellular injury after liver warm ischaemia-reperfusion injury. HPB (Oxford). 2009;11:264-273. [PubMed] |
| 8. | Hilmi IA, Peng Z, Planinsic RM, Damian D, Dai F, Tyurina YY, Kagan VE, Kellum JA. N-acetylcysteine does not prevent hepatorenal ischaemia-reperfusion injury in patients undergoing orthotopic liver transplantation. Nephrol Dial Transplant. 2010;25:2328-2333. [PubMed] [DOI] |
| 9. | Andreani P, Hoti E, de la Serna S, degli Esposti D, Sebagh M, Lemoine A, Ichai P, Saliba F, Castaing D, Azoulay D. Ischaemic preconditioning of the graft in adult living related right lobe liver transplantation: impact on ischaemia-reperfusion injury and clinical relevance. HPB (Oxford). 2010;12:439-446 [PMID: 738222&dopt=Abstract". [PubMed] |
| 10. | Jegatheeswaran S, Siriwardena AK. Experimental and clinical evidence for modification of hepatic ischaemia-reperfusion injury by N-acetylcysteine during major liver surgery. HPB (Oxford). 2011;13:71-78. [PubMed] |
| 11. | Martins PN, Chang S, Mahadevapa B, Martins AB, Sheiner P. Liver grafts from selected older donors do not have significantly more ischaemia reperfusion injury. HPB (Oxford). 2011;13:212-220. [PubMed] |
| 13. | Bezinover D, Kadry Z, McCullough P, McQuillan PM, Uemura T, Welker K, Mastro AM, Janicki PK. Release of cytokines and hemodynamic instability during the reperfusion of a liver graft. Liver Transpl. 2011;17:324-330. [PubMed] [DOI] |
| 14. | Hines IN, Grisham MB. Divergent roles of superoxide and nitric oxide in liver ischemia and reperfusion injury. J Clin Biochem Nutr. 2011;48:50-56. [PubMed] [DOI] |
| 15. | Shen XD, Ke B, Uchida Y, Ji H, Gao F, Zhai Y, Busuttil RW, Kupiec-Weglinski JW. Native macrophages genetically modified to express heme oxygenase 1 protect rat liver transplants from ischemia/reperfusion injury. Liver Transpl. 2011;17:201-210. [PubMed] [DOI] |
| 16. | Wu C, Wang P, Rao J, Wang Z, Zhang C, Lu L, Zhang F. Triptolide alleviates hepatic ischemia/reperfusion injury by attenuating oxidative stress and inhibiting NF-κB activity in mice. J Surg Res. 2011;166:e205-e213. [PubMed] [DOI] |
| 17. | Teoh NC. Hepatic ischemia reperfusion injury: Contemporary perspectives on pathogenic mechanisms and basis for hepatoprotection-the good, bad and deadly. J Gastroenterol Hepatol. 2011;26 Suppl 1:180-187. [PubMed] [DOI] |
| 18. | Scherer de Fraga R, Camacho VR, Souza GF, Cerski CT, de Oliveira JR, de Oliveira MG, Álvares-da-Silva MR. S-nitroso-N-acetylcysteine: a promising drug for early ischemia/reperfusion injury in rat liver. Transplant Proc. 2010;42:4491-4495. [PubMed] [DOI] |
| 19. | Pratschke S, Meimarakis G, Mayr S, Graeb C, Rentsch M, Zachoval R, Bruns CJ, Kleespies A, Jauch KW, Loehe F. Arterial blood flow predicts graft survival in liver transplant patients. Liver Transpl. 2011;17:436-445. [PubMed] [DOI] |
| 20. | Farid WR, de Jonge J, Slieker JC, Zondervan PE, Thomeer MG, Metselaar HJ, de Bruin RW, Kazemier G. The importance of portal venous blood flow in ischemic-type biliary lesions after liver transplantation. Am J Transplant. 2011;11:857-862. [PubMed] [DOI] |
| 21. | Dogan S, Aslan M. Hepatic ischemia-reperfusion injury and therapeutic strategies to alleviate cellular damage. Hepatol Res. 2011;41:103-117. [PubMed] [DOI] |
| 22. | Kniepeiss D, Iberer F, Grasser B, Schaffellner S, Stadlbauer V, Tscheliessnigg KH. A single-center experience with retrograde reperfusion in liver transplantation. Transpl Int. 2003;16:730-735. [PubMed] |
| 23. | Matevossian E, Doll D, Hüser N, Brauer R, Sinicina I, Nährig J, Friess H, Stangl M, Assfalg V. Liver transplantation in the rat: single-center experience with technique, long-term survival, and functional and histologic findings. Transplant Proc. 2009;41:2631-2636. [PubMed] [DOI] |
| 24. | 陈 皓, 彭 承宏, 沈 柏用, 谢 俊杰, 申 川, 费 悦, 邓 侠兴, 周 光文, 程 东峰, 杨 卫平. 原位肝移植术中逆行灌注对早期移植肝功能的影响. 上海交通大学学报(医学版). 2006;26:615-617. |
| 25. | Heidenhain C, Heise M, Jonas S, Ben-Asseur M, Puhl G, Mittler J, Thelen A, Schmidt S, Langrehr J, Neuhaus P. Retrograde reperfusion via vena cava lowers the risk of initial nonfunction but increases the risk of ischemic-type biliary lesions in liver transplantation--a randomized clinical trial. Transpl Int. 2006;19:738-748. [PubMed] [DOI] |
| 26. | 江 艺, 张 文华, 吕 立志, 蔡 秋程, 张 小进. 原位肝移植中下腔静脉逆灌注法对胆道并发症的影响. 中华普通外科学文献(电子版). 2009;3:212-215. |
| 27. | Pappo O, Ben-Ari Z, Shevtsov E, Avlas O, Gassmann M, Ravid A, Cheporko Y, Hochhauser E. The role of excessive versus acute administration of erythropoietin in attenuating hepatic ischemia-reperfusion injury. Can J Physiol Pharmacol. 2010;88:1130-1137. [PubMed] [DOI] |
| 28. | Jameel NM, Thirunavukkarasu C, Murase N, Cascio M, Prelich J, Yang S, Harvey SA, Gandhi CR. Constitutive release of powerful antioxidant-scavenging activity by hepatic stellate cells: protection of hepatocytes from ischemia/reperfusion injury. Liver Transpl. 2010;16:1400-1409. [PubMed] [DOI] |
| 29. | Cag M, Audet M, Saouli AC, Panaro F, Piardi T, Cinqualbre J, Wolf P. Does arterialisation time influence biliary tract complications after orthotopic liver transplantation. Transplant Proc. 2010;42:3630-3633. [PubMed] [DOI] |
| 30. | Daniela K, Michael Z, Florian I, Silvia S, Estrella J, Doris D, Karl-Heinz T. Influence of retrograde flushing via the caval vein on the post-reperfusion syndrome in liver transplantation. Clin Transplant. 2004;18:638-641. [PubMed] [DOI] |
| 31. | Koh HJ, Ryu KH, Cho ML, Heo YJ, Lee J. Factors influencing the concentration of cytokines during liver transplantation. Transplant Proc. 2010;42:3617-3619. [PubMed] [DOI] |
| 32. | Arrenberg P, Maricic I, Kumar V. Sulfatide-mediated activation of type II natural killer T cells prevents hepatic ischemic reperfusion injury in mice. Gastroenterology. 2011;140:646-655. [PubMed] [DOI] |
| 33. | Kern H, Bald C, Brill T, Fend F, von Weihern CH, Kriner M, Hüser N, Thorban S, Stangl M, Matevossian E. The influence of retrograde reperfusion on the ischaemia-/reperfusion injury after liver transplantation in the rat. Int J Exp Pathol. 2008;89:433-437. [PubMed] [DOI] |