修回日期: 2011-05-12
接受日期: 2011-05-17
在线出版日期: 2011-05-18
目的: 探讨原发性胃肠道弥漫性大B细胞淋巴瘤(PGI-DLBCL)中核转录因子κB(NF-κB)的表达及临床意义.
方法: 采用免疫组织化学方法检测PGI-DLBCL患者中CD10、Bcl-6、Mum-1、NF-κB p65的表达, 结合临床随访资料, 分析NF-κB p65与PGI-DLBCL免疫分型、临床生物学行为及预后的关系.
结果: PGI-DLBCL中CD10阳性15例(28%), Bcl-6阳性37例(69%), Mum1阳性44例(81%), 将其分为生发中心B细胞型(GCB型)19例(35%), 活化B细胞(ABC型)35例(65%). NF-κB p65阳性表达率为72%(39/54), ABC型中NF-κB p65的表达率明显高于GCB型(74.4% vs 25.6%, P<0.05). PGI-DLBCL中NF-κB p65的表达程度与结外侵犯部位有显著差异(P<0.05), 其阳性表达率在结外侵犯部位中"≥2"组的77%(10/13)表达强度大于"0-1"组的71%(29/41)(P<0.05). NF-κB p65表达阴性患者平均生存期明显长于阳性组(45.8 mo±35.9 mo vs 20.3 mo± 29.3 mo, P<0.05).
结论: NF-κB p65和ABC型呈正相关, 和PGI-DLBCL的发展和侵袭有关, 对PGI-DLBCL预后判断具有一定临床意义, 在PGI-DLBCL的高表达可作为新的治疗靶点.
引文著录: 刘方方, 葛军辉, 刘惠敏, 何金, 袁振刚, 王良哲, 马小梅. 核转录因子-κB在原发性胃肠道弥漫性大B细胞淋巴瘤中的表达及临床意义. 世界华人消化杂志 2011; 19(14): 1476-1482
Revised: May 12, 2011
Accepted: May 17, 2011
Published online: May 18, 2011
AIM: To investigate the clinical significance of nuclear factor κB (NF-κB) expression in primary gastrointestinal diffuse large B-cell lymphoma (PGI-DLBCL).
METHODS: Immunohistochemical staining was used to detect the expression of CD10, Bcl-6, Mum-1 and NF-κB p65 in PGI-DLBCL. The relationship of NF-κB p65 expression with tumor subtype, biological behavior and prognosis was analyzed.
RESULTS: Of 54 cases of PGI-DLBCL detected, 28% were positive for CD10, 69% positive for Bcl-6, and 81% positive for Mum-1; 19 were classified as germinal center B-cell-like (GCB) subtype, and 35 as activated B-cell like (ABC) subtype. The positive rate of NF-κB p65 expression in PGI-DLBCL was 72% (39/54). The positive rate of NF-κB p65 expression was significantly higher in ABC-DLBCL than in GCB-DLBCL (74.4% vs 25.6%, P < 0.05). NF-κB p65 expression was correlated with extranodal invasion site in PGI-DLBCL (P < 0.05). The overall survival time of NF-κB p65-negative PGI-DLBCL patients was longer than that of NF-κB p65-positive ones (45.8 mo ± 35.9 mo vs 20.3 mo ± 29.3 mo, P < 0.05).
CONCLUSION: NF-κB p65 expression was positively correlated with the subtype, development, and invasion of PGI-DLBCL. NF-κB p65 can be used as a prognostic factor for PGI-DLBCL and may represent a new molecular target for the therapy of GI-DLBCL.
- Citation: Liu FF, Ge JH, Liu HM, He J, Yuan ZG, Wang LZ, Ma XM. Clinical significance of nuclear factor κB expression in primary gastrointestinal diffuse large B-cell lymphoma. Shijie Huaren Xiaohua Zazhi 2011; 19(14): 1476-1482
- URL: https://www.wjgnet.com/1009-3079/full/v19/i14/1476.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i14.1476
胃肠道是结外非霍奇金淋巴瘤(non-hodgkin's lymphoma, NHL)常发生的部位, 据统计原发性胃肠道淋巴瘤(primary gastrointestinal lymphoma, PGIL)占整个NHL的4%-20%. 其中原发性胃肠道弥漫性大B细胞淋巴瘤(primary gastrointestinal diffuse large B-cell lymphoma, PGI-DLBCL)是胃肠道最常见的淋巴瘤, 占全部胃肠道淋巴瘤的40%-50%[1,2]. PGI-DLBCL的形态学和分子生物学与结内弥漫性大B细胞淋巴瘤(diffuse large B-cell lymphoma, DLBCL)无区别, 恶性程度及侵袭性比结内DLBCL高, 且与胃肠道一般疾病或癌症难以区别. 因此发现时分期较晚、误诊率较高. 由于手术切除存在致死性的并发症, 近年来将化疗作为胃肠道DLBCL的首选治疗[3,4], 而部分患者对常规化疗不敏感, 预后差. 故进一步寻找合适的治疗靶点, 对患者的治疗和预后具有重要意义. NF-κB是一类蛋白质核转录因子, 在多种肿瘤中存在着选择性激活或表达异常. 有学者认为, NF-κB持续活化是活化B淋巴细胞型弥漫性大B细胞淋巴瘤(activate B-cell like diffuse large B-cell lymphoma, ABC-DLBCL)预后不好的原因之一, NF-κB传导通路成为ABC-DLBCL潜在的治疗靶点[5,6]. 本研究通过PGI-DLBCL中NF-κB p65的表达与其免疫分型、临床特征及预后的相互关系, 试图为PGI-DLBCL中分子机制及临床治疗提供依据及指导.
收集1998-05/2010-06长征医院PGI-DLBCL患者54例, 所有病例均符合2001年WHO淋巴瘤分类DLBCL组织学标准: 肿瘤细胞呈弥漫性增生且细胞核相当于正常吞噬细胞的细胞核或淋巴细胞的细胞核的2倍. 全部病例均符合Dawson等[7]提出的PGIL的诊断标准: (1)全身体表淋巴结无肿大; (2)无纵隔淋巴结肿大; (3)外周血白细胞计数及分类正常; (4)病变以胃肠道为主或伴有局部淋巴结受累, 肝脾无原发灶. 对其临床资料、实验室检测结果进行总结, 其中男28例, 女26例, 年龄12-84(中位年龄61)岁. 54例均经胃肠镜或CT提示有占位, 胃DLBCL 30例, 肠DLBCL 24例(回盲部20例, 小肠4例). 45例标本来源于根治性或姑息性手术切除, 9例来源于淋巴结活检术. 有49例患者术后接受化疗, 其中14例行2次以上CHOP化疗方案, 13例行2次以上利妥昔单抗(rituximab)联合CHOP(R-CHOP)化疗方案, 22例术后行一般化疗方案或中药治疗. 临床分期参考Lugano分期评估[8]. 按照IPI[9]评分将患者分为低度危险组(0-1因素), 低中度危险组(2个因素), 高中度危险组(3个因素), 高度危险组(4-5个因素). 另选同期10例反应增生淋巴结组织作为对照. 随访资料通过患者门诊复查、电话随访结合信函调查获得. 随访中已死亡患者生存期为病理诊断明确当日至死亡日期的间隔月数, 计为完整数据, 随访截止仍存活者生存期为病理诊断明确当日至末次随访的间隔月数, 计为截尾数据. 末次随访时间为2010-12-31. 鼠抗人单克隆抗体CD10、Bcl-6、Mum-1(即用型)均购自福州迈新生物技术公司, 兔抗人单克隆抗体NF-κB p65(浓缩型1:150)购自Santa Cruz公司. EnVision即用型免疫组织化学试剂盒和DAB二氨基联苯胺显色剂试剂盒, 均由福州迈新生物技术公司提供.
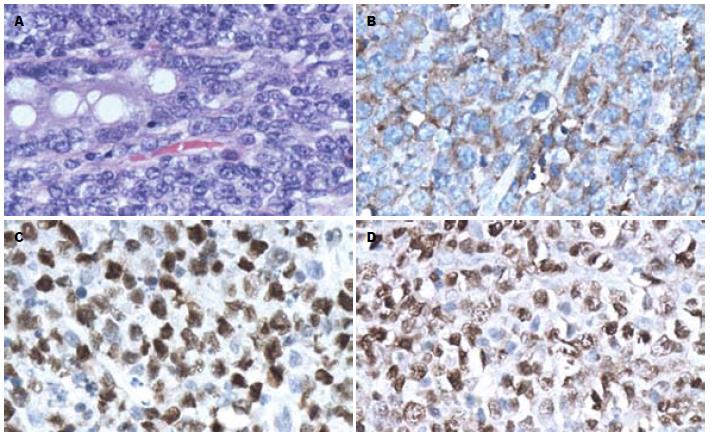
石蜡标本制成4 μm的切片, 常规脱蜡, 梯度乙醇水化, 抗原修复, 免疫组织化学EnVision法染色, DAB显色, 苏木精对比染色, 脱水, 二甲苯透明, 中性树胶封片. 同时用已知的阳性切片在同条件下染色作为阳性对照, 用PBS缓冲液代替一抗作为阴性对照. 结果判定标准: 阳性反应为细胞膜、浆内或胞核内出现黄色或棕黄色颗粒, 且其着色强度高于背景非特异性染色者. CD10定位于细胞质或胞膜, Bcl-6、Mum-1定位于细胞核. 每张切片随机选取10个高倍视野, 计算瘤细胞阳性率, 瘤细胞阳性率≤30%视为阴性[10]. NF-κB p65呈胞核着色, 每例切片随机选取10个高倍视野进行结果判定. 按染色强度及阳性细胞数占肿瘤细胞总数的百分比综合计分. 染色强度: 无色为0分, 淡黄色为1分, 棕黄色为2分, 棕褐色为3分. 阳性细胞数: 小于总数的5%为0分, 5%-25%为1分, 26%-50%为2分, 大于50%为3分. 染色强度得分与阳性细胞数得分相加, 0分为阴性(-), 1-3分为弱阳性(+), 4-5分为中度阳性(++), ≥6分为强阳性(+++)[11].
统计学处理 采用SPSS18.0统计软件. 数据百分率比较采用R×2列联表卡方检验及Fisher精确概率检验, 等级资料采用χ2检验; 生存分析采用Kaplan-Meier分析技术, 生存期差别的比较用Log-Rank时序检验. 检验效能为0.05.
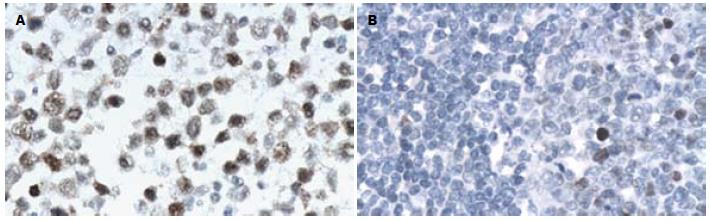
根据2004年Hans等[10]标准对采用对DLBCL进行免疫学分GCB和ABC两种亚型. CD10、Bcl-6作为生发中心细胞来源的标志物, CD10(+)或CD10(-)/Bcl-6(+), 为GCB型; CD10(-)/Bcl-6(-)为ABC型. Mum-1作为非生发中心细胞来源的标志物, 若CD10(-)/Bcl-6(+), 则用Mum-1分类: Mum-1(+)为ABC型, Mum-1 (-)为GCB型. 结果显示: 15例(28%)CD10(+), 37例(69%)Bcl-6(+), 44例(81%)Mum-1(+). GCB型19例(35%), ABC型35例(65%). NF-κB p65蛋白阳性表达主要定位于DLBCL细胞核, 呈淡黄、棕黄或棕褐色颗粒, 在PGI-DLBCL中的表达较弥漫, 程度增强, 阳性表达率为72%(39/54), 其中"+"为33%(18/54), "++"为30%(16/54), "+++"为9%(5/54). NF-κB p65在反应增生淋巴结组织中的阳性表达主要定位于淋巴滤泡生发中心成熟淋巴细胞胞核. GCB亚型中NF-κB p65的表达率为25.6%, ABC亚型中NF-κB p65的表达率为74.4%, ABC亚型中NF-κB p65的表达率明显高于GCB亚型(P<0.05, 图1, 2, 表1).
| NF-κB p65 | GCB n(%) | ABC n(%) | P值 | χ2值 |
| - | 9(60.0) | 6(40.0) | 0.018 | 5.608 |
| + | 10(25.6) | 29(74.4) |
PGI-DLBCL中NF-κB p65的表达程度与结外侵犯部位有显著差异(P<0.05), 其阳性表达率在结外侵犯部位中"≥2"组的77% (10/13)表达强度大于"0-1"组的71%(29/41). 而NF-κB p65阳性表达与患者性别、年龄、临床分期、浸润深度、淋巴结受累、肿块大小、LDH、活动状态、IPI、B症状(临床分期中每一期还应根据有无特定的全身症状而分为A或B症状: A: 无全身症状; B: 1: 发热: 无法解释的发热, 体温超过38 ℃; 2: 盗汗: 需要更换床单或被罩的大汗; 3: 体质量减轻: 诊断前6 mo内无法解释的体质量减轻超过平时体质量的10%)均无显著关系(P>0.05, 表2).
| 临床病理特征 | NF-κB/p65 | ||||
| - | + | ++ | +++ | P值 | |
| 性别 | 15 | 18 | 16 | 5 | 0.781 |
| 男 | 7 | 11 | 8 | 2 | |
| 女 | 8 | 7 | 8 | 3 | |
| 年龄(岁) | 15 | 18 | 16 | 5 | 0.821 |
| <60 | 6 | 7 | 7 | 1 | |
| ≥60 | 9 | 11 | 9 | 4 | |
| 临床分期 | 15 | 18 | 16 | 5 | 0.408 |
| Ⅰ、Ⅱ | 8 | 13 | 8 | 4 | |
| Ⅲ、Ⅳ | 7 | 5 | 8 | 1 | |
| 浸润深度 | 15 | 18 | 16 | 5 | 0.649 |
| 黏膜、黏膜下层 | 1 | 0 | 0 | 0 | |
| 固有肌层 | 1 | 3 | 1 | 1 | |
| 浆膜层 | 13 | 15 | 15 | 4 | |
| 淋巴结受累 | 15 | 18 | 16 | 5 | 0.108 |
| 无 | 3 | 4 | 7 | 2 | |
| 局部淋巴结 | 2 | 8 | 1 | 1 | |
| 更远部位淋巴结 | 10 | 6 | 8 | 2 | |
| 结外侵犯部位 | 15 | 18 | 16 | 5 | 0.024 |
| 0-1 | 12 | 17 | 8 | 4 | |
| ≥2 | 3 | 1 | 8 | 1 | |
| 肿块大小(cm) | 15 | 18 | 16 | 5 | 0.431 |
| <5 | 2 | 4 | 1 | 0 | |
| ≥5 | 13 | 14 | 15 | 5 | |
| LDH | 15 | 18 | 16 | 5 | 0.215 |
| 正常 | 9 | 16 | 10 | 3 | |
| >正常 | 6 | 2 | 6 | 2 | |
| 体能状况 | 15 | 18 | 16 | 5 | 0.713 |
| 0-1 | 12 | 15 | 13 | 3 | |
| 2-4 | 3 | 3 | 3 | 2 | |
| IPI | 15 | 18 | 16 | 5 | 0.536 |
| 低危(0-1因素) | 9 | 13 | 8 | 3 | |
| 低中危(2因素) | 1 | 3 | 1 | 1 | |
| 高中危(3因素) | 2 | 2 | 2 | 0 | |
| 高危(4因素) | 3 | 0 | 5 | 1 | |
| B症状 | 15 | 18 | 16 | 5 | 0.390 |
| 无 | 10 | 15 | 13 | 5 | |
| 有 | 5 | 3 | 3 | 0 | |
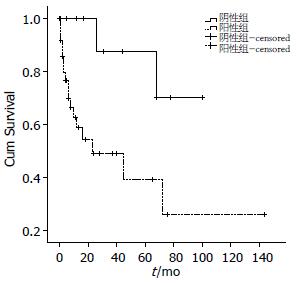
患者整体生存时间(overall survival, OS)为从诊断明确开始计算直到死亡或最后1次随访所经历的时间. 本组患者随访时间为1-144 mo, 6例失访. 其间死亡19例, 占随访者的35%. 最短存活时间仅为1 mo, 平均生存时间为26.6 mo±32.6 mo, 中位存活时间为12.5 mo. 通过Kaplan-Meier方法分析PGI-DLBCL中NF-κB p65的表达与患者预后的关系, 结果显示: NF-κB p65阴性表达患者平均生存期为45.8 mo±35.9 mo, 阳性表达患者平均为20.3 mo±29.3 mo, Log-Rank时序检验提示两组间生存期差异具有统计学意义(P<0.05, 图3).
核转录因子NF-κB最初是Sen和Baltimore[12]从B细胞的核抽提物中发现的一种能与免疫球蛋白κ链基因的增强子κB序列(GGGACTTTCC)特异性结合的核蛋白因子, 参与众多与免疫和炎症反应有关的基因转录调控[13]. 已知哺乳动物细胞中NF-κB成员有5个: NF-κB1(p50/p105)、NF-κB2(p52/p100)、c-Rel、RelA(p65)、RelB[14]. 其中p65:p50是最早被发现也是存在最广泛的二聚体形式, 因此通常所说的NF-κB指的是p65:p50复合体. NF-κB广泛存在于各种类型细胞中, 正常情况下, NF-κB与阻遏蛋白(inhibitor of kappa B, IκB)相结合以无活性的状态存在于细胞质中, 当机体面临生存危机时, 在各种因素的作用下, NF-κB进入核内开始转录, 从而调控多种细胞因子、黏附分子、转录因子等, 不仅能促进细胞增殖及肿瘤转移, 增加肿瘤的血管生成及耐药等, 更重要的是他可以上调抗凋亡基因Bcl-2或凋亡蛋白抑制因子家族成员Survivin的表达, 使肿瘤细胞逃避凋亡, 成为肿瘤细胞生存的关键因素, 从而促进肿瘤的发生、发展. NF-κB不仅在实体瘤细胞增殖、转化和肿瘤的发展中起着非常重要的作用[15-18], 而且与血液系统肿瘤密切相关. 近年, 大量研究表明, 在淋巴瘤细胞株以及淋巴瘤患者细胞都存在持续活化的NF-κB, 其种类为p50/p65和p50/p50[19].
本研究通过检测NF-κB的主要组成因子NF-κB p65, 发现其阳性表达主要定位于PGI-DLBCL细胞核, 在反应增生淋巴结中主要定位于滤泡生发中心的胞核, 这可能与淋巴滤泡的生发中心是增生最活跃的部分有关. 而Espinosa等[20]通过免疫组织化学发现NF-κB p65在DLBCL和正常淋巴结滤泡生发中心中是胞质表达, 在正常淋巴结副皮质区是胞核表达. 我们认为, NF-κB p65表达部位的不同可能是由于NF-κB在细胞中以两种状态存在, 即细胞质内的非活化状态和细胞核内的活化状态, NF-κB p65表达在细胞核上是NF-κB活化的标志, 因此观察NF-κB的病理意义, 应以出现细胞核内的表达更合适, 同李百周等[21]观点一致.
Davis等[5]发现, ABC-DLBCL细胞株中NF-κB持续活化, IκB激酶(IκB kinase, IKK)活性增强, IκBα降解加速, 而在GCB-DLBCL中未能见到这种情况. 同样Lam等[6]通过基因表达谱进一步研究发现, 高特异性的小分子IκB激酶抑制剂PS-1145和MLX105可以选择性地发挥毒性作用于ABC-DLBCL细胞株, 但对GCB-DLBCL却没有影响. 本研究通过免疫组织化学在PGI-DLBCL石蜡组织中同样发现NF-κB p65高表达, ABC亚型中NF-κB p65的表达率明显高于GCB亚型(P<0.05), 与王艳君等[22]在DLBCL中的研究结果一致. 2008年新的WHO分类也提到NF-κB在ABC亚型中有异常活化, 而GCB亚型中无此现象[23]. 在随后的NF-κB p65和临床特征之间的关系研究中我们发现NF-κB p65的表达程度与结外侵犯部位有相关性(P<0.05), 据此推测NF-κB p65和PGI-DLBCL的发展和侵袭呈正相关. 而且已有研究表明多部位累及发病可能是部分患者预后差、疾病进展迅速的重要因素[24], 结外浸润病灶愈多预后愈差, 临床分期是影响胃肠道淋巴瘤预后的重要因素, 肿瘤浸润至黏膜、黏膜下层或肌层对患者的长期生存影响不大, 而一旦累及浆膜外组织、邻近淋巴结和组织器官则预后较差. 原发肿瘤直径<5 cm者预后较好[25]. 但本研究并未发现其与临床Ⅲ/Ⅳ期、IPI、出现B症状等有明确的相关性, 与黄忠连等[26]、昌红等[27]的研究结果不一致. 其原因可能是与PGI-DLBCL的异质性有关, 也与本研究对象住院治疗患者中分布不均有关, 这有待于进一步扩大样本量, 进行进一步判定研究.
本研究经Kaplan-Meier生存分析显示NF-κB p65阳性表达组患者生存期明显低于阴性组(P<0.05), 提示NF-κB p65蛋白表达显示预后不良, 可以作为一个很有前途的针对ABC-DLBCL的治疗靶点. 新的免疫化学疗法R-CHOP已成为侵袭性B细胞淋巴瘤新的标准治疗方案, Nakanishi等[28]发现单纯CHOP治疗主要是通过抑制拓扑酶Ⅱ的活性, 随之导致DNA的断裂而抑制肿瘤细胞增殖和死亡, 而不良反应是增强NF-κB活性, 从而使肿瘤细胞逃避凋亡. Pavan等[29]推测利妥昔单抗可能是通过抑制IKK复合物的活性来抑制NF-κB激活, 从而恢复肿瘤化疗药的敏感性. R-CHOP方案在DLBCL治疗上的成功经验正在进一步增长了减少胃肠道DLBCL手术治疗的趋势. 2003年美国FDA首先批准蛋白水解酶抑制剂硼替佐米用于复发难治性多发性骨髓瘤, 主要通过阻止IκB水解达到抑制NF-κB活化目的. Dunleavy等[30]对复发难治性DLBCL采用硼替佐米联合单纯化疗方法, 发现ABC-DLBCL患者可从使用硼替佐米中受益, 可以进一步大样本的临床试验.
NF-κB活性的失调能引起包括肿瘤和炎症在内的很多人类病症, 随着NF-κB抑制细胞凋亡作用机制的研究深入, 并应用于各种疾病的治疗, 人们发现NF-κB在不同的刺激因素及特定的细胞类型中还有促进细胞凋亡的作用[31], 且有学者发现NF-κB的表达在T淋巴细胞淋巴瘤有好的预后[32], 这可能跟激活的NF-κB亚单位的种类及数量有关[33]. NF-κB在PGI-DLBCL发病过程中的信号传导途径和调控的分子基础需要做进一步的研究, 相信以NF-κB为靶点的肿瘤基因治疗及新药开发将为肿瘤治疗的研究开辟一个新领域.
原发性胃肠道弥漫性大B细胞淋巴瘤(PGI-DLBCL)在临床上恶性程度及侵袭性比结内DLBCL高, 且与胃肠道一般疾病或癌症难以区别, 因此发现时分期较晚、误诊率较高, 且其标准治疗的方法仍未确定. 因此, 迫切需要寻找适合的分子靶点, 为PGI-DLBCL临床诊治提供指导.
宋军, 副教授, 武汉协和医院消化科
NF-κB是一类蛋白质核转录因子, 在多种肿瘤中存在着选择性激活或表达异常. 有学者认为, NF-κB持续活化是活化B细胞型弥漫性大B细胞淋巴瘤(ABC-DLBCL)预后不好的原因之一, NF-κB传导通路成为ABC-DLBCL潜在的治疗靶点. 从不同角度研究NF-κB通路上的信号分子, 找到抑制NF-κB活性的靶点, 则能诱导细胞凋亡, 抑制肿瘤的生长, 这也一直是国内外学者研究的热点领域.
Espinosa等通过免疫组织化学发现NF-κB p65在DLBCL和正常淋巴结滤泡生发中心中是胞质表达, 在正常淋巴结副皮质区是胞核表达.
国内外尚未有文献对NF-κB在胃肠道DLBCL中的表达与免疫分型、各个临床特征及预后相关性作过系统研究. 本研究首次利用Lugano分期对PGI-DLBCL患者进行临床分期, 通过NF-κB p65在54例均为PGI-DLBCL外科术后石蜡组织中的表达, 全面系统地研究其在胃肠道DLBCL的临床意义, 为寻找PGI-DLBCL发病的分子机制及临床治疗提供理论依据.
NF-κB p65蛋白在PGI-DLBCL的ABC亚型中高表达, 提示NF-κB可以作为PGI-DLBCL中一个很有前途的治疗靶点. 今后PGI-DLBCL的治疗方向将趋向于个体化, 根据患者的临床特征、免疫分型及免疫组化指标等因素制定恰当的治疗方案将会有助于提高临床疗效. 由于NF-κB活性失调能引起很多疾病, 因此NF-κB活化途径中的关键因子均可作为药物设计筛选的靶标.
本文新颖性较好, 对原发性胃肠道弥漫性大B细胞淋巴瘤生物靶向治疗和临床有一定指导价值, 有利于提高消化科医师对该病的认识.
编辑: 曹丽鸥 电编:何基才
| 1. | van Krieken JH, Otter R, Hermans J, van Groningen K, Spaander PJ, van de Sandt MM, Keuning JF, Kluin PM. Malignant lymphoma of the gastrointestinal tract and mesentery. A clinico-pathologic study of the significance of histologic classification. NHL Study Group of the Comprehensive Cancer Center West. Am J Pathol. 1989;135:281-289. [PubMed] |
| 3. | Raderer M, Chott A, Drach J, Montalban C, Dragosics B, Jäger U, Püspök A, Osterreicher C, Zielinski CC. Chemotherapy for management of localised high-grade gastric B-cell lymphoma: how much is necessary? Ann Oncol. 2002;13:1094-1098. [PubMed] [DOI] |
| 4. | Ferreri AJ, Cordio S, Ponzoni M, Villa E. Non-surgical treatment with primary chemotherapy, with or without radiation therapy, of stage I-II high-grade gastric lymphoma. Leuk Lymphoma. 1999;33:531-541. [PubMed] |
| 5. | Davis RE, Brown KD, Siebenlist U, Staudt LM. Constitutive nuclear factor kappaB activity is required for survival of activated B cell-like diffuse large B cell lymphoma cells. J Exp Med. 2001;194:1861-1874. [PubMed] [DOI] |
| 6. | Lam LT, Davis RE, Pierce J, Hepperle M, Xu Y, Hottelet M, Nong Y, Wen D, Adams J, Dang L. Small molecule inhibitors of IkappaB kinase are selectively toxic for subgroups of diffuse large B-cell lymphoma defined by gene expression profiling. Clin Cancer Res. 2005;11:28-40. [PubMed] |
| 7. | Dawson IM, Cornes JS, Morson BC. Primary malignant lymphoid tumours of the intestinal tract. Report of 37 cases with a study of factors influencing prognosis. Br J Surg. 1961;49:80-89. [PubMed] [DOI] |
| 8. | 沈 志祥, 石 元凯, 朱 雄增. 淋巴瘤特殊问题诊治对策. 第1版, 上海: 科学技术出版社 2009; 227-228. |
| 9. | A predictive model for aggressive non-Hodgkin's lymphoma. The International Non-Hodgkin's Lymphoma Prognostic Factors Project. N Engl J Med. 1993;329:987-994. [PubMed] [DOI] |
| 10. | Hans CP, Weisenburger DD, Greiner TC, Gascoyne RD, Delabie J, Ott G, Müller-Hermelink HK, Campo E, Braziel RM, Jaffe ES. Confirmation of the molecular classification of diffuse large B-cell lymphoma by immunohistochemistry using a tissue microarray. Blood. 2004;103:275-282. [PubMed] [DOI] |
| 11. | Mattern J, Koomägi R, Volm M. Association of vascular endothelial growth factor expression with intratumoral microvessel density and tumour cell proliferation in human epidermoid lung carcinoma. Br J Cancer. 1996;73:931-934. [PubMed] [DOI] |
| 12. | Sen R, Baltimore D. Inducibility of kappa immunoglobulin enhancer-binding protein Nf-kappa B by a posttranslational mechanism. Cell. 1986;47:921-928. [PubMed] [DOI] |
| 13. | Sintara K, Thong-Ngam D, Patumraj S, Klaikeaw N, Chatsuwan T. Curcumin suppresses gastric NF-kappaB activation and macromolecular leakage in Helicobacter pylori-infected rats. World J Gastroenterol. 2010;16:4039-4046. [PubMed] [DOI] |
| 14. | Hayden MS, Ghosh S. Shared principles in NF-kappaB signaling. Cell. 2008;132:344-362. [PubMed] [DOI] |
| 15. | Kalaitzidis D, Gilmore TD. Transcription factor cross-talk: the estrogen receptor and NF-kappaB. Trends Endocrinol Metab. 2005;16:46-52. [PubMed] [DOI] |
| 16. | Sclabas GM, Uwagawa T, Schmidt C, Hess KR, Evans DB, Abbruzzese JL, Chiao PJ. Nuclear factor kappa B activation is a potential target for preventing pancreatic carcinoma by aspirin. Cancer. 2005;103:2485-2490. [PubMed] [DOI] |
| 17. | Karin M, Cao Y, Greten FR, Li ZW. NF-kappaB in cancer: from innocent bystander to major culprit. Nat Rev Cancer. 2002;2:301-310. [PubMed] [DOI] |
| 18. | 王 以浪, 姚 登福, 吴 玮, 于 洪波, 赛 文莉, 钱 静, 李 姗姗, 卞 银珠. 肝癌组织核转录因子-κB表达与HBV复制及其临床病理学特征. 世界华人消化杂志. 2009;17:265-269. [DOI] |
| 19. | Mathas S, Jöhrens K, Joos S, Lietz A, Hummel F, Janz M, Jundt F, Anagnostopoulos I, Bommert K, Lichter P. Elevated NF-kappaB p50 complex formation and Bcl-3 expression in classical Hodgkin, anaplastic large-cell, and other peripheral T-cell lymphomas. Blood. 2005;106:4287-4293. [PubMed] [DOI] |
| 20. | Espinosa I, Briones J, Bordes R, Brunet S, Martino R, Sureda A, Sierra J, Prat J. Activation of the NF-kappaB signalling pathway in diffuse large B-cell lymphoma: clinical implications. Histopathology. 2008;53:441-449. [PubMed] [DOI] |
| 21. | 李 百周, 周 晓燕, 陆 洪芬, 范 月珍, 施 达仁. MALT淋巴瘤中bcl-10与NF-κB的表达及其意义探讨. 临床与实验病理学杂志. 2007;23:650-652. |
| 23. | WHO Classification of Tumors of Haematopoietic and Lymphoid Tissues. The International Agency for Research on Cancer. Lyon: IARC press 2008; 236. |
| 28. | Nakanishi C, Toi M. Nuclear factor-kappaB inhibitors as sensitizers to anticancer drugs. Nat Rev Cancer. 2005;5:297-309. [PubMed] [DOI] |
| 29. | Pavan A, Spina M, Canzonieri V, Sansonno S, Toffoli G, De Re V. Recent prognostic factors in diffuse large B-cell lymphoma indicate NF-kappaB pathway as a target for new therapeutic strategies. Leuk Lymphoma. 2008;49:2048-2058. [PubMed] [DOI] |
| 30. | Dunleavy K, Pittaluga S, Czuczman MS, Dave SS, Wright G, Grant N, Shovlin M, Jaffe ES, Janik JE, Staudt LM. Differential efficacy of bortezomib plus chemotherapy within molecular subtypes of diffuse large B-cell lymphoma. Blood. 2009;113:6069-6076. [PubMed] [DOI] |
| 32. | Martínez-Delgado B, Cuadros M, Honrado E, Ruiz de la Parte A, Roncador G, Alves J, Castrillo JM, Rivas C, Benítez J. Differential expression of NF-kappaB pathway genes among peripheral T-cell lymphomas. Leukemia. 2005;19:2254-2263. [PubMed] [DOI] |
| 33. | Chen X, Kandasamy K, Srivastava RK. Differential roles of RelA (p65) and c-Rel subunits of nuclear factor kappa B in tumor necrosis factor-related apoptosis-inducing ligand signaling. Cancer Res. 2003;63:1059-1066. [PubMed] |