修回日期: 2011-04-18
接受日期: 2011-04-21
在线出版日期: 2011-05-18
目的: 探讨新疆蜂胶挥发油对体外培养的大肠癌细胞HCT-116细胞增生、细胞周期和凋亡的影响.
方法: 采用四甲基偶氮唑盐(MTT)显色法, 检测不同浓度蜂胶挥发油作用不同时间对HCT-116细胞生长所产生的不同影响; 倒置显微镜观察凋亡细胞的形态特点; PI染色、流式细胞仪检测细胞周期分布; Annexin V-FITC/PI双染色、流式细胞仪检测细胞凋亡率.
结果: 蜂胶挥发油能抑制HCT-116细胞生长, 其抑制活性与5-氟尿嘧啶(5-FU)一致, 在一定剂量和时间范围内, 可见凋亡细胞明显增多, 给予5、10、20 mg/L蜂胶挥发油处理HCT-116细胞24 h后, 较对照组G0/G1期细胞(%)增多(57.57±2.31, 67.94±1.90, 86.09±1.72 vs 44.60±3.43, 均P<0.01), S期细胞(%)减少(33.51±3.40, 27.30±4.65, 7.30±4.76 vs 47.78±4.54, 均P<0.01), G2/M期细胞无明显变化, 细胞凋亡率明显上升, 呈剂量依赖性(58.33%±2.44%, 44.53%±2.59%, 35.40%±0.42% vs 4.38%±0.92%, 均P<0.01).
结论: 新疆蜂胶挥发油对HCT-116细胞具有明显的增殖抑制作用, 其机制与其阻滞细胞周期和诱导凋亡有关.
引文著录: 阿布力克木•吾甫尔, 依米提•热合曼, 吐尔逊娜依•阿布都热依木, 阿尔孜古丽•吐尔逊, 木塔力甫•艾买提. 新疆蜂胶挥发油对结直肠癌HCT-116细胞增生、周期及凋亡的影响. 世界华人消化杂志 2011; 19(14): 1469-1475
Revised: April 18, 2011
Accepted: April 21, 2011
Published online: May 18, 2011
AIM: To study the effect of essential oils extracted from XinJiang propolis on cell proliferation, cell cycle progression and apoptosis in human colorectal cancer cell line HCT-116.
METHODS: After HCT-116 cells were treated with different concentrations of essential oils for different durations, cell growth was evaluated by MTT assay; cell cycle progression was analyzed by flow cytometry (FCM) with propidium iodide (PI) staining; apoptosis was detected by FCM with annexin V-FITC/PI double labeling.
RESULTS: Treatment with essential oils inhibited the growth of HCT-116 cells. FCM analysis showed that treatment with 5.0, 10, and 20 mg/L of essential oils for 24 h increased the proportion of cells in G0/G1 phase (57.57 ± 2.31, 67.94 ± 1.90, 86.09 ± 1.72 vs 44.60 ± 3.43, all P < 0.01), decreased the proportion of cells in S phase (33.51 ± 3.40, 27.30 ± 4.65, 7.30 ± 4.76 vs 47.78 ± 4.54, all P < 0.01), and increased the apoptosis rate (58.33% ± 2.44%, 44.53% ± 2.59%, 35.40% ± 0.42% vs 4.38% ± 0.92%, all P < 0.01), suggesting a dose-dependent effect.
CONCLUSION: Essential oils inhibited the proliferation of human colorectal cancer HCT-116 cells by inducing cell cycle arrest and apoptosis.
- Citation: Ablikim•Ghupur, Yimit•Rahman, Tursunay•Abdureyim, Aerziguli•Tuerxun, Mutallip•Amet. Effect of essential oils extracted from Xinjiang propolis on cell proliferation, cell cycle progression and apoptosis in human colorectal cancer cell line HCT-116. Shijie Huaren Xiaohua Zazhi 2011; 19(14): 1469-1475
- URL: https://www.wjgnet.com/1009-3079/full/v19/i14/1469.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i14.1469
天然物蜂胶(propolis)是蜜蜂从植物花苞及树干上采集的树胶, 混入其上颚腺分泌物和蜂蜡等物质而成的一种具有芳香气味的胶状固体物质[1]. 蜂胶从公元前300年开始作为民间药物广泛使用[2]. 蜂胶具有抗氧化[3-5]、抗菌[6-9]、抗炎[10,11]、抗肿瘤[12-15]等多种生物活性作用. 蜂胶成分及其生物活性取决于其收集产地[16-18], 由于蜂胶的化学成分十分复杂, 迄今发现的有300多种成分[19,20]. 蜂胶挥发油是蜂胶中的挥发性芳香组分, 一般采用水蒸气蒸馏法、有机溶剂萃取或超临界CO2萃取法从蜂胶中提取, 他是蜂胶中的重要活性组分, 约占蜂胶成分的10%. 蜂胶挥发油化学成分也较为复杂, 含有多种生物活性较强或具有芳香气味的萜烯类、芳香族、脂肪族及其含氧衍生物如醇、醛、酮、酸、酚、醚、酯、内酯等. 近年来国内外学者对蜂胶及其挥发油成分的抗肿瘤作用及其活性组分进行了大量研究, 取得了一定的进展. 1988年Grunberger等[21]从以色列的蜂胶中首次分离出咖啡酸苯乙酯(caffeic acid phenethyl ester, CAPE), 近年来国外研究报道, CAPE作为蜂胶抗肿瘤作用的主要活性成分, 对人白血病[22]、结肠癌[23]、乳腺癌[24]、宫颈癌[25]、黑色素瘤[21]等细胞均有抑制增殖和诱导凋亡作用. 日本国立预防卫生研究所的研究证明, 蜂胶中的二萜类等化合物对肿瘤具有特异性杀伤作用[26], 癌症患者在服用蜂胶后, 不仅癌细胞可以消失, 而且能减轻化疗、放疗引起的不良反应. Matsuno等采用高效液相色谱法从巴西蜂胶中分离出3, 5-二异戊二烯基-4-羟基肉桂酸(artepillin C)[27], 该化合物对肿瘤细胞表现出明显的细胞毒性[27], 他的抗肿瘤活性并不亚于常规的化疗药物5-氟尿嘧啶(5-FU). 日本Awale等[28]从巴西蜂胶中分离出3种新的化合物, 其中(6aR, 11aR)-3, 8-dihydroxy-9-methoxypterocarpan(12.5 μmol/L)对人胰腺癌细胞PANC-1具有很强的杀死作用. 我们采用水蒸气蒸馏法从新疆伊犁蜂胶中分离出挥发油成分, 并对其进行GC-MS成分分析, 从中共分离出59个峰, 经核对标准谱图及有关资料, 鉴定出其中的42个化合物. 这些化合物中含有萜烯类及其衍生物, 即有机酸类、烯烃类、脂肪酸类、芳香类、酯类、醇类以及少量的酚、醛、酮类等物质成分. 文献报道蜂胶挥发油所含的一些化合物特别是萜烯类及其衍生物和有机酸类具有抗肿瘤活性, 但对不同肿瘤细胞的作用存在不一致的结果. 本研究根据从蜂胶中分离出的新疆伊犁蜂胶挥发油含有萜烯类, 有机酸类等多种活性成分的实验依据, 进一步研究新疆伊犁蜂胶挥发油对体外培养的结直肠癌HCT-116细胞的增殖抑制作用及其对细胞周期和凋亡的影响, 并探讨其抗肿瘤作用的机制, 为开发新疆伊犁蜂胶挥发油所含的某些化合物成为新的抗肿瘤药物提供重要的实验数据.
蜂胶采至新疆伊犁那拉提养蜂场, 采集时间是2009-10. 蜂胶挥发油是采用水蒸气蒸馏法从蜂胶中分离, 并进一步对其进行纯化. 结直肠癌细胞株HCT-116购自中国科学院上海细胞生物学研究所细胞库. 二甲基亚砜(DMSO)、四甲基偶氮唑盐(MTT)为Sigma公司产品. MocCoys 5A培养基由Hyclone公司提供、胎牛血清由Gibco公司提供. 细胞周期检测试剂盒为凯基生物公司产品, Annexin V-FITC凋亡检测试剂盒为珠海健康元生物医药有限公司产品. 流式细胞仪为美国贝克曼库尔特(Beckman)公司所生产.
1.2.1 细胞培养: HCT-116细胞置孵箱(37 ℃, 50 mL/L CO2)内培养, 给予100 mL/L胎牛血清的MocCoys 5A培养基, 其内另加1.0×105 U/L青霉素和链霉素, 调pH至7.2. 根据细胞生长状况每2-3 d换液1次, 当细胞生长进入对数生长期时, 分别给予蜂胶挥发油和5-FU, 临用前以DMSO溶解配成浓度分别为160、80 g/L的母液, 用MocCoys 5A培养液稀释成不同浓度(MocCoys 5A培养液中DMSO浓度<0.1%).
1.2.2 蜂胶挥发油对结直肠癌HCT-116细胞增殖抑制作用的检测: 取对数生长期的HCT-116细胞, 用2.5 g/L胰蛋白酶消化培养细胞, 用含100 mL/L胎牛血清的McCoys 5A培养液配成单个细胞悬液, 以每孔4×103个细胞接种于96孔培养板培养, 将培养板移入CO2孵箱中, 在37 ℃、50 mL/L CO2及饱和湿度条件下常规培养. 24 h后吸除原培养液, 加入含蜂胶挥发油浓度分别为5、10、20、40、80、160 mg/L的McCoys 5A培养液200 μL, 并设对照组(仅加相同浓度的DMSO), 另设只加培养液, 不加细胞和药物的空白组. 此外再设含40、80 mg/L 5-FU的McCoys 5A培养液为阳性对照, 其结果用于蜂胶挥发油和5-FU的活性对比, 以上各组均设6个复孔. 分别将各组细胞继续培养24、48、72、96 h后, 进行MTT实验. 每孔加入MTT溶液(5 g/L)20 μL, 继续培养4 h, 终止培养, 小心吸弃孔内培养上清液, 每孔加入DMSO 150 μL, 轻轻振荡10 min, 使结晶充分溶解, 用酶联免疫标记分析仪在490 nm波长处测定各孔的吸光度A值(A490), 按下列公式计算细胞生长抑制率: 细胞生长抑制率R = [1-(A实验组-A空白组)/(A对照组-A空白组)]×100%.
1.2.3 用倒置显微镜动态观察细胞形态学变化: 取对数生长期的HCT-116细胞, 用2.5 g/L胰蛋白酶消化后, 以每孔5×104个细胞接种于6孔培养板培养, 24 h后吸除原培养液, 加入蜂胶挥发油浓度分别为5、10、20、40、80、160 mg/L的McCoys 5A培养液2 mL, 继续培养24 h后, 用倒置显微镜观察细胞形态学变化.
1.2.4 蜂胶挥发油对结直肠癌细胞株HCT-116细胞周期的影响: 取对数生长期的HCT-116细胞, 用2.5 g/L胰蛋白酶消化后, 以每孔5×104个细胞接种于6孔培养板培养, 24 h后吸除原培养液, 加入蜂胶挥发油浓度分别为5、10、20 mg/L的McCoys 5A培养液2 mL, 设培养液中不加药物(加相同浓度的DMSO)的为对照组, 继续培养24 h后, 用2.5 g/L胰蛋白酶消化成单细胞悬液, 收集细胞, 离心(2 000 r/min, 4 ℃)5 min后弃上清, 用PBS重悬, 离心(2 000 r/min, 4 ℃), 弃上清, 再次重悬离心(2 000 r/min, 4 ℃)后弃上清 , 缓慢加入体积分数为700 mL/L预冷的乙醇固定, 4 ℃过夜. 染色前用PBS洗涤, 离心(2 000 r/min, 4 ℃)5 min, 去除固定液, 用100 μL RNaseA消化, 37 ℃水浴30 min, 再加入400 μL碘化丙啶(propdium iodide, PI)染色液混匀, 4 ℃避光染色30 min, 流式细胞仪进行DNA含量和细胞周期分析, 得出细胞各周期的百分率.
1.2.5 蜂胶挥发油对结直肠癌细胞株HCT-116细胞凋亡的影响: 取对数生长期的HCT-116细胞经2.5 g/L胰蛋白酶消化后, 以每孔5×104个细胞接种于6孔培养板培养, 24 h后吸除原培养液, 加入蜂胶挥发油浓度分别为 5、10、20 mg/L的McCoys 5A培养液2 mL, 设培养液中不加药物(加相同浓度的DMSO)的为对照组, 继续培养24 h后收集细胞, 离心(1 500 r/min, 4 ℃)5 min后弃上清, 用PBS重悬细胞并计数, 取大约1.5×105细胞悬浮液, 离心(1 500 r/min, 4 ℃), 弃上清, 再次重悬离心后弃上清, 加入500 μL的1×Binding Buffer (用蒸馏水稀释10×Binding Buffer), 再加入5 μL Annexin V-FITC和10 μL PI, 轻轻混匀. 在室温下, 避光反应5-15 min, 在1 h内进行流式细胞仪检测, 检测时激发波长Ex = 488 nm, 发射波长Em = 530 nm, FITC的绿色荧光FITC通道为FL1, PI红色荧光PI通道为FL2.
统计学处理 所有数据均以mean±SD表示. 以SPSS17.0版专用统计分析软件对各组数据进行t检验. 以CalcuSyn Demo Version 1.1.4统计软件计算IC50.
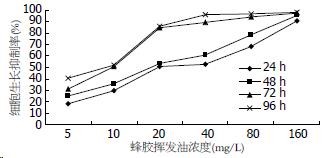
用蜂胶挥发油分别作用24、48、72、96 h后HCT-116细胞的生长明显受到抑制(图1), 随着蜂胶挥发油浓度的增加和作用时间的延长, HCT-116细胞的增殖抑制率逐渐升高, 抑制作用表现剂量依赖性和时间依赖性(表1). 蜂胶挥发油作用结直肠癌HCT-116细胞24、48、72、96 h后的IC50分别为25.95、19.50、9.68、8.24 mg/L. 40、80 mg/L蜂胶挥发油组的吸光度A值以不同时间段分别与40、80 mg/L 5-FU组比较均无显著性差异(P>0.05). 蜂胶挥发油对HCT-116细胞的抑制作用与经典的抗癌药物5-FU一致.
| 蜂胶挥发油浓度(mg/L) | 24 h | 48 h | 72 h | 96 h |
| 0 | 0.0 | 0.0 | 0.0 | 0.0 |
| 5 | 18.3 | 24.7 | 31.4 | 40.4 |
| 10 | 29.4 | 36.1 | 50.8 | 52.1 |
| 20 | 51.0 | 53.5 | 84.3 | 85.6 |
| 40 | 52.7 | 60.9 | 89.5 | 95.7 |
| 80 | 68.3 | 78.3 | 93.8 | 96.7 |
| 160 | 90.5 | 95.1 | 97.6 | 97.8 |
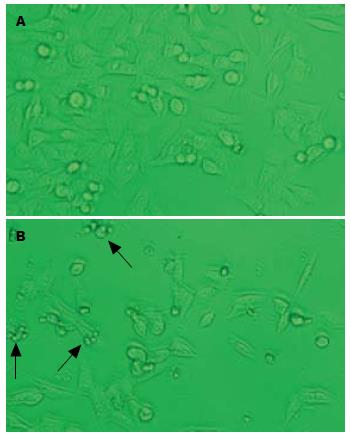
不同浓度的蜂胶挥发油作用HCT-116细胞24 h后, 在倒置显微镜下均可见悬浮细胞增多, 细胞质混浊, 细胞胞体缩小、变圆、皱缩, 核固缩碎裂, 细胞折光性减弱, 细胞内出现颗粒样物质, 培养液中有较多的细胞碎片. 以20 mg/L蜂胶挥发油组最明显(图2), 结果提示, 20 mg/L蜂胶挥发油作用24 h后HCT-116细胞的生长明显受到抑制.
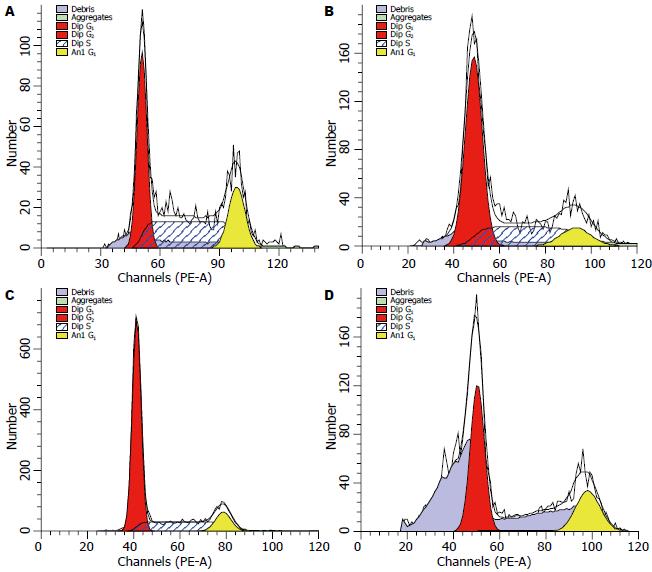
结直肠癌HCT-116细胞经5、10、20 mg/L的蜂胶挥发油作用24 h后, 细胞G0/G1期比例增加, S期比例细胞明显减少, 在G0/G1期和S期各浓度蜂胶挥发油组与对照组比较差异均有显著性(P<0.01). 而且随着蜂胶挥发油剂量的增加, G0/G1期细胞比例逐渐增加, S期细胞比例逐渐下降, 10 mg/L组G0/G1期和S期细胞比例分别与5 mg/L组比较均有显著性差异(P<0.01, P<0.05). 20 mg/L组G0/G1期和S期细胞比例与10 mg/L组比较, 差异极显著(P<0.01), 而G2/M期比例均无明显变化(表2, 图3).
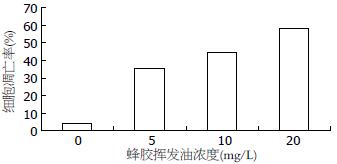
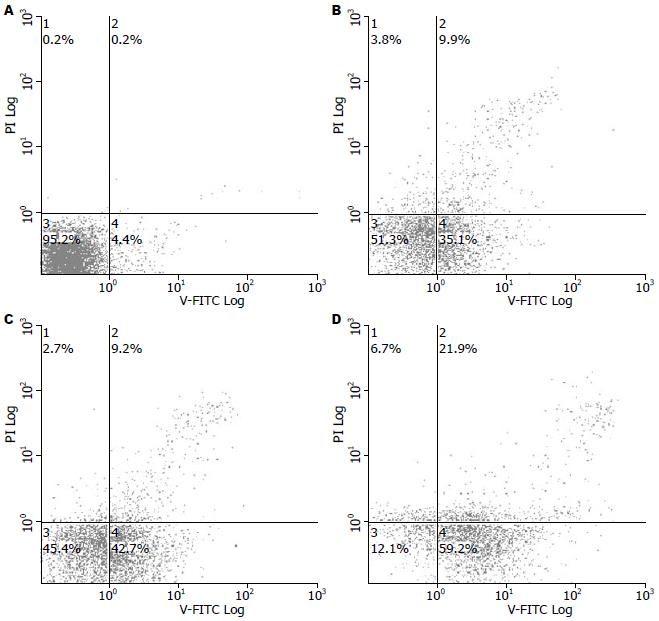
对照组HCT-116细胞自然凋亡率为4.38%±0.92%, 5、10、20 mg/L的蜂胶挥发油作用24 h后凋亡率分别为35.40%±0.42%, 44.53%±2.59%, 58.33%±2.44%, 均显著高于对照组(P<0.01), 随着蜂胶挥发油剂量的增加, 凋亡率逐渐增加(图4, 5). 10 mg/L组凋亡率与5.0 mg/L组比较, 20 mg/L组凋亡率与10 mg/L组比较差异极显著(P<0.01).
结直肠癌是我国最常见的恶性肿瘤之一, 其发病呈上升趋势[23], 严重威胁人民生命健康, 积极探索更为有效、安全的治疗方法具有重要的临床意义. 我们应用蜂胶挥发油作用人结肠癌HCT-116细胞24、48、72、96 h, 发现蜂胶挥发油能明显抑制细胞增生, 随着蜂胶挥发油浓度的增加和作用时问的延长, 其对HCT-116细胞生长的抑制率逐渐升高, 抑制作用表现为剂量依赖性和时间依赖性.
从形态学角度观察不同浓度的蜂胶挥发油作用HCT-116细胞24 h后细胞形状的变化, 发现细胞出现核固缩、核碎裂、染色质边集和凋亡小体等典型的凋亡形态学特征.
我们发现, 蜂胶挥发油作用HCT-116细胞24 h后, 细胞受阻于G0/G1期, S期细胞减少, 且呈剂量依赖性. 在一个完整的细胞周期中, 有多个影响各时期间过渡的限制点, 他们分别处在由G1期到M期和M期到G1期的过渡阶段中. 由于不同生物细胞的增生周期时间不同, 主要表现在G1期持续时间的差异, 而且G1期的启动是细胞周期的关键. 因此G1-S期的调控尤为重要. G1期阻滞使HCT-116细胞生长周期延长, 细胞的恶性增生相应减慢. S期即DNA合成期, 可反映细胞的增生情况. S期细胞占细胞周期的比例高则提示DNA合成活跃, 细胞增生活跃. 与此相反, S期细胞比例低则意味DNA合成缓慢, 细胞增生减慢, 一般而言, 肿瘤细胞的S期比例较正常细胞要高, 其增生活性也较正常细胞高. 因此, 我们能够表明蜂胶挥发油可调控细胞周期, 使细胞受阻于G0/G1期, 而不能进入S期, 限制细胞增生.
我们应用Annexin V-FITC/PI双染色法检测蜂胶挥发油对HCT-116细胞凋亡的影响, 该方法是目前检测凋亡的最敏感的方法之一, 能检测出早期凋亡细胞, 并能区分出坏死细胞. 本项研究结果显示, 蜂胶挥发油作用HCT-116细胞24 h后, 细胞凋亡率明显升高, 呈剂量依赖性特点. 根据现有的研究结果认为, 蜂胶挥发油在体外对肿瘤具有较强的诱导凋亡作用, 可能是通过抑制凋亡调控基因Bcl-2表达, 激活凋亡相关基因Fas、Bax, 启动细胞凋亡过程等而诱发HCT-116细胞凋亡[29], 本项研究的结果还需要进一步深入研究证实.
天然物蜂胶(propolis)是蜜蜂从植物花苞及树干上采集的树胶, 混入其上颚腺分泌物和蜂蜡等物质而成的一种具有芳香气味的胶状固体物质. 蜂胶挥发油是蜂胶中的挥发性芳香组分, 一般采用水蒸气蒸馏法、有机溶剂萃取或超临界CO2萃取法从蜂胶中提取, 他是蜂胶中的重要活性组分, 约占蜂胶成分的10%.
刘丽江, 教授, 江汉大学医学院病理学与病理生理学教研室
1988年Grunberger等从以色列的蜂胶中首次分离出具有抗癌作用的CAPE. 1991年, 日本国立预防卫生研究所松野哲也博士研究证明, 蜂胶中的二萜类等化合物对肿瘤具有特异性杀伤作用. 1997年, Matsuno等采用高效液相色谱法从巴西蜂胶中分离出artepillin C, 他的抗肿瘤活性不亚于常规的化疗药物5-氟尿嘧啶.
本研究首次通过测定新疆产蜂胶挥发油的抗大肠癌细胞活性, 为实现蜂胶产品产业化, 标准化, 进一步将其开发成新型抗大肠癌药物打下坚实的基础. 本研究同时对新疆蜂胶挥发油的抗结直肠癌细胞作用机制研究奠定了一定基础.
本研究表明, 蜂胶挥发油对HCT- 116细胞具有明显的增生抑制作用. 本实验首次研究分析的新疆伊犁蜂胶挥发油所含的一些化合物有希望研究为新的抗肿瘤药物.
本文科学性较好, 对开发新的抗肿瘤药物具有重要的潜在的临床意义.
编辑: 曹丽鸥 电编:何基才
| 1. | Banskota AH, Tezuka Y, Adnyana IK, Ishii E, Midorikawa K, Matsushige K, Kadota S. Hepatoprotective and anti-Helicobacter pylori activities of constituents from Brazilian propolis. Phytomedicine. 2001;8:16-23. [PubMed] [DOI] |
| 2. | Banskota AH, Tezuka Y, Prasain JK, Matsushige K, Saiki I, Kadota S. Chemical constituents of Brazilian propolis and their cytotoxic activities. J Nat Prod. 1998;61:896-900. [PubMed] [DOI] |
| 3. | Sheng JC, Zhou J, Wang L, Xu J, Hu QH. Antioxidant activity of ethanol and petroleum ether extracts from Brazilian propolis. J Eur Food Res Technol. 2007;225:249-253. [DOI] |
| 4. | Mohammadzadeh S, Sharriatpanahi M, Hamedi M, Amanzadeh Y, Ebrahimi SES, Ostad SN. Antioxidant power of Iranian propolis extract. J Food Chemistry. 2007;103:729-733. [DOI] |
| 5. | Kanbur M, Eraslan G, Silici S. Antioxidant effect of propolis against exposure to propetamphos in rats. Ecotoxicol Environ Saf. 2009;72:909-915. [PubMed] [DOI] |
| 6. | Bastos EM, Simone M, Jorge DM, Soares AE, Spivak M. In vitro study of the antimicrobial activity of Brazilian propolis against Paenibacillus larvae. J Invertebr Pathol. 2008;97:273-281. [PubMed] [DOI] |
| 7. | Ramanauskiene K, Inkeniene AM, Savickas A, Masteikova R, Brusokas V. Analysis of the antimicrobial activity of propolis and lysozyme in semisolid emulsion systems. Acta Pol Pharm. 2009;66:681-688. [PubMed] |
| 8. | Kujumgiev A, Tsvetkova I, Serkedjieva Y, Bankova V, Christov R, Popov S. Antibacterial, antifungal and antiviral activity of propolis of different geographic origin. J Ethnopharmacol. 1999;64:235-240. [PubMed] [DOI] |
| 9. | Murad JM, Calvi SA, Soares AM, Bankova V, Sforcin JM. Effects of propolis from Brazil and Bulgaria on fungicidal activity of macrophages against Paracoccidioides brasiliensis. J Ethnopharmacol. 2002;79:331-334. [PubMed] [DOI] |
| 10. | Naito Y, Yasumuro M, Kondou K, Ohara N. Antiinflammatory effect of topically applied propolis extract in carrageenan-induced rat hind paw edema. Phytother Res. 2007;21:452-456. [PubMed] [DOI] |
| 11. | Paulino N, Dantas AP, Bankova V, Longhi DT, Scremin A, de Castro SL, Calixto JB. Bulgarian propolis induces analgesic and anti-inflammatory effects in mice and inhibits in vitro contraction of airway smooth muscle. J Pharmacol Sci. 2003;93:307-313. [PubMed] [DOI] |
| 13. | Mishima S, Narita Y, Chikamatsu S, Inoh Y, Ohta S, Yoshida C, Araki Y, Akao Y, Suzuki KM, Nozawa Y. Effects of propolis on cell growth and gene expression in HL-60 cells. J Ethnopharmacol. 2005;99:5-11. [PubMed] [DOI] |
| 14. | Orsolić N, Terzić S, Mihaljević Z, Sver L, Basić I. Effects of local administration of propolis and its polyphenolic compounds on tumor formation and growth. Biol Pharm Bull. 2005;28:1928-1933. [PubMed] [DOI] |
| 15. | Akao Y, Maruyama H, Matsumoto K, Ohguchi K, Nishizawa K, Sakamoto T, Araki Y, Mishima S, Nozawa Y. Cell growth inhibitory effect of cinnamic acid derivatives from propolis on human tumor cell lines. Biol Pharm Bull. 2003;26:1057-1059. [PubMed] [DOI] |
| 16. | Gabrys J, Konecki J, Krol W, Scheller S, Shani J. Free amino acids in bee hive product (propolis) as identified and quantified by gas-liquid chromatography. Pharmacol Res Commun. 1986;18:513-518. [PubMed] [DOI] |
| 18. | Li F, Awale S, Tezuka Y, Kadota S. Cytotoxic constituents from Brazilian red propolis and their structure-activity relationship. Bioorg Med Chem. 2008;16:5434-5440. [PubMed] [DOI] |
| 19. | Jasprica I, Mornar A, Debeljak Z, Smolcić-Bubalo A, Medić-Sarić M, Mayer L, Romić Z, Bućan K, Balog T, Sobocanec S. In vivo study of propolis supplementation effects on antioxidative status and red blood cells. J Ethnopharmacol. 2007;110:548-554. [PubMed] [DOI] |
| 21. | Grunberger D, Banerjee R, Eisinger K, Oltz EM, Efros L, Caldwell M, Estevez V, Nakanishi K. Preferential cytotoxicity on tumor cells by caffeic acid phenethyl ester isolated from propolis. Experientia. 1988;44:230-232. [PubMed] [DOI] |
| 22. | Chen YJ, Shiao MS, Hsu ML, Tsai TH, Wang SY. Effect of caffeic acid phenethyl ester, an antioxidant from propolis, on inducing apoptosis in human leukemic HL-60 cells. J Agric Food Chem. 2001;49:5615-5619. [PubMed] [DOI] |
| 23. | Wang D, Xiang DB, He YJ, Li ZP, Wu XH, Mou JH, Xiao HL, Zhang QH. Effect of caffeic acid phenethyl ester on proliferation and apoptosis of colorectal cancer cells in vitro. World J Gastroenterol. 2005;11:4008-4012. [PubMed] |
| 24. | Watabe M, Hishikawa K, Takayanagi A, Shimizu N, Nakaki T. Caffeic acid phenethyl ester induces apoptosis by inhibition of NFkappaB and activation of Fas in human breast cancer MCF-7 cells. J Biol Chem. 2004;279:6017-6026. [PubMed] [DOI] |
| 25. | Hung MW, Shiao MS, Tsai LC, Chang GG, Chang TC. Apoptotic effect of caffeic acid phenethyl ester and its ester and amide analogues in human cervical cancer ME180 cells. Anticancer Res. 2003;23:4773-4780. [PubMed] |
| 28. | Awale S, Li F, Onozuka H, Esumi H, Tezuka Y, Kadota S. Constituents of Brazilian red propolis and their preferential cytotoxic activity against human pancreatic PANC-1 cancer cell line in nutrient-deprived condition. Bioorg Med Chem. 2008;16:181-189. [PubMed] [DOI] |