修回日期: 2011-04-15
接受日期: 2011-04-21
在线出版日期: 2011-05-08
目的: 探讨β-榄香烯对人胃癌细胞SGC7901/Adr细胞外信号调节激酶(ERK)通路的活化和谷胱甘肽转移酶π(GST-π)表达的影响.
方法: MTT法检测细胞的药物敏感性, Western blot检测蛋白表达, 应用SPSS13.0进行统计学分析.
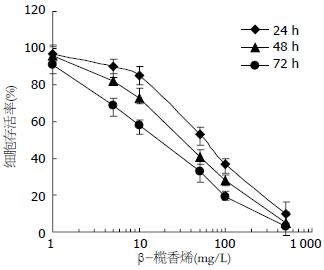
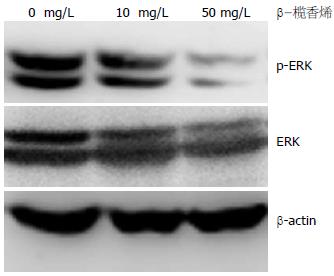
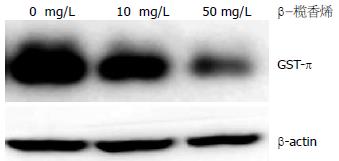
结果: β-榄香烯以时间依赖的方式抑制SGC 7901/Adr细胞增殖, 24、48和72 h的IC50浓度分别为53.48、28.78和14.78 mg/L. 对照组即有ERK的磷酸化, 50 mg/L的β-榄香烯处理SGC7901/Adr细胞24 h, 明显下调了ERK的磷酸化水平, 同时GST-π蛋白的表达显著下调.
结论: β-榄香烯通过抑制胃癌细胞SGC7901/Adr中ERK信号转导通路的活化, 进而下调了GST-π蛋白的表达.
引文著录: 张晔, 曲秀娟, 刘云鹏, 侯科佐, 刘静. β-榄香烯对人胃癌SGC7901/Adr细胞ERK通路的活化和GST-π表达的影响. 世界华人消化杂志 2011; 19(13): 1394-1397
Revised: April 15, 2011
Accepted: April 21, 2011
Published online: May 8, 2011
AIM: To investigate the effect of treatment with β-elemene on the activation of extracellular signal-regulated kinase (ERK) and expression of glutathione transferase-π (GST-π) in human gastric cancer cell line SGC7901/Adr.
METHODS: After SGC7901/Adr cells were treated with different concentrations of β-elemene for different durations, cell proliferation was measured by MTT assay, and protein expression was detected by Western blot. All experimental data were analyzed with the SPSS 13.0 software package.
RESULTS: β-elemene inhibited the proliferation of SGC7901/Adr cells in a time-dependent manner. The half maximal inhibitory concentrations of β-elemene at 24, 48, and 72 h in SGC7901/Adr cells were 53.48, 28.78 and 14.78 mg/L, respectively. In untreated control cells, ERK was basically phosphorylated. Treatment with β-elemene (50 mg/L) for 24 h significantly decreased the expression of phosphorylated ERK and GST-π in SGC7901/Adr cells.
CONCLUSION: β-elemene could inhibit the activation of the ERK signaling pathway and thereby down-regulate the expression of GST-π in SGC7901/Adr cells.
- Citation: Zhang Y, Qu XJ, Liu YP, Hou KZ, Liu J. Treatment with β-elemene inhibits ERK activation and down-regulates GST-π expression in human gastric cancer cell line SGC7901/Adr. Shijie Huaren Xiaohua Zazhi 2011; 19(13): 1394-1397
- URL: https://www.wjgnet.com/1009-3079/full/v19/i13/1394.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i13.1394
胃癌是一种严重威胁人类健康的恶性肿瘤, 其发病率和死亡率居我国消化系恶性肿瘤之首[1]. 多数患者在诊断时已经是晚期, 5年生存率只有10%左右. 尽管化疗药物的应用使晚期患者的生存期有所提高, 但中位总生存时间仍然不超过1年[2]. 榄香烯是从中药莪术中提取的抗癌药物, β-榄香烯是其主要活性成分, 属非细胞毒性药物. 目前研究表明β-榄香烯能够诱导细胞凋亡和分化[3]、逆转肿瘤多药耐药[4,5]、抗肿瘤转移和血管生成[6]、与放化疗联合增敏[7,8], 同时不良反应小, 因此应用前景较好. 本实验旨在探讨β-榄香烯对人胃癌SGC7901/Adr细胞细胞外信号调节激酶(extracellular signal-regulated kinase, ERK)通路的活化和谷胱甘肽转移酶π(glutathione transferase-π, GST-π)表达的影响.
β-榄香烯(β-elemene)购于大连金港制药有限公司, RPMI 1640培养基购自Gibco公司, 胎牛血清购自天津血液病研究所. 鼠抗人GST-π和兔抗人β-Actin抗体购自Santa Cruz公司, 兔抗人磷酸化ERK(p-ERK)和ERK抗体购自Cell Signaling公司. 辣根过氧化物酶标记的二抗购自北京中杉金桥生物技术有限公司, ECL试剂盒购自PIERCE公司.
1.2.1 细胞培养: 胃癌耐药细胞SGC7901/Adr由中国人民解放军第四军医大学西京医院全军消化病研究所惠赠, 在含100 mL/L胎牛血清、12 kU/L庆大霉素、含1 mg/L阿霉素的RPMI 1640培养液中, 37 ℃、饱和湿度及50 mL/L CO2的孵育箱内传代培养, 2.5 g/L胰酶消化液消化传代, 2-3 d传代1次, 实验前2 wk将细胞置于无阿霉素的培养基中培养.
1.2.2 MTT法进行细胞活力检测: 取对数生长期细胞接种于96孔板, 培养12 h后分别加入不同浓度的β-榄香烯, 每组设3个复孔, 每孔终体积为200 mL. 培养24、48、72 h后每孔加入MTT溶液(5 g/L)25 μL, 继续孵育4 h后吸去上清, 每孔加入200 μL DMSO, 振荡摇匀. 用酶标仪于570 nm波长条件下测定吸光度值.
1.2.3 Western blot检测蛋白表达: 取对数生长期细胞接种于6孔板, 收集不同处理组作用24 h的SGC7901/Adr细胞, 将其裂解于200 μL含有蛋白酶抑制剂(100 mg/L PMSF, 2 mg/L Aprotitin)的裂解液中[1% Triton X-100, 50 mmol/L Tris-HCl(pH7.4), 150 mmol/L NaCl, 10 mmol/L EDTA, 100 mmol/L NaF, 1 mmol/L Na3VO4], 4 ℃裂解40 min, 15 000 r/min离心20 min, 取上清, Bardford法进行蛋白定量. 与3×样品缓冲液混合后, 煮沸5 min. 将样品在10%的SDS-聚丙烯凝胶中进行电泳3 h, 然后转印至硝酸纤维素膜上. 用5%脱脂牛奶封闭1 h后, 分别加入一抗, 4 ℃过夜. TTBS洗4次后加入辣根过氧化物酶标记二抗, 室温作用30 min, ECL法显色, GIS凝胶图像分析系统照相并分析处理.
统计学处理 所有数据均为3次独立实验结果, 以mean±SD表示. 采用SPSS13.0统计软件进行统计学分析. 两组之间比较采用t检验, P<0.05有统计学意义.
1-500 mg/L的β-榄香烯处理SGC7901/Adr细胞24、48、72 h, 结果显示β-榄香烯以时间依赖的方式抑制SGC7901/Adr细胞活力, IC50浓度分别为53.48、28.78、14.78 mg/L(图1).
用10 mg/L和50 mg/L的β-榄香烯处理SGC7901/Adr细胞24 h, 检测ERK的磷酸化状态. 结果显示, 对照组SGC7901/Adr细胞即有ERK的磷酸化, 50 mg/L的β-榄香烯处理SGC7901/Adr细胞24 h, 明显下调了ERK的磷酸化水平, 从而抑制了ERK信号转导通路(图2).
用10、50 mg/L的β-榄香烯处理SGC7901/Adr细胞24 h, 检测GST-π蛋白的表达. 结果显示, 10 mg/L的β-榄香烯处理组较对照组细胞相比, GST-π蛋白的表达显著下调; 50 mg/L的β-榄香烯处理组进一步下调了GST-π的表达(图3).
ERK是一类丝/苏氨酸蛋白激酶, 是传递丝裂原信号的信号转导蛋白, 正常定位在胞质, 当激活后转位到胞核, 调节转录因子活性, 控制着细胞增殖与分化、细胞形态维持、细胞凋亡和细胞的恶变等多种生物学反应[9-11]. 在许多人类肿瘤中(如乳腺癌、黑色素瘤等)都可以发现ERK的过度激活, 目前, 很多学者正在寻找针对ERK途径中各个环节的抑制物以切断信号转导途径, 从而达到治疗肿瘤的目的, 一些实验结果显示这种治疗手段不良反应小而明显优于传统的化疗[12,13].
榄香烯是我国自行研发的抗肿瘤新药, 其主要成分是β-榄香烯. 主要作用为: 抑制癌细胞DNA的合成; 增强T淋巴细胞亚群的功能; 对放化疗引起的白细胞下降有一定的保护作用; 放化疗协同作用; 缓解癌性疼痛; 改善微循环; 镇静作用等, 不良反应小, 适合临床应用. 本研究探讨了β-榄香烯对人胃癌SGC7901/Adr细胞ERK通路的活化影响. 首先检测了β-榄香烯对SGC7901/Adr细胞活力的影响: 1-500 mg/L的β-榄香烯处理SGC7901/Adr细胞24、48和72 h, 结果显示β-榄香烯以时间依赖的方式抑制SGC7901/Adr细胞活力, IC50浓度分别为53.48、28.78和14.78 mg/L. 进一步选用10 mg/L和50 mg/L的β-榄香烯处理SGC7901/Adr细胞24 h, 检测ERK的磷酸化状态. 结果显示, 对照组SGC7901/Adr细胞即有ERK的磷酸化, 50 mg/L的β-榄香烯处理SGC7901/Adr细胞24 h, 明显下调了ERK的磷酸化水平, 从而抑制了ERK信号转导通路.
GST-π是一种药物代谢酶, 通过催化还原型谷胱甘肽和多种亲电子化合物结合, 使其更具极性而加强药物的排出; 其次, GST-π可通过非酶结合的方式将细胞内的毒性化学药物排出, 从而达到解毒的目的. 有研究学者[14]提出在氧化应激条件下肿瘤细胞启动细胞保护机制, 通过ERK通路的活化使转录因子NF-E2相关因子2磷酸化, 导致其与胞质蛋白伴侣分子Keap1蛋白的解离, 进入细胞核内与Maf家族蛋白形成杂二聚体与抗氧化剂反应元件结合从而促进GST-π的基因转录. 此外, 研究发现大蒜提取物通过活化ERK通路, 增强AP-1与GST-π基因的结合, 诱导结肠癌细胞中GST-π蛋白的表达, 抑制ERK活性后, 下调了GST-π蛋白表达[15]. 我们以往的研究证实[16]: ERK抑制剂PD98059作用胃癌BGC-823细胞24 h, p-ERK蛋白表达明显下调, GST-π蛋白表达亦明显下调, 同时伴有对顺铂的药物敏感性增加. 因此我们用榄香烯处理SGC7901/Adr细胞24 h, 检测了GST-π蛋白的表达. 结果显示, 10 mg/L的β-榄香烯处理组较对照组细胞相比, GST-π蛋白的表达显著下调; 50 mg/L的β-榄香烯处理组进一步下调了GST-π的表达. 由此我们推测β-榄香烯通过抑制ERK信号通路的活化, 下调GST-π蛋白表达, 进而可能增强铂类药物对肿瘤细胞的杀伤作用.
中西医结合治疗是肿瘤治疗今后发展的方向, 如何提高敏感性和特异性是亟待解决的问题之一. 本研究为临床上联合β-榄香烯与铂类化疗药物治疗胃癌提供了分子理论基础.
感谢"CSCO-金港榄香烯肿瘤学研究生课题启动奖励基金"对本实验的大力资助.
研究表明β-榄香烯能够诱导细胞凋亡和分化、逆转肿瘤多药耐药、抗肿瘤转移和血管生成、与放化疗联合增敏, 同时不良反应小, 因此应用前景较好.
王小众, 教授, 福建医科大学附属协和医院消化内科
Tsai等研究发现大蒜提取物通过活化ERK通路, 增强AP-1与GST-π基因的结合, 诱导结肠癌细胞中GST-π蛋白的表达, 抑制ERK活性后, 下调GST-π蛋白表达.
本实验证实β-榄香烯通过抑制ERK信号通路的活化, 可下调GST-π蛋白表达, 进而可能增强铂类药物对胃癌细胞的杀伤作用.
中西医结合治疗是肿瘤治疗今后发展的方向, 如何提高敏感性和特异性是亟待解决的问题之一. 本研究为临床上联合β-榄香烯与铂类化疗药物治疗胃癌提供了分子理论基础.
本文对榄香烯的抑癌作用提供了一定分子基础, 但新颖性一般.
编辑: 曹丽鸥 电编:何基才
| 1. | Peng J, Wang Y. Epidemiology, pathology and clinical management of multiple gastric cancers: a mini-review. Surg Oncol. 2010;19:e110-e114. [PubMed] [DOI] |
| 2. | Fujii M, Kochi M, Takayama T. Recent advances in chemotherapy for advanced gastric cancer in Japan. Surg Today. 2010;40:295-300. [PubMed] [DOI] |
| 3. | Li QQ, Wang G, Zhang M, Cuff CF, Huang L, Reed E. beta-Elemene, a novel plant-derived antineoplastic agent, increases cisplatin chemosensitivity of lung tumor cells by triggering apoptosis. Oncol Rep. 2009;22:161-170. [PubMed] [DOI] |
| 4. | Li X, Wang G, Zhao J, Ding H, Cunningham C, Chen F, Flynn DC, Reed E, Li QQ. Antiproliferative effect of beta-elemene in chemoresistant ovarian carcinoma cells is mediated through arrest of the cell cycle at the G2-M phase. Cell Mol Life Sci. 2005;62:894-904. [PubMed] [DOI] |
| 5. | Li QQ, Wang G, Huang F, Banda M, Reed E. Antineoplastic effect of beta-elemene on prostate cancer cells and other types of solid tumour cells. J Pharm Pharmacol. 2010;62:1018-1027. [PubMed] [DOI] |
| 6. | Chen W, Lu Y, Wu J, Gao M, Wang A, Xu B. Beta-elemene inhibits melanoma growth and metastasis via suppressing vascular endothelial growth factor-mediated angiogenesis. Cancer Chemother Pharmacol. 2011;67:799-808. [PubMed] [DOI] |
| 7. | Zhao J, Li QQ, Zou B, Wang G, Li X, Kim JE, Cuff CF, Huang L, Reed E, Gardner K. In vitro combination characterization of the new anticancer plant drug beta-elemene with taxanes against human lung carcinoma. Int J Oncol. 2007;31:241-252. [PubMed] |
| 8. | Rui D, Xiaoyan C, Taixiang W, Guanjian L. Elemene for the treatment of lung cancer. Cochrane Database Syst Rev. 2007;CD006054. [PubMed] |
| 9. | Ramos JW. The regulation of extracellular signal-regulated kinase (ERK) in mammalian cells. Int J Biochem Cell Biol. 2008;40:2707-2719. [PubMed] [DOI] |
| 10. | Rasola A, Sciacovelli M, Chiara F, Pantic B, Brusilow WS, Bernardi P. Activation of mitochondrial ERK protects cancer cells from death through inhibition of the permeability transition. Proc Natl Acad Sci U S A. 2010;107:726-731. [PubMed] [DOI] |
| 11. | Kim WJ, Lee SJ, Choi YD, Moon SK. Decursin inhibits growth of human bladder and colon cancer cells via apoptosis, G1-phase cell cycle arrest and extracellular signal-regulated kinase activation. Int J Mol Med. 2010;25:635-641. [PubMed] |
| 12. | Sánchez A, Setién F, Martinez N, Oliva JL, Herranz M, Fraga MF, Alaminos M, Esteller M, Rojas JM. Epigenetic inactivation of the ERK inhibitor Spry2 in B-cell diffuse lymphomas. Oncogene. 2008;27:4969-4972. [PubMed] [DOI] |
| 13. | Marampon F, Gravina GL, Di Rocco A, Bonfili P, Di Staso M, Fardella C, Polidoro L, Ciccarelli C, Festuccia C, Popov VM. MEK/ERK inhibitor U0126 increases the radiosensitivity of rhabdomyosarcoma cells in vitro and in vivo by downregulating growth and DNA repair signals. Mol Cancer Ther. 2011;10:159-168. [PubMed] [DOI] |
| 14. | Kim SG, Lee SJ. PI3K, RSK, and mTOR signal networks for the GST gene regulation. Toxicol Sci. 2007;96:206-213. [PubMed] [DOI] |
| 15. | Tsai CW, Chen HW, Yang JJ, Sheen LY, Lii CK. Diallyl disulfide and diallyl trisulfide up-regulate the expression of the pi class of glutathione S-transferase via an AP-1-dependent pathway. J Agric Food Chem. 2007;55:1019-1026. [PubMed] [DOI] |