修回日期: 2011-04-11
接受日期: 2011-04-21
在线出版日期: 2011-04-28
目的: 探讨性别决定区Y框蛋白2(Sox2)和尾型同源盒转录因子2(Cdx2)在胃黏膜肠化生中的表达及意义.
方法: 免疫组织化学检测80例病理学诊断为胃炎、轻度胃黏膜肠化生(IM)、中度IM和重度IM的石蜡包埋胃黏膜标本中Sox2和Cdx2蛋白的表达; 荧光定量PCR检测40例病理学诊断为胃炎、轻度IM和中重度IM组的胃镜活检标本中Sox2和Cdx2 mRNA表达.
结果: Sox2和Cdx2蛋白分别定位于正常胃和肠上皮细胞胞核. 胃炎、轻度IM组中Sox2蛋白阳性率显著高于Cdx2(94.4% vs 5.6%; 75.0% vs 50.0%, 均P<0.05), 而中度IM组和重度IM组中Sox2蛋白阳性率显著低于Cdx2(23.5% vs 85.7%; 9.5% vs 90.5%, 均P<0.05). 胃炎组、轻度IM组Sox2 mRNA水平显著高于Cdx2(0.5778±0.0778 vs 0.0517±0.0218; 0.1496±0.0384 vs 0.1402±0.0300, 均P<0.05), 中重度IM组Sox2 mRNA水平显著低于Cdx2(0.1131±0.0384 vs 0.3453±0.0537, P<0.05). 随着IM进展, 有Sox2 mRNA逐渐减少, 而Cdx2逐渐被上调, 二者呈负相关(r<0).
结论: 随着IM的进展, 有Sox2的表达下调和Cdx2的异位表达.
引文著录: 牛海静, 陈鑫, 王邦茂. Sox2和Cdx2在胃黏膜肠化生中的表达及意义. 世界华人消化杂志 2011; 19(12): 1295-1299
Revised: April 11, 2011
Accepted: April 21, 2011
Published online: April 28, 2011
AIM: To investigate the significance of expression of sex determining region Y-box 2 (Sox2) and caudal type homeobox transcription factor 2 (Cdx2) in gastric intestinal metaplasia (IM).
METHODS: The expression of SOX2 and CDX2 proteins in 80 paraffin-embedded specimens of gastritis and mild/moderate/severe IM was detected by immunohistochemistry. The mRNA levels of Sox2 and Cdx2 in 40 endoscopic biopsy specimens of gastritis and mild/moderate/severe IM were quantified by real-time Q-PCR.
RESULTS: Both SOX2 and CDX2 proteins were located in the nuclei of normal gastric and normal intestinal epithelial cells. The positive rates of SOX2 and CDX2 protein expression in gastritis and mild/moderate/severe IM were 94.4% and 5.6%, 75.0% and 50.0%, 23.5% and 85.7%, and 9.5% and 90.5%, respectively (all P < 0.05). The relative expression levels of Sox2 and Cdx2 mRNAs in gastritis and mild/moderate/severe IM were 0.5778 ± 0.0778 and 0.0517 ± 0.0218, 0.1496 ± 0.0384 and 0.1402 ± 0.0300, and 0.1131 ± 0.0384 and 0.3453 ± 0.0537, respectively (all P < 0.05). The levels of Sox2 transcripts decreased but those of Cdx2 transcripts increased with the progression of IM. There is an inverse correlation between the expression levels of Sox2 and Cdx2 (r < 0).
CONCLUSION: Down-regulation of Sox2 and ectopic expression of Cdx2 were found in the progression of gastric IM.
- Citation: Niu HJ, Chen X, Wang BM. Significance of expression of Sox2 and Cdx2 in gastric intestinal metaplasia. Shijie Huaren Xiaohua Zazhi 2011; 19(12): 1295-1299
- URL: https://www.wjgnet.com/1009-3079/full/v19/i12/1295.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i12.1295
胃黏膜肠化生(intestinal metaplasia, IM)是胃上皮细胞转分化为肠表型, 伴随着肠特异性基因(如Muc2, 蔗糖酶/异麦芽糖酶和肠碳酸苷酶Ⅰ等)的表达. 胃黏膜IM被认为是肠型胃癌的一种癌前病变[1]. 随着胚胎发育学的发展, 人们发现在消化道上皮发育过程中很重要的一些转录因子可能参与了胃黏膜IM的发生[2]. 尾型同源盒转录因子2(caudal type homeobox transcription factor 2, Cdx2)仅在成体肠道中表达而在胃中不表达, 是肠特异性转录因子, 负责调控下消化道上皮细胞的发育[3]. 性别决定区Y框蛋白2(sex determining region Y-box 2, Sox2)是含有Sry样HMG盒的进化保守的转录因子家族的一个成员, 成人Sox2主要表达在正常食管和胃上皮中以维持胃和食管正常上皮表型, 而在肠道中不表达[4]. 为研究Cdx2和Sox2在胃黏膜IM中的表达情况及意义, 我们从蛋白和mRNA水平检测了不同程度胃黏膜IM中Cdx2和Sox2在胃黏膜IM中的表达, 以探讨Cdx2和Sox2在胃黏膜IM发生中可能起到的作用.
免疫组织化学所使用的胃黏膜IM标本为2007-2008年天津医科大学总医院消化内镜中心胃镜活检标本于病理科存档蜡块. 所选标本临床资料较为完备, 患者平均年龄58(50-65)岁, 男女比例为1:1.5. 其HE染色切片经一个独立病理医师镜下诊断, 分为胃炎组18例、轻度IM组20例、中度IM组21例、重度IM组21例(杯状细胞所占百分比<30%为轻度IM、30%-60%为中度IM、>60%为中度IM). 荧光定量PCR所使用胃黏膜IM标本为天津医科大学总医院消化内镜中心胃镜活检新鲜标本, 经同一病理医师对HE切片重新评价后分为胃炎组12例、轻度IM组16例、中重度IM组12例. 所选标本患者平均年龄56岁(45-65岁), 男女比例为1:1.5. 主要试剂: 鼠抗人Cdx2单克隆抗体购自北京中山生物技术有限公司, 兔抗人Sox2多克隆抗体购自北京博奥森生物公司, 免疫组织化学相关试剂购自北京中山生物技术有限公司. SYBR® Green Master Mix(日本Toyobo), M-MLV逆转录酶及TRIzol(美国Invitrogen), Taq DNA聚合酶(美国NEB), DEPC(上海生工), DNaseⅠ(美国Sigma), 氯仿、异丙醇等荧光定量PCR相关试剂均为国产分析纯产品.
1.2.1 免疫组织化学: 石蜡切片常规二甲苯脱蜡, 梯度乙醇脱苯, 微波修复, 3% H2O2溶液室温孵育, 分别滴加Sox2抗体(1:300)或Cdx2抗体(工作液), 滴加辣根酶标记的通用型二抗, 滴加DAB显色, 显微镜下适时终止反应, 苏木素返蓝, 脱水, 透明, 干燥中性树脂封片. Sox2和Cdx2染色以胞核呈现棕黄色为阳性标准, 着色明显高于背景或背景不着色而细胞着色为阳性细胞. 每张切片随机选择5个高倍视野(×400), 根据阳性细胞百分数的多少进行分级, 阳性细胞百分比>10%为阳性.
1.2.2 荧光定量PCR: 新鲜标本TRIzol法提取总RNA, 1%甲醛变性琼脂糖凝胶电泳鉴定总RNA完整性, 逆转录合成cDNA第一链, Sox2和Cdx2 mRNA的相对定量检测, 其中Sox2、Cdx2和GAPDH的引物由北京奥科生物技术公司负责合成. Sox2: 5'-CCCACCTACAGCATGTCCTAC-3'; 5'-GGAGTGGGAGGAAGAGGTAAC-3', 扩增片段长度: 122 bp. Cdx2: 5'-GAACCTGTGCGAGTGGATG-3'; 5'-CGGATGGTGATGTAGCGAC-3', 扩增片段长度: 152 bp. GAPDH: 5'-GTCGGAGTCAACGGATTTG-3'; 5'-CCATGGGTGGAATCATATTG-3', 扩增片段长度: 146 bp. 实时荧光定量PCR通过实时监测PCR产物的动态累积量, 得到各管样品的扩增曲线, 从而测得各管样品待测序列的Ct值, 待测样品目的基因相对表达量为2-ΔCt.
统计学处理 使用SPSS11.5统计软件进行数据处理. 免疫组织化学各组之间蛋白表达阳性率比较采用χ2检验和Fisher确切概率法. 荧光定量PCR各组之间Sox2和Cdx2 mRNA相对表达量使用方差分析, Pearson参数相关分析检验各组Sox2和Cdx2 mRNA表达的相关性. P<0.05认为有统计意义.
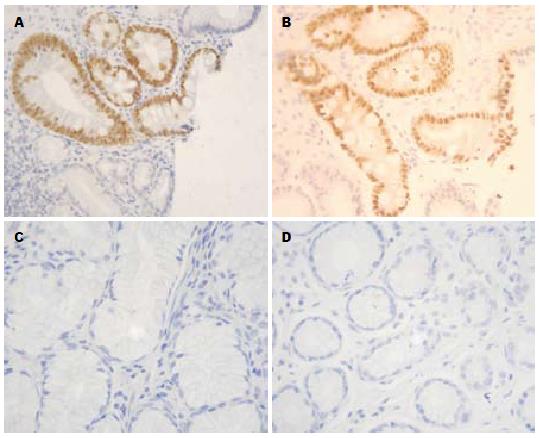
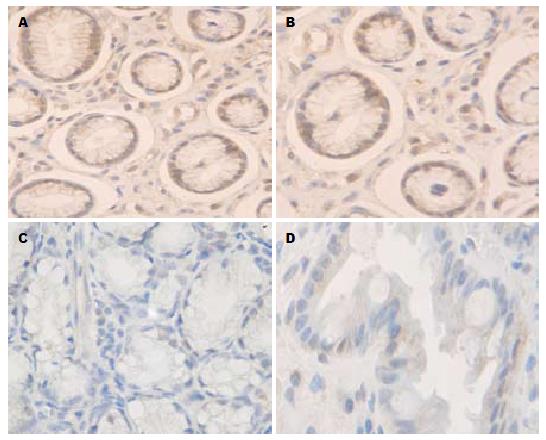
CDX2蛋白定位于轻、中、重度IM组杯状细胞和柱状上皮细胞的胞核, 呈棕黄色染色(图1A, B), 表达阳性率分别为50.0%、85.7%和90.5%, 正常胃上皮细胞基本无表达(图1C, D), 阳性率为5.6%, 各组之间表达有显著性差异(χ2 = 36.978, P<0.001, 表1). SOX2蛋白定位于正常胃黏膜上皮胞核, 近核周的胞质区也有少量棕黄色着色(图2A, B), 表达阳性率为94.4%. 轻、中、重度IM中Sox2表达阳性率分别为75.0%、23.5%和9.5%, 表达逐渐减弱(图2C, D), 各组之间表达有显著性差异(χ2 = 40.934, P<0.001, 表2).
| 分组 | n | Cdx2 | 阳性率(%) | χ2值 | P值 | |
| 阴性 | 阳性 | |||||
| 胃炎 | 18 | 17 | 1 | 5.6 | ||
| 轻度IM | 20 | 10 | 10 | 50.0 | 36.978 | <0.001 |
| 中度IM | 21 | 3 | 18 | 85.7 | ||
| 重度IM | 21 | 2 | 19 | 90.5 | ||
| 分组 | n | Sox2 | 阳性率(%) | χ2值 | P值 | |
| 阴性 | 阳性 | |||||
| 胃炎 | 18 | 1 | 17 | 94.4 | ||
| 轻度IM | 20 | 5 | 15 | 75.0 | 40.934 | <0.001 |
| 中度IM | 21 | 17 | 4 | 23.5 | ||
| 重度IM | 21 | 19 | 2 | 9.5 | ||
胃炎组Sox2 mRNA水平最高为0.5778±0.0778, 随着IM程度加重其表达逐渐减低, 各组之间差异有显著性(P<0.01); Cdx2在胃炎组中有微弱表达, 随着IM程度加重表达逐渐增高, 在中重度IM组中表达最高为0.3453±0.0537, 各组之间差异有显著性(P<0.01, 表3). 对各组Cdx2和Sox2 mRNA的相关性分析结果分别为胃炎组r = -0.799, P<0.01; 轻度IM组r = -0.825, P<0.01; 中重度IM组r = -0.714, P<0.01; 总体r = -0.822, P<0.01. 说明Cdx2和Sox2 mRNA在各组及总体中的表达均呈逆相关.
| 分组 | Sox2 | Cdx2 |
| 胃炎 | 0.5778±0.0778 | 0.0517±0.0218 |
| 轻度IM | 0.1496±0.0384 | 0.1402±0.0300 |
| 中重度IM | 0.1131±0.0384 | 0.3453±0.0537 |
流行病学研究证实, 胃黏膜IM具有高致癌风险[5]. 我国的一项包括3 000名患者的4-5年随访时间的队列研究中, 从IM进展为胃癌的OR值波动于17-29, 存在不典型增生个体的危险性尤其高. 日本利用胃癌风险指数评估胃癌前病变与胃癌的发生关系时得出结论, IM是肠型胃癌发生的重要条件, 从IM进展到肿瘤的相对危险性为6.4. 因此如果可以防治或逆转胃黏膜IM, 将可能降低肠型胃癌的发病率.
同源盒基因家族是消化道上皮发育相关的一些最重要的基因[6], 脊椎动物中这些发育转录因子也许在控制IM发生中起了一定作用. 尾同源盒基因Cdx2在肠上皮发育和肠表型分化和维持中起重要作用[7]. 为了分析胃向肠表型的转变, 人们还应该注意到胃转录因子如Sox基因家族[8]. 其家族成员的结构特点为均含有一个保守的、与HMG盒子DNA连接结构域同源的DNA序列特异的结构域[9]. 在胚胎发育中起了关键作用的Sox基因家族, 除了能维持胚胎干细胞多能性之外, 在IM的发展中也许也发挥了重要作用.
正常情况下Cdx2仅在人类十二指肠以下的肠道中表达, 而在胃及以上的上消化道上皮细胞中不表达[10]. 我们证明Cdx2在胃镜活检的胃炎标本中有微弱表达, 考虑原因可能有: (1)这些标本虽然还没有发生形态学可见的改变如杯状细胞的形成, 但已经有了肠化倾向. 而Cdx2作为转录因子应该在IM表型形成(即有杯状细胞出现)之前就表达. 另有研究表明GERD患者的食管炎性上皮中也可以检测到微弱的Cdx2表达[11], 与我们的推测相一致; (2)这些标本可能是H.pylori相关性胃炎组织. 有研究表明H.pylori相关性胃炎中可以出现Cdx2的表达[12]. 我们下一步应该确认是否我们实验中Cdx2阳性的标本中有H.pylori抗原的表达来验证这一观点. 流行病学证实H.pylori定位与胃黏膜IM的发生非常相关[13]. H.pylori诱导的炎症后发生的组织退化过程及H.pylori感染相关蛋白包括SHP2磷酸酶和IL-1β能影响细胞内信号级联反应[14]. 我们认为有可能H.pylori的某些毒力因素首先诱导了转录因子Cdx2的表达, 然后经过一段时间才会逐渐出现镜下可见的IM病灶. 我们还发现Cdx2随着IM程度加重表达逐渐增高, 可能与发生肠表型转化的细胞所占比率相关.
Sox2基因是胚胎干细胞标志物之一, 正常情况下表达在胚胎的全能干细胞和其他的早期多潜能细胞中, 是这些细胞功能维系所必需的, 如果表达缺失将在胚胎早期发生致命性的发育障碍[15]. 我们证明Sox2在胃炎组织中强表达, 随着胃黏膜IM程度加重表达逐渐减低. 因为Sox2是胃特异性转录因子, 控制着胃表型的形成, IM形成就是肠表型替代胃表型的过程, 故随着IM程度加重会有胃表型的减少和Sox2表达的减少.
我们证明SOX2蛋白定位于正常胃上皮细胞的胞核, 而CDX2蛋白定位于IM细胞的胞核, 这可以用二者都是转录因子, 其主要的功能发挥位点应该是在细胞核内来解释. SOX2和CDX2蛋白在胃黏膜IM组织中的表达似乎呈现一定规律, 因此我们接着测定了二者mRNA水平来验证.
我们从蛋白和mRNA表达方面研究了人类胃炎和轻、中、重度IM病变中Sox2和Cdx2的表达情况. Sox2与Cdx2的表达模式呈逆相关, 除了Cdx2在转录和翻译水平的异位表达之外, Sox2的下调可能会是胃黏膜IM表型转变的另外一个重要机制. 但仍需阐明胃黏膜IM中转录因子Sox2和Cdx2表达改变的原因是什么; 这种表达改变是独立调节, 还是协同调节. 逆转调节基因表达的改变, 很有可能有助于修复萎缩和化生黏膜, 作为未来一种新的治疗手段.
胃黏膜肠上皮化生是肠型胃癌发病机制Correa's级联反应的一个中间步骤, 一般被认为是一种癌前病变. 胃黏膜IM发生的机制还没有被详细阐明. 如果想要预防肿瘤从这种病变中发生, 就有必要研究控制这个过程的转录因子.
刘丽江, 教授, 江汉大学医学院病理学与病理生理学教研室
胃表型向肠表型的转变可能是胃黏膜IM形成的重要机制. 本实验选择了2个重要的消化系上皮转录因子Cdx2和Sox2, 从转录和翻译水平较为详尽地研究了二者在胃黏膜IM中的表达改变.
本文研究发现胃黏膜IM中胃转录因子Sox2表达下调而肠转录因子Cdx2表达上调. 如能逆转这些调节基因表达的改变, 很有可能有助于修复萎缩和化生黏膜, 这可作为未来一种新的治疗手段.
本文科学性较好, 具有一定的研究价值和科学意义.
编辑: 曹丽鸥 电编:何基才
| 1. | Giraud AS. Metaplasia as a premalignant pathology in the stomach. Gastroenterology. 2007;132:2053-2056. [PubMed] [DOI] |
| 2. | Tsukamoto T, Mizoshita T, Tatematsu M. Gastric-and-intestinal mixed-type intestinal metaplasia: aberrant expression of transcription factors and stem cell intestinalization. Gastric Cancer. 2006;9:156-166. [PubMed] [DOI] |
| 3. | Colleypriest BJ, Farrant JM, Slack JM, Tosh D. The role of Cdx2 in Barrett's metaplasia. Biochem Soc Trans. 2010;38:364-369. [PubMed] [DOI] |
| 4. | Tani Y, Akiyama Y, Fukamachi H, Yanagihara K, Yuasa Y. Transcription factor SOX2 up-regulates stomach-specific pepsinogen A gene expression. J Cancer Res Clin Oncol. 2007;133:263-269. [PubMed] [DOI] |
| 6. | Richmond CA, Breault DT. Regulation of gene expression in the intestinal epithelium. Prog Mol Biol Transl Sci. 2010;96:207-229. [PubMed] [DOI] |
| 7. | Stringer EJ, Pritchard CA, Beck F. Cdx2 initiates histodifferentiation of the midgut endoderm. FEBS Lett. 2008;582:2555-2560. [PubMed] [DOI] |
| 8. | Bowles J, Schepers G, Koopman P. Phylogeny of the SOX family of developmental transcription factors based on sequence and structural indicators. Dev Biol. 2000;227:239-255. [PubMed] [DOI] |
| 9. | Gracz AD, Magness ST. Sry-box (Sox) transcription factors in gastrointestinal physiology and disease. Am J Physiol Gastrointest Liver Physiol. 2011;300:G503-G515. [PubMed] [DOI] |
| 10. | Barros R, Camilo V, Pereira B, Freund JN, David L, Almeida R. Pathophysiology of intestinal metaplasia of the stomach: emphasis on CDX2 regulation. Biochem Soc Trans. 2010;38:358-363. [PubMed] [DOI] |
| 11. | Souza RF, Krishnan K, Spechler SJ. Acid, bile, and CDX: the ABCs of making Barrett's metaplasia. Am J Physiol Gastrointest Liver Physiol. 2008;295:G211-G218. [PubMed] [DOI] |
| 12. | Shiotani A, Iishi H, Uedo N, Ishihara R, Ishiguro S, Tatsuta M, Nakae Y, Kumamoto M, Hinoi T, Merchant JL. Helicobacter pylori-induced atrophic gastritis progressing to gastric cancer exhibits sonic hedgehog loss and aberrant CDX2 expression. Aliment Pharmacol Ther. 2006;24 Suppl 4:71-80. [PubMed] [DOI] |
| 13. | Kosunen TU, Pukkala E, Sarna S, Seppälä K, Aromaa A, Knekt P, Rautelin H. Gastric cancers in Finnish patients after cure of Helicobacter pylori infection: A cohort study. Int J Cancer. 2011;128:433-439. [PubMed] [DOI] |
| 14. | Katoh M. Dysregulation of stem cell signaling network due to germline mutation, SNP, Helicobacter pylori infection, epigenetic change and genetic alteration in gastric cancer. Cancer Biol Ther. 2007;6:832-839. [PubMed] [DOI] |