修回日期: 2011-03-01
接受日期: 2011-03-08
在线出版日期: 2011-04-28
目的: 探讨复方青黛颗粒治疗溃疡性结肠炎(UC)大鼠的相关机制.
方法: 用三硝基苯磺酸(TNBS)法制备大鼠UC模型, 分为空白对照组、模型对照组、柳氮磺吡啶(SASP)组、复方青黛颗粒低、中、高剂量组. 造模后第3天开始灌胃给药, 共给药10 d, 实验第14天, 处死大鼠. 取大鼠结肠组织及血清, 用免疫组织化学SP法检测NF-κB P65蛋白表达, ELISA测定血清中肿瘤坏死因子α(TNF-α)的含量.
结果: 空白对照组与模型对照组比较, 结肠组织中NF-κB P65蛋白表达及血清中TNF-α表达明显增高(0.276±0.0081 vs 0.138±0.003; 67.657±3.580 vs 18.990±3.964, 均P<0.05), 复方青黛颗粒高剂量组与模型对照组相比, 结肠组织中NF-κB P65蛋白表达及血清中TNF-α表达显著降低(0.217±0.007 vs 0.276±0.008; 27.783±2.867 vs 67.657±3.580, 均P<0.05).
结论: 复方青黛颗粒对TNBS诱导的UC大鼠的治疗作用可能与通过NF-κB信号传导通路, 调节TNF-α含量有关.
引文著录: 杜立阳, 陈铭诗, 刘清芳, 程晓磊, 李鲜明. 复方青黛颗粒对溃疡性结肠炎大鼠NF-κB P65、TNF-α表达的影响. 世界华人消化杂志 2011; 19(12): 1290-1294
Revised: March 1, 2011
Accepted: March 8, 2011
Published online: April 28, 2011
AIM: To determine the mechanism underlying the therapeutic effects of Compound Indigo Granules (CIG) against ulcerative colitis by investigating the effect of treatment with CIG on the expression of nuclear factor-κB P65 (NF-κB P65) and tumor necrosis factor (TNF)-α in the colon of rats with experimental ulcerative colitis.
METHODS: Ulcerative colitis was induced in rats with trinitrobenzenesulfonic acid (TNBS). Rats were divided into control group, model group, salazosulfapyridine (SASP) group, low-, medium-, and high-dose CIG groups. Except the control group, the other groups were intragastrically given normal saline, SASP, and different doses of CIG from day 3 after model induction for 10 days, respectively. On day 14, all rats were killed to take colon and serum samples for measuring colonic NF-κB P65 expression by immunohistochemisty and serum TNF-α levels by enzyme-linked immunosorbent assay (ELISA).
RESULTS: The levels of NF-κB P65 protein expression in the colon and serum TNF-α were significantly higher in the model group than in the control group (0.138 ± 0.003 vs 0.276 ± 0.0081; 18.990 ± 3.964 vs 67.657 ± 3.580, both P < 0.05) but were significantly lower in the high-dose CIG group than in the model group (0.217 ± 0.007 vs 0.276 ± 0.008; 27.783 ± 2.867 vs 67.657 ± 3.580, both P < 0.05).
CONCLUSION: Treatment with CIG significantly decreased the levels of NF-κB P65 protein expression in the colon and serum TNF-α in rats with ulcerative colitis. CIG exerts therapeutic effects against ulcerative colitis possibly via mechanisms associated with the NF-κB signaling pathway and down-regulation of TNF-α.
- Citation: Du LY, Chen MS, Liu QF, Cheng XL, Li XM. Treatment with Compound Indigo Granules down-regulates NF-κB P65 and TNF-α expression in ulcerative colitis in rats. Shijie Huaren Xiaohua Zazhi 2011; 19(12): 1290-1294
- URL: https://www.wjgnet.com/1009-3079/full/v19/i12/1290.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i12.1290
溃疡性结肠炎(ulcerative colitis, UC)的病因及发病机制目前尚不清楚, 免疫系统异常是造成炎症和组织损伤的内在因素, 并与遗传、环境、微生物等因素密切相关. UC的治疗目前仍以氨基水杨酸类和糖皮质激素为主. 复方青黛颗粒是中国医科大学附属第一医院中医科用于治疗UC的协定处方, 经30多年临床应用疗效显著. 研究表明促炎症反应细胞因子及其他炎症介质包括TNF-α和细胞间黏附分子1(intercellular adhesion molecule-1, ICAM-1)在炎症反应过程中起重要作用, 他们在肠黏膜中含量增加是UC发病的重要因素, 同时NF-κB信号传导通路激活是慢性炎症性肠病(inflammatory bowel disease, IBD)的发病机制之一[1]. 在UC模型大鼠肠组织中NF-κB表达水平与TNF-α、ICAM-1阳性表达呈正相关[2]. 本实验通过复方青黛颗粒治疗TNBS诱导的UC大鼠模型, 检测结肠组织NF-κB P65蛋白的表达、血清中TNF-α含量, 进一步探讨复方青黛颗粒治疗UC的作用机制.
酶标定量测定仪、连续加样枪(日本Nichiryo公司). 复方青黛颗粒(NIGC, 中国医科大学), 柳氮磺吡啶(SASP, 批号040106, 上海三维制药有限公司), TNBS(批号: P2297, 美国Sigma 公司), 大鼠TNF-α ELISA试剂盒(96T , 批号: 300333, 美国ADL公司), NF-κB P65鼠多克隆抗体(Santa Cruz公司); SP试剂盒、DAB显色试剂盒: 均购自北京中杉生物公司.
1.2.1 TNBS法制备UC大鼠模型: TNBS法大鼠UC模型的制备方法参考文献[3-5]. SD大鼠, ♂, 体质量250 g±20 g, 52只, 随机分为6组, 空白对照组, 模型对照组, 柳氮磺吡啶(0.5 g/kg, SASP组), 复方青黛颗粒低(0.6 g/kg)、中(0.9 g/kg)、高(1.2 g/kg)剂量组. 灌胃药物剂量均按照大鼠与人之间药物剂量换算公式计算. 各组动物于造模前禁食24 h, 以0.9 g/kg乌拉坦腹腔注射麻醉, 固定于平板上, 平板下部垫高使动物尾部与头部呈40度. 将体积分数为5%的TNBS 水溶液与500 mL/L乙醇以体积比1:1混匀. 取一外径2.0 mm、长约12 cm的硅胶输液管(用石蜡油润滑), 插入大鼠肛门8 cm, 按剂量100 mg/kg缓慢灌注TNBS乙醇溶液, 1 min灌注完, 2 min后松开固定, 取其俯卧位自然苏醒. 造模结束后第2天随机处死大鼠4只, 剖腹摘取直肠和结肠, 清洗后肉眼观察结肠充血水肿情况, 并取8 cm肠段(甲醛固定)做病理检查及组织切片确定造模成功. 造模后第3天开始各组动物灌胃给药, 连续给药10 d. 空白对照组和模型对照组动物按10 mL/kg体质量胃内给予蒸馏水, 每日记录动物体质量、体征及粪便状况.
1.2.2 标本处理: 连续给药10 d后处死大鼠, 立即沿腹中线剪开腹腔, 腹主动脉取血, 2 500 r/min离心10 min分离血清, 置于-80 ℃冰箱保存以备检测血清TNF-α含量. 分离结肠, 沿肠系膜剪开肠腔取病变结肠, 冷生理盐水冲洗干净, 肉眼进行大体形态观察, 拍摄大病理数码相片. 取病变结肠组织1.0 cm×1.0 cm放入EP管中, 置于-80 ℃冰箱保存备用. 剩余部分用4%甲醛溶液固定, 石蜡包埋, 3 μm连续切片, HE染色, 镜下评价炎症和溃疡情况.
1.2.3 血清TNF-α含量测定: 根据TNF-α ELISA试剂盒方法检测血清样本, 后用酶标仪测定450 nm处吸光度值, 作标准曲线, 回归计算血清中TNF-α含量.
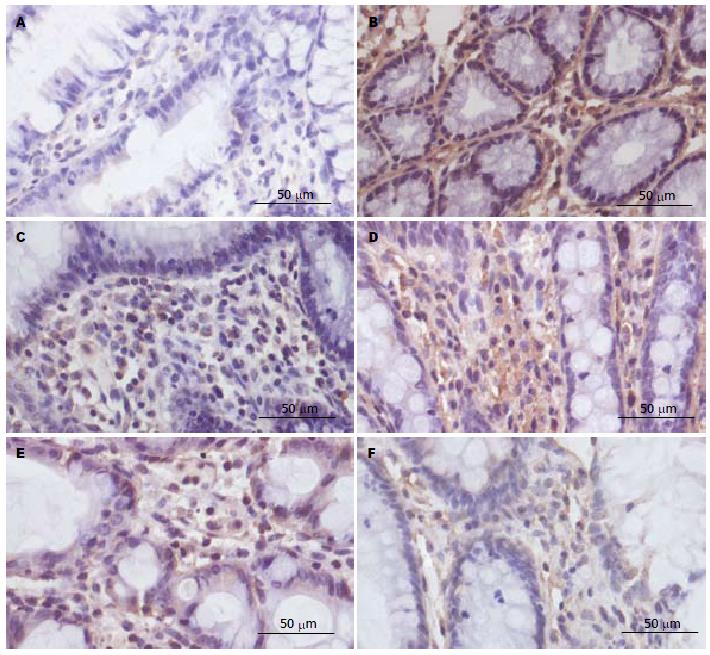
1.2.4 NF-κB P65蛋白表达测定: 根据免疫组织化学(SP)法, 对NF-κB P65进行蛋白表达测定. DAB显色后, 以细胞质出现棕黄色颗粒为阳性. 利用Image-pro plus 4.5显微图像分析系统对染色阳性物质进行吸光度测定. 以高倍镜(×400)在每张切片上随机选取5个视野, 测定阳性部位总吸光度值和总面积值, 计算二者比值即阳性表达部位的平均光密度值, 该值越大, 表明蛋白含量越高.
统计学处理 采用SPSS13.0随机单位组设计资料的方差分析S-N-K统计方法分析数据, 用mean±SD表示.
空白对照组、模型对照组、SASP组、复方青黛颗粒低、中、高剂量组大鼠血清中TNF-α含量分别为: 18.990±3.964、67.657±3.580、23.454±3.500、42.053±3.413、34.846±4.091、27.783±2.867. 模型对照组大鼠血清TNF-α的含量与正常对照组比较显著升高(P<0.05). 经过复方青黛颗粒治疗后, 高剂量组TNF-α的含量显著低于模型对照组, 具有统计学差异(P<0.05).
NF-κB P65各组肠组织黏膜层可见中性粒细胞、淋巴细胞、浆细胞及嗜酸性粒细胞浸润, 细胞质出现棕黄色颗粒为阳性(图1). 空白对照组、模型对照组、SASP组、复方青黛颗粒低、中、高剂量组大鼠结肠组织NF-κB P65蛋白定量分析分别为: 0.138±0.003、0.276±0.008、0.223±0.005、0.269±0.008、0.251±0.008、0.217±0.007. 模型对照组大鼠结肠组织NF-κB P65蛋白表达与正常对照组比较显著升高(P<0.05). 经复方青黛颗粒治疗后, 高剂量组大鼠结肠组织NF-κB P65蛋白表达减少, 与模型对照组相比较具有统计学差异(P<0.05).
UC属祖国医学"泄泻"、"久痢"、"休息痢"、"肠澼"、"肠风"等范畴. 现代医学认为: UC是一种主要分布于结肠和直肠黏膜或黏膜下层的、边界不清楚的炎性反应,属于IBD的一种. 临床表现为腹泻、黏液脓血便、腹痛. 病情轻重不等, 多呈反复发作的慢性病程. 可伴有多种肠外表现, 包括外周性关节炎、结节性红斑、坏疽性脓皮病、巩膜外层炎等. 本病可发生在任何年龄, 多见于20-40岁, 亦可见于儿童或老年.
复方青黛颗粒由青黛、黄柏、儿茶、枯矾、珍珠等组成. 组方中所含有效化学成分具有加强机体吞噬细胞的吞噬能力, 抗病原微生物, 抑制肠黏膜分泌, 抑制肠蠕动, 促进盲肠逆蠕动, 能和蛋白化合成难溶于水的蛋白化合物而形成沉淀, 用于局部出血, 促进创口愈合和抑制实验性溃疡的作用[6]. 前期研究结果表明, 复方青黛颗粒能显著减轻异种异体结肠致敏所致大鼠实验性UC模型的症状[7], 减少结肠组织中自由基的形成[8], 并有镇痛抗炎[9], 抑制肠蠕动的作用[10], 能下调CD54的过度表达和调节IL-1β、IL-4、MUC2、iNOS水平[11].
TNF-α主要由活化的单核巨噬细胞所产生, 是一种具有广泛生物活性的细胞因子, 可使白细胞在炎症局部聚集, 刺激单核细胞、血管内皮细胞等产生细胞因子, 并诱导细胞因子合成及发生级联反应, 最终导致组织的损伤, 在UC中被公认为是一种促炎细胞因子. 在UC活动期, TNF-α的水平在血浆及粪便中升高, 在肠道中能介导肠黏膜损伤作用[12]. 本实验中UC大鼠血清中存在TNF-α水平异常增高, 增高的TNF-α与炎症细胞相互作用, 加重局部肠黏膜的炎症损伤. 经过复方青黛颗粒治疗, 抑制TNF-α的活化, 减少TNF-α与炎症细胞相互作用, 减轻局部肠黏膜的炎症损伤, 从而促进肠黏膜修复与溃疡愈合.
NF-κB广泛存在于各种组织中, 正常情况下存在于细胞质内, 是一种具有多向转录调节作用的蛋白质, 参与许多炎症性疾病的发病机制. 哺乳动物的NF-κB家族包括5种成员: NF-κB1 (P105/P50)、NF-κB2(P100/P52、P65RelA)、C-rel和RelB. 研究显示: NF-κB可上调肠黏膜中致炎细胞因子IL-1、TNF-α的表达, 加重肠黏膜的炎症, 引起上皮细胞的凋亡, 且NF-κB活化后可以增强TNF-α和IL-1β的基因转录, 使TNF-α和IL-lβ产生和释放增多[13,14]. 在鼠UC实验中发现, 肠黏膜组织中活化的NF-κB及促炎因子TNF-α表达上调, 而NF-κB抑制物水平下降. 肠道炎性细胞核提取物中NF-κB P65水平明显升高[15]. 实验数据分析表明: UC模型大鼠结肠组织NF-κB P65的含量明显高于空白对照组大鼠的含量, 并且UC模型大鼠经复方青黛颗粒治疗后, 大鼠结肠组织NF-κB P65的含量显著降低, 由此可以得出复方青黛颗粒治疗UC可能通过NF-κB信号传导通路.
TNBS是一种半抗原物质, 与大分子组织蛋白结合后成为一种抗原物质, 引起机体免疫反应, 诱导肠炎发生. 该方法成熟, 易操作, 是较理想的造模途径[16]. 本实验通过TNBS制备UC大鼠模型, 经过复方青黛颗粒治疗, NF-κB P65及TNF-α的表达明显减少. 从而可以得出复方青黛颗粒在治疗UC中可能通过NF-κB信号传导通路, 抑制TNF-α的活化, 减少TNF-α与炎症细胞相互作用, 降低各种炎症细胞的渗出及炎症细胞因子的含量, 减轻局部肠黏膜的炎症损伤, 从而促进肠黏膜修复与溃疡愈合.
复方青黛颗粒是中国医科大学附属第一医院中医科用于治疗溃疡性结肠炎(UC)的协定处方, 经30多年临床应用疗效显著.
李晓波, 教授, 上海交通大学药学院
有研究显示, 作为可诱发的转录调节因子, NF-κB结合位点可接受免疫刺激,如TNF-α、 IL-1、LPS或T淋巴细胞激活.
本文通过研究TNBS诱导的溃疡性结肠炎大鼠结肠组织NF-κB P65及血清TNF-α表达, 来阐明复方青黛颗粒治疗溃疡性结肠炎的作用机制, 并进行药物治疗疗效比较.
复方青黛颗粒在治疗UC中, 可能与通过NF-κB信号传导通路, 抑制TNF-α的活化, 减少TNF-α与炎症细胞相互作用有关.
本文具有一定的理论价值和科学意义, 对于阐明UC发病机制和复方青黛颗粒的作用机制具有一定贡献.
编辑: 曹丽鸥 电编:李薇
| 1. | Li JH, Yu JP, Yu HG, Xu XM, Yu LL, Liu SQ. Expression and significance of nuclear factor kappaB p65 in colon tissues of rats with TNBS-induced colitis. World J Gastroenterol. 2005;11:1759-1763. [PubMed] |
| 3. | Morris GP, Beck PL, Herridge MS, Depew WT, Szewczuk MR, Wallace JL. Hapten-induced model of chronic inflammation and ulceration in the rat colon. Gastroenterology. 1989;96:795-803. [PubMed] |
| 4. | Shorter RG, Huizenga KA, Spencer RJ. A working hypothesis for the etiology and pathogenesis of nonspecific inflammatory bowel disease. Am J Dig Dis. 1972;17:1024-1032. [PubMed] [DOI] |
| 5. | te Velde AA, Verstege MI, Hommes DW. Critical appraisal of the current practice in murine TNBS-induced colitis. Inflamm Bowel Dis. 2006;12:995-999. [PubMed] [DOI] |
| 7. | 杜 立阳, 宗 士群, 刘 悦, 李 东安, 赵 金明, 张 艳玲. 复方青黛颗粒对大鼠溃疡性结肠炎模型的影响. 中国中西医结合消化杂志. 2002;10:135-137. |
| 10. | 杜 立阳, 宗 士群, 刘 悦, 刘 艳, 李 东安, 赵 金明, 张 艳玲. 青黛颗粒对小鼠小肠推进运动的影响. 中国中西医结合消化杂志. 2004;12:337-38. |
| 11. | 杜 立阳, 刘 清芳, 程 晓磊, 陈 铭诗, 李 鲜明, 仇 靖. 青黛颗粒对溃疡性结肠炎大鼠结肠黏膜MUC2和iNOS基因表达的影响. 世界华人消化杂志. 2010;18:937-941. [DOI] |
| 12. | 林 平, 伍 杨, 黄 华, 梅 林. 细胞因子与溃疡性结肠炎. 湖北民族学院学报(医学版). 2003;20:28-33. |
| 13. | Woodford-Richens K, Bevan S, Churchman M, Dowling B, Jones D, Norbury CG, Hodgson SV, Desai D, Neale K, Phillips RK. Analysis of genetic and phenotypic heterogeneity in juvenile polyposis. Gut. 2000;46:656-660. [PubMed] [DOI] |
| 15. | Howe JR, Shellnut J, Wagner B, Ringold JC, Sayed MG, Ahmed AF, Lynch PM, Amos CI, Sistonen P, Aaltonen LA. Common deletion of SMAD4 in juvenile polyposis is a mutational hotspot. Am J Hum Genet. 2002;70:1357-1362. [PubMed] [DOI] |