修回日期: 2011-03-24
接受日期: 2011-04-11
在线出版日期: 2011-04-28
目的: 评估结直肠癌患者抗肿瘤免疫状态.
方法: 应用流式细胞术检测100例未转移结直肠癌患者、100例伴有转移结直肠癌患者和100例健康志愿者外周血CD4+、CD8+、NK、B、CD4+CD25HighCD127low Treg、Th/Treg值, 采用单因素方差分析进行比较, 分析差异.
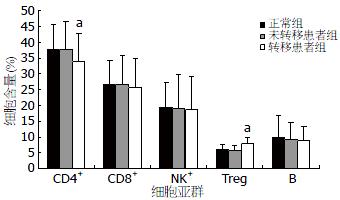
结果: 转移性结直肠癌患者组分别与正常对照组和非转移性结直肠癌患者组相比, CD4+CD25HighCD127low Treg细胞升高(7.72%±2.20% vs 6.08%±1.47%, 5.91%±1.55%, 均P<0.05), CD4+ T细胞降低(34.04%±8.71% vs 37.83%±7.62%, 37.68%±8.89%, 均P<0.05), Th/Treg值降低(4.70±1.72 vs 6.47±2.54, 6.81±4.09, 均P<0.05). 结直肠癌患者与正常对照组CD8+ T细胞、NK细胞、B细胞三组两两相比, 均无统计学意义.
结论: 转移性结直肠癌患者免疫功能紊乱, 主要表现为CD4+ T细胞、Th/Treg值降低, CD4+CD25HighCD127low Treg细胞升高.
引文著录: 李耀平, 宋东, 王艳峰, 田志华, 贾莉, 苏文. 细胞免疫参数对结直肠癌的评估价值. 世界华人消化杂志 2011; 19(12): 1263-1268
Revised: March 24, 2011
Accepted: April 11, 2011
Published online: April 28, 2011
AIM: To compare the proportions of CD4+, CD8+ T cells, NK cells, B cells, and CD4+CD25HighCD127low Treg cells and Th/Treg ratio in the peripheral blood of patients with colorectal cancer and healthy controls to investigate the immune status in patients with colorectal cancer.
METHODS: Flow cytometry was used to analyze the proportions of CD4+, CD8+ T cells, NK cells, B cells, and CD4+CD25HighCD127low Treg cells and Th/Treg ratio in the peripheral blood from 100 patients with non-metastatic colorectal cancer, 100 patients with metastatic colorectal cancer, and 100 healthy controls. One-way ANOVA was used to study the changes in the above immunity parameters.
RESULTS: The proportion of CD4+CD25HighCD127low Treg cells was significantly higher in patients with metastatic colorectal cancer than in health controls and patients with non-metastatic colorectal cancer (7.72% ± 2.20% vs 6.08% ± 1.47%, 5.91% ± 1.55%, both P < 0.05), while that of CD4+ T cells was statistically lower in patients with metastatic colorectal cancer than in the other two groups of subjects (34.04% ± 8.71% vs 37.83% ± 7.62%, 37.68% ± 8.89%, both P < 0.05). The Th/Treg ratio was also significantly lower in patients with metastatic colorectal cancer than in health controls and patients with non-metastatic colorectal cancer (4.70 ± 1.72 vs 6.47 ± 2.54, 6.81 ± 4.09, both P < 0.05). There were no statistical differences in the proportions of CD8+ T cells, NK cells and B cells between patients with colorectal cancer and healthy controls.
CONCLUSION: Abnormal immune status was observed in patients with metastatic colorectal cancer.
- Citation: Li YP, Song D, Wang YF, Tian ZH, Jia L, Su W. Multiparameter analysis of cellular immunity in patients with colorectal cancer. Shijie Huaren Xiaohua Zazhi 2011; 19(12): 1263-1268
- URL: https://www.wjgnet.com/1009-3079/full/v19/i12/1263.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i12.1263
结直肠癌(colorectal cancer, CRC)是消化系统常见的恶性肿瘤, 据国际癌症研究机构IARC 2009年的一项统计数据研究资料显示全球范围内每年约有超过100万的新发病例, 5年生存率在50%左右[1-3], 在我国每年新发病例高达15万. 目前, 对CRC的治疗仍是以手术为主、辅以局部或全身放疗及化疗, 有提高疗效的作用, 特别是近年新辅助放化疗在临床上的应用能使CRC体积缩小, 提高手术切除率和降低局部复发率, 因此, 进一步研究CRC术后新的辅助治疗十分重要, 而免疫治疗就是一种行之有效的辅助治疗方法, 肿瘤患者免疫状态评估对于选择合理的治疗方式、判断预后有着重要的临床意义, 但目前缺乏理想的免疫评价参数使其无法在临床常规开展. 本文通过分析CRC患者外周血CD4+、CD8+、NK、B、Treg、Th/Treg的变化, 探讨这几种免疫参数评估患者免疫状态的价值.
本研究实验组外周血标本200例均为2009-07/2009-12山西省肿瘤医院住院CRC患者, 所有病例经组织病理学鉴定为腺癌, 男118例, 女82例, 年龄(58.3±13.9)岁, 其中伴有局部肠系膜淋巴结转移和远处转移100例, 无转移100例. 患者均未行化疗和放射治疗, 无免疫相关性疾病和其他肿瘤, 无使用激素类药物及免疫抑制剂史. 100例正常组为同期山西省肿瘤医院经体格检查, 且生化及免疫指标均正常的健康体检者, 其中男44例, 女66例, 年龄(56.0±9.8)岁. 流式细胞仪; 鼠抗人抗体: CD3 PerCP-Cy5.5、CD3 FITC、CD4 FITC、CD8 PE、CD19 PE、CD16+56 PE、CD25 APC、CD127 PE; 同型对照为鼠抗人IgG1 PerCP-Cy5.5、IgG1 FITC、IgG1 PE、IgG1 APC; 红细胞裂解液; 流式上样管. 以上仪器和试剂均购自美国BD公司.
1.2.1 标本采集: 患者与健康体检者签署知情同意书, 所有标本均在清晨受检者空腹下, 用一次性真空管采集静脉血2 mL, EDTA抗凝, 在标本采集后室温(15 ℃-25 ℃)保存, 6 h内处理.
1.2.2 检测: 取待检静脉全血100 μL, 加入上样管中, 采用双色和三色标记法根据检测项目的不同分别加入以下抗体组合: CD3 PerCP-Cy5.5、CD4 FITC; CD3 PerCP-Cy5.5、CD8 PE; CD3 FITC、CD16+56 PE; CD4 FITC、CD25 APC、CD127 PE; CD3 FITC、CD19 PE, 震荡混匀, 常温孵育20 min, 加红细胞裂解液850 μL裂解10 min, 1 500 r/min离心7 min, PBS冲洗1次, 加200 μL PBS悬浮细胞, 上机检测, 采用FACSDiva软件对数据结果进行分析.
统计学处理 采用SPSS18.0软件包进行统计分析, 所有正态分布数据均以mean±SD, 组间比较单因素方差分析(One-way ANOVA)比较, P<0.05认为差异有统计学意义.
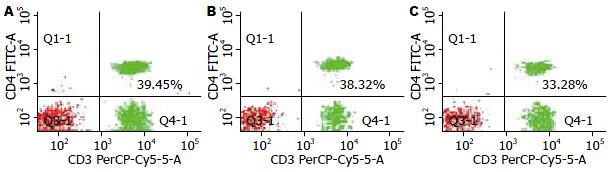
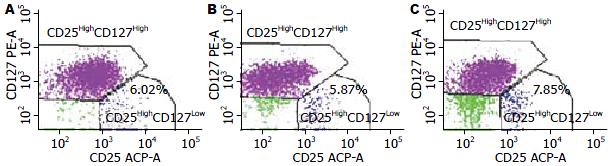
健康体检者外周血和未转移性CRC患者CD4+ T淋巴细胞占所有淋巴细胞比例分别为37.83%±7.62%和37.68%±8.89%, 两者相比较, 无统计学差异. 转移性CRC患者CD4+ T淋巴细胞为34.04%±8.71%, 同健康体检者和未转移患者相比, 差异有统计学意义(P<0.05, 图1, 2).
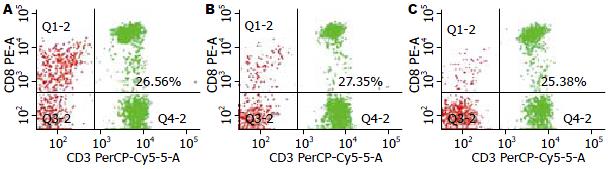
CD8+ T淋巴细胞占所有淋巴细胞比例分别为26.64%±7.54%、26.61%±9.16%、25.75%±9.17%, 三者相比较, 均无统计学差异(图2, 3).
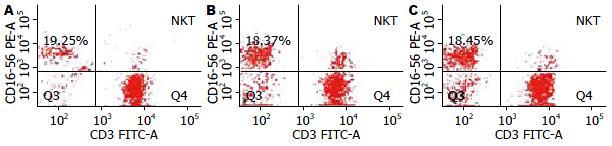
健康体检者、非转移性和转移性CRC患者NK细胞占全部淋巴细胞的比值分别19.30%±8.07%、19.00%±10.60%、18.70%±10.62%, 三组相比较, 无统计学差异(图2, 4).
健康体检者、未转移和转移性CRC患者CD4+CD25HighCD127Low Treg细胞占CD4+ T淋巴细胞的比例分别为6.08%±1.47%、5.91%±1.55%、7.72%±2.20%, 转移患者与健康体检者和未转移患者相比较, 有统计学差异(P<0.05), 而健康体检者和未转移患者相比较, 两者无统计学差异(图2, 5).
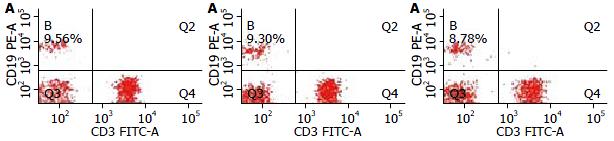
健康体检者、未转移和转移性CRC患者B细胞占淋巴细胞的比例分别为9.80%±6.92%、9.40%±5.10%、8.96%±4.33%, 三者两两比较, 均无统计学差异(图2, 6).
健康体检者、未转移和转移性CRC患者Th/Treg比值分别为6.47±2.54、6.81±4.09、4.70±1.72, 转移性患者与健康体检者和未转移患者相比较, 有统计学差异(P<0.05), 而健康体检者和未转移患者相比较, 两者无统计学差异.
肿瘤是由机体自身细胞在各种内外致癌因素作用下发生恶变转化而成, 在此过程中, 机体的免疫异常与恶性肿瘤的发生、发展、转移及预后密切相关[4-6]. 在机体抗肿瘤细胞免疫应答过程中, 淋巴细胞发挥重要的作用, 检测T淋巴细胞亚群, B淋巴细胞和自然杀伤细胞是目前临床上最常用的反映机体细胞免疫功能状态的指标, 在肿瘤免疫监测中起着重要的作用. 研究发现, 在不同的肿瘤中, 患者会出现不同的免疫功能异常[7-9].
T淋巴细胞是具有多功能的细胞群体, 其中辅助性T淋巴细胞(Th, CD4+)、细胞毒性T淋巴细胞(Tc, CD8+)、调节性T淋巴细胞(Treg, CD4+CD25HighFoxp3+)是近年来研究与肿瘤免疫密切相关的亚型. 在肿瘤发生的早期CD4+ T淋巴细胞可以起到有效的免疫监视作用, CD4+ T淋巴细胞不仅可以分泌大量的细胞因子, 而且CD4+ T淋巴细胞在肿瘤免疫中具有免疫记忆功能, 因而在机体的抗瘤免疫反应中起重要作用. CD8+ T淋巴细胞是一种高效杀伤肿瘤作用的分泌型细胞, 其溶酶体可以裂解蛋白, 特异性的识别靶细胞, 同时也可以分泌特异性抗肿瘤的细胞因子如IL-2、TNF-α、IFN-γ等. Treg细胞又称抑制性T淋巴细胞(suppressor T cells), CD4+分子表达阳性, CD25+高表达, 早期通过检测CD4+CD25+免疫表型来确定是否为Treg细胞, 但不具有特异性, 经研究发现细胞核内Foxp3特异性转录因子高表达于Treg细胞, 但检测需要破膜染色, 不利于临床检测, 在随后的多项相关性研究发现CD127低表达的细胞与Foxp3高表达同属一类细胞, 提示可以用CD127低表达来定量Treg[10-12]. 近年对Treg细胞生物学功能研究发现, 他可以通过抑制其他免疫细胞的活化和增殖来抑制机体的免疫应答反应, 这类细胞在肿瘤的免疫逃逸机制中发挥了重要作用, 在肿瘤微环境或外周血中, 通过分泌IL-10、TGF-β、IL-35等多种细胞因子抑制反应性T淋巴细胞功能, 对宿主免疫系统产生抑制作用, 以此给肿瘤提供逃避免疫识别和杀伤的机会, 促进肿瘤生长[9,13,14]. 国内外一些研究也证实, 在肺癌、肝癌、卵巢癌、胰腺癌、胃肠道肿瘤、乳腺癌等多种实体瘤患者的外周血和肿瘤局部Treg细胞比例明显增高[15-18].
本研究以CRC患者为研究对象, 经统计学分析我们发现, 与正常组相比较转移性CRC患者Treg细胞比例升高, 而CD4+ T淋巴细胞比例下降, 且差异具有显著性, 相比之下, 未转CRC患者与正常组CD4+ T淋巴细胞和Treg细胞, 无明显差别, 提示CRC患者肿瘤转移和CD4+ T淋巴细胞和Treg细胞比例失调有相关性, 同时, 通过分析了另一项机体抗肿瘤参数Th/Treg值, 发现转移性CRC患者比正常组和未转移患者组相比较Th/Treg值有所降低, 且具有统计学意义, 提示进展期肿瘤微环境的免疫耐受状态明显加重, 并有利于癌细胞的转移播散, 预后不良. 我们分析由于Treg细胞对CD4+ T和CD8+ T淋巴细胞、NK细胞、B淋巴细胞、树突状细胞以及单核细胞/巨噬细胞的分化和效应具有抑制功能[19-24], 因此, 我们对CRC患者的B淋巴细胞和NK细胞也做了检测分析, 结果显示转移性CRC患者B淋巴细胞和NK细胞较非转移组和正常组有所降低, B淋巴细胞主要反映机体体液免疫功能状态, 本研究中转移性CRC患者B淋巴细胞降低, 推测可能与其Treg升高产生的免疫抑制有关, 其具体机制需进一步研究证实. NK细胞是机体最主要的抗肿瘤免疫屏障之一, 多数文献报道, 肿瘤患者体内NK细胞会有不同程度的降低[25-28], 本研究通过较大样本研究发现CRC肿瘤患者NK细胞并未明显降低(通过统计学分析无明显差异), 我们分析仅检测肿瘤患者NK细胞含量并不能准确反映肿瘤患者机体的抗肿瘤活性, 可进一步检测其抑制性受体(NKG2A)和活化性受体(NKG2D)的表达来更准确反映肿瘤患者NK细胞抗肿瘤活性[29]. 因此, 未来我们可进一步研究NK细胞亚群如NKG2A和NKG2D之间的关系, 来进一步阐明CRC患者NK细胞抗肿瘤活性, 为探讨肿瘤患者免疫功能紊乱的免疫学机制和肿瘤免疫治疗提供参考.
总之, 本研究通过对CRC患者细胞免疫分析总结, 比较其变化规律, 发现CRC患者的免疫功能存在不同程度的紊乱, 尤其是转移性CRC患者, 为指导临床免疫治疗和了解患者的预后提供较为有意义的参考数据.
结直肠癌(CRC)是消化系统常见的恶性肿瘤, 在我国每年新发病例高达15万. 目前, 对CRC的治疗仍是以手术为主、辅以局部或全身放疗及化疗, 有提高疗效的作用, 特别是近年新辅助放化疗在临床上的应用能使CRC体积缩小, 提高手术切除率和降低局部复发率.
台桂香, 教授, 吉林大学白求恩医学院免疫教研室; 魏继福, 副研究员, 江苏省人民医院中心实验室
国内外一些研究也证实, 在肺癌、肝癌、卵巢癌、胰腺癌、胃肠道肿瘤、乳腺癌等多种实体瘤患者的外周血和肿瘤局部Treg细胞比例明显增高.
转移性结直肠癌患者免疫功能紊乱, 主要表现为CD4+ T细胞、Th/Treg值降低, CD4+CD25HighCD127low Treg细胞升高.
本文设计合理, 数据分析严谨, 结论可靠, 具有较好的学术价值.
编辑: 李薇 电编:何基才
| 1. | Jemal A, Siegel R, Ward E, Hao Y, Xu J, Thun MJ. Cancer statistics, 2009. CA Cancer J Clin. 2009;59:225-249. [PubMed] [DOI] |
| 2. | Karlsson M, Marits P, Dahl K, Dagöö T, Enerbäck S, Thörn M, Winqvist O. Pilot study of sentinel-node-based adoptive immunotherapy in advanced colorectal cancer. Ann Surg Oncol. 2010;17:1747-1757. [PubMed] [DOI] |
| 3. | El-Tawil AM. Colorectal cancer and pollution. World J Gastroenterol. 2010;16:3475-3477. [PubMed] [DOI] |
| 4. | Finn OJ. Cancer immunology. N Engl J Med. 2008;358:2704-2715. [PubMed] [DOI] |
| 5. | Zitvogel L, Tesniere A, Kroemer G. Cancer despite immunosurveillance: immunoselection and immunosubversion. Nat Rev Immunol. 2006;6:715-727. [PubMed] [DOI] |
| 6. | Nagorsen D, Scheibenbogen C, Marincola FM, Letsch A, Keilholz U. Natural T cell immunity against cancer. Clin Cancer Res. 2003;9:4296-4303. [PubMed] |
| 7. | Croci DO, Zacarías Fluck MF, Rico MJ, Matar P, Rabinovich GA, Scharovsky OG. Dynamic cross-talk between tumor and immune cells in orchestrating the immunosuppressive network at the tumor microenvironment. Cancer Immunol Immunother. 2007;56:1687-1700. [PubMed] [DOI] |
| 8. | Clarke SL, Betts GJ, Plant A, Wright KL, El-Shanawany TM, Harrop R, Torkington J, Rees BI, Williams GT, Gallimore AM. CD4+CD25+FOXP3+ regulatory T cells suppress anti-tumor immune responses in patients with colorectal cancer. PLoS One. 2006;1:e129. [PubMed] [DOI] |
| 9. | Beyer M, Schultze JL. Regulatory T cells: major players in the tumor microenvironment. Curr Pharm Des. 2009;15:1879-1892. [PubMed] [DOI] |
| 10. | Hartigan-O'Connor DJ, Poon C, Sinclair E, McCune JM. Human CD4+ regulatory T cells express lower levels of the IL-7 receptor alpha chain (CD127), allowing consistent identification and sorting of live cells. J Immunol Methods. 2007;319:41-52. [PubMed] [DOI] |
| 11. | Liu W, Putnam AL, Xu-Yu Z, Szot GL, Lee MR, Zhu S, Gottlieb PA, Kapranov P, Gingeras TR, Fazekas de St Groth B. CD127 expression inversely correlates with FoxP3 and suppressive function of human CD4+ T reg cells. J Exp Med. 2006;203:1701-1711. [PubMed] [DOI] |
| 12. | 荣 守华, 贾 莉婷, 泰 淑红, 张 展, 冯 爱强, 王 玉萍. CD4+ CD25highCD127low调节性T细胞在乳腺癌患者外周血中的临床意义. 免疫学杂志. 2009;26:785-788. |
| 13. | Vignali DA, Collison LW, Workman CJ. How regulatory T cells work. Nat Rev Immunol. 2008;8:523-532. [PubMed] [DOI] |
| 14. | Woo EY, Yeh H, Chu CS, Schlienger K, Carroll RG, Riley JL, Kaiser LR, June CH. Cutting edge: Regulatory T cells from lung cancer patients directly inhibit autologous T cell proliferation. J Immunol. 2002;168:4272-4276. [PubMed] |
| 15. | Kono K, Kawaida H, Takahashi A, Sugai H, Mimura K, Miyagawa N, Omata H, Fujii H. CD4(+)CD25high regulatory T cells increase with tumor stage in patients with gastric and esophageal cancers. Cancer Immunol Immunother. 2006;55:1064-1071. [PubMed] [DOI] |
| 16. | Liyanage UK, Moore TT, Joo HG, Tanaka Y, Herrmann V, Doherty G, Drebin JA, Strasberg SM, Eberlein TJ, Goedegebuure PS. Prevalence of regulatory T cells is increased in peripheral blood and tumor microenvironment of patients with pancreas or breast adenocarcinoma. J Immunol. 2002;169:2756-2761. [PubMed] |
| 17. | Ichihara F, Kono K, Takahashi A, Kawaida H, Sugai H, Fujii H. Increased populations of regulatory T cells in peripheral blood and tumor-infiltrating lymphocytes in patients with gastric and esophageal cancers. Clin Cancer Res. 2003;9:4404-4408. [PubMed] |
| 18. | Woo EY, Chu CS, Goletz TJ, Schlienger K, Yeh H, Coukos G, Rubin SC, Kaiser LR, June CH. Regulatory CD4(+)CD25(+) T cells in tumors from patients with early-stage non-small cell lung cancer and late-stage ovarian cancer. Cancer Res. 2001;61:4766-4772. [PubMed] |
| 19. | Wolf AM, Wolf D, Steurer M, Gastl G, Gunsilius E, Grubeck-Loebenstein B. Increase of regulatory T cells in the peripheral blood of cancer patients. Clin Cancer Res. 2003;9:606-612. [PubMed] |
| 20. | Curiel TJ, Coukos G, Zou L, Alvarez X, Cheng P, Mottram P, Evdemon-Hogan M, Conejo-Garcia JR, Zhang L, Burow M. Specific recruitment of regulatory T cells in ovarian carcinoma fosters immune privilege and predicts reduced survival. Nat Med. 2004;10:942-949. [PubMed] |
| 21. | 王 芳, 吕 洪敏, 韩 涛, 王 鹏, 王 凤梅, 朱 争艳, 向 慧玲. 不同方法检测肝癌患者外周血中CD4+CD25hi-intTregs水平的关系及意义. 世界华人消化杂志. 2010;18:1384-1389. [DOI] |
| 22. | Romagnani C, Della Chiesa M, Kohler S, Moewes B, Radbruch A, Moretta L, Moretta A, Thiel A. Activation of human NK cells by plasmacytoid dendritic cells and its modulation by CD4+ T helper cells and CD4+ CD25hi T regulatory cells. Eur J Immunol. 2005;35:2452-2458. [PubMed] [DOI] |
| 23. | Aluvihare VR, Kallikourdis M, Betz AG. Regulatory T cells mediate maternal tolerance to the fetus. Nat Immunol. 2004;5:266-271. [PubMed] [DOI] |
| 24. | Sakaguchi S, Yamaguchi T, Nomura T, Ono M. Regulatory T cells and immune tolerance. Cell. 2008;133:775-787. [PubMed] [DOI] |
| 25. | Waldhauer I, Steinle A. NK cells and cancer immunosurveillance. Oncogene. 2008;27:5932-5943. [PubMed] [DOI] |
| 26. | Ralainirina N, Poli A, Michel T, Poos L, Andrès E, Hentges F, Zimmer J. Control of NK cell functions by CD4+CD25+ regulatory T cells. J Leukoc Biol. 2007;81:144-153. [PubMed] [DOI] |
| 27. | Albertsson PA, Basse PH, Hokland M, Goldfarb RH, Nagelkerke JF, Nannmark U, Kuppen PJ. NK cells and the tumour microenvironment: implications for NK-cell function and anti-tumour activity. Trends Immunol. 2003;24:603-609. [PubMed] [DOI] |
| 28. | Arnon TI, Markel G, Mandelboim O. Tumor and viral recognition by natural killer cells receptors. Semin Cancer Biol. 2006;16:348-358. [PubMed] [DOI] |