修回日期: 2011-04-02
接受日期: 2011-04-11
在线出版日期: 2011-04-28
目的: 研究大鼠急性坏死性胰腺炎(ANP)胰腺组织LC3、Beclin1的表达, 并探讨其在ANP中的作用及意义.
方法: 36只SD大鼠随机分为假手术(SO)组和ANP组, ANP组采用胰胆管逆行注射5%牛磺胆酸钠诱导制作大鼠ANP模型, SO组开腹后翻动胰腺后关腹, 各组再分3、6和12 h 3个不同时间点. 观察各组大鼠血清炎症因子及胰腺的病理改变, 运用免疫组织化学法检测各组大鼠在不同时间点胰腺组织LC3和Beclin1的变化.
结果: ANP组血浆淀粉酶(U/L)、TNF-α(μg/L)较SO组明显增加(血浆淀粉酶: 3 h: 4 936±1 207 vs 1 447±355; 6 h: 5 464±768 vs 1 513±333; 12 h: 6 139±710 vs 1 539±231; TNF-α: 3 h: 111.24±21.86 vs 56.14±7.69; 6 h: 107.55±33.05 vs 57.13±11.30; 12 h: 108.24 ±24.83 vs 58.60±9.54, 均P<0.05), 且ANP组大鼠胰腺病理改变随着时间延长加重. 正常大鼠胰腺腺泡细胞LC3、Beclin1低表达, 大鼠ANP 3 h后胰腺细胞LC3、Beclin1表达开始增多, 在6和12 h呈强表达.
结论: 大鼠ANP后胰腺组织Beclin1和LC3增多, 表明ANP后胰腺自噬活性增强, 其表达与炎症变化程度相关, 细胞自噬增强是可能对损伤的反应.
引文著录: 杨淑丽, 陈卫昌, 孙楹, 陈冯梅. 自噬相关基因LC3和Beclin1在大鼠急性坏死性胰腺炎中的表达和意义. 世界华人消化杂志 2011; 19(12): 1231-1236
Revised: April 2, 2011
Accepted: April 11, 2011
Published online: April 28, 2011
AIM: To examine the expression of microtubule-associated protein 1 light chain 3 (LC3) and Beclin-1 in acute necrotizing pancreatitis (ANP) in rats and to analyze their significance.
METHODS: Thirty-six Sprague-Dawley rats were randomized into sham operation (SO) group and ANP group. ANP was induced in rats by retrograde injection of 5% sodium taurocholate into the bili-pancreatic duct. Rats were killed at 3, 6, and 12 h after sodium taurocholate injection. Pancreatic histopathological changes and serum levels of several inflammatory factors were measured. The expression of LC3 and Beclin-1 in ANP at different time points was detected by immunohistochemistry.
RESULTS: Pancreatic pathological changes were gradually exacerbated with time in the ANP group. Serum levels of amylase (AMY, U/L) and TNF-α (μg/L) were significantly higher in the ANP group than in the SO group at all time points (AMY: 3 h: 4 936 ± 1 207 vs 1 447 ± 355; 6 h: 5 464 ± 768 vs 1 513 ± 333; 12 h: 6 139 ± 710 vs 1 539 ± 231; TNF-α: 3 h: 111.24 ± 21.86 vs 56.14 ± 7.69; 6 h: 107.55 ± 33.05 vs 57.13 ± 11.30; 12 h: 108.24 ± 24.83 vs 58.60 ± 9.54, all P < 0.05). The expression levels of LC3 and Beclin-1 in the pancreas were maintained at a very low level in the SO group, but started to elevate at 3 h in the ANP group and showed strong expression at 6 and 12 h (all P < 0.05).
CONCLUSION: The expression levels of LC3 and Beclin-1 increased in ANP in rats, suggesting that up-regulation of autophagic activity may represent a response to injury in rats with ANP.
- Citation: Yang SL, Chen WC, Sun Y, Chen FM. Significance of expression of autophagy-related proteins LC3 and Beclin-1 in acute necrotizing pancreatitis in rats. Shijie Huaren Xiaohua Zazhi 2011; 19(12): 1231-1236
- URL: https://www.wjgnet.com/1009-3079/full/v19/i12/1231.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i12.1231
自噬(autophagy)是细胞利用溶酶体降解自身受损的细胞器和大分子物质的过程, 是真核细胞特有的生命现象[1], 这一过程在细胞清除废物、重建结构以及生长发育中、维持内环境稳定中起重要作用, 并与疾病的发生密切相关[2,3]. 现研究表明, 自噬是细胞生长发育、成熟分化及死亡的重要调控机制, 又是细胞对不良环境的一种防御机制. Beclin1蛋白是自噬通路必须的磷脂酰肌醇3磷酸激酶(phosphatidylinositol-3-kinase, PI3K)复合物的组成部分[4,5]. 微管相关蛋白1轻链3(microtubule-associated protein 1 light chain 3, MAP1-LC3, LC3)是目前观察自噬现象是否存在、研究自噬活性较为可靠的生物学标志物[6,7]. 本文通过检测大鼠急性坏死性胰腺炎(acute necrotizing pancreatitis, ANP)后胰腺Beclin1和LC3表达的变化, 了解ANP发生后胰腺细胞的自噬变化与炎症的关系, 以进一步揭示急性胰腺炎(acute pancreatitis, AP)发生发展的机制.
健康♂Sprague-Dawley大鼠, 体质量200-250 g(由苏州大学动物实验中心提供). 牛磺胆酸钠购自Sigma公司, TNF-α试剂盒购自上海西唐生物公司, LC3和Beclin1兔多克隆抗体购自Santa Cruz公司, 辣根过氧化物酶标记羊抗兔IgG购自北京博奥森生物公司, SABC免疫组织化学试剂盒北京博奥森生物公司.
1.2.1 分组: 将大鼠随机分成假手术(SO)组及ANP组, 每18只. 各组再分为术后3、6、12 h 3个亚组, 每组6只.
1.2.2 造模及组织处理: ANP组, 模型制备采用改良的Aho方法[8], 以0.1 mL/min的速度向胰胆管内逆行注入5%(1 mL/kg)牛磺胆酸钠建立大鼠ANP模型. SO组, 开腹后仅翻动胰腺, 即关腹. 各组分别于术后3、6和12 h腹主动脉抽血, 分离血浆保存于-20 ℃中备测, 将大鼠处死. 留取胰腺和肺组织, 40 g/L甲醛固定用于常规病理学检查和免疫组织化学检测.
1.2.3 观察指标和检测: (1)血淀粉酶(amylase, AMY): 采用全自动生化分析仪检测, 血浆TNF-α采用ELISA 方法检测, 严格按试剂盒说明进行操作; (2)胰腺病理学改变: 取固定的各组胰腺标本石蜡包埋, 4 μm连续切片, 行常规HE染色, 采用盲法由专科医师在光镜下阅片, 每张切片随机选择5个高倍视野, 观察胰腺组织病理变化; (3)免疫组织化学检测胰腺组织LC3和Beclin1的表达: 40 g/L甲醛固定的胰腺组织, 常规脱水, 石蜡包埋, 制备成4 μm厚连续切片, 经二甲苯脱蜡及梯度乙醇水化后, PBS冲洗, 正常山羊血清封闭背景, 室温l5 min; 加一抗LC3抗体和Beclin1(1:200), 4 ℃过夜, PBS冲洗; 滴加生物素化二抗工作液, 37 ℃孵育1-2 h, PBS洗冲; 加入辣根酶标记链霉卵白素1滴, 37 ℃孵育, 30 min, PBS冲洗; 使用DAB显色试剂盒显色, 自来水冲洗切片1-2 min; 切片苏木素复染、梯度酒精脱水、二甲苯透明、中性树胶封片, 显微镜观察. 以胞质出现棕黄色颗粒细胞为阳性细胞, 随机观察5个高倍视野, 根据其中阳性细胞的比率和染色深度分别进行评估, 最后综合评定. (1)阳性细胞的比率评分: 0分为阳性细胞数占总细胞数<10%, 1分为阳性细胞数占总细胞数10%-25%, 2分为阳性细胞数占总细胞数26%-50%, 3分为阳性细胞数占总细胞数51%-75%, 4分为阳性细胞数占总细胞数>75%%; (2)染色深度评分: 0分为无染色, 1分为淡黄色, 3分为黄色至棕黄色, 2分为染色强度介于1分与3分之间; (3)总积分 = 阳性细胞比率评分+染色强度评分.
统计学处理 数据以mean±SD表示, 使用SPSS15.0统计软件, 多组间比较采用方差分析(ANOVA), 实验组与对照组比较采用最小显著差法(LSD), 实验组之间比较采用t检验, 以P<0.05为差异具有统计学意义.
ANP组各时间点AMY及TNF-α水平均较SO组显著升高(P<0.05, 表1).
SO组光镜下大鼠胰腺组织基本正常, 各亚组之间无明显差异性. ANP组可见胰腺腺泡水肿及腺泡结构破坏、消失, 叶间隔、小叶间隔及腺泡间隔显著增宽, 腺泡细胞呈不同程度变性坏死, 周围出血, 随着时间的延长, 病变呈进行性加重.
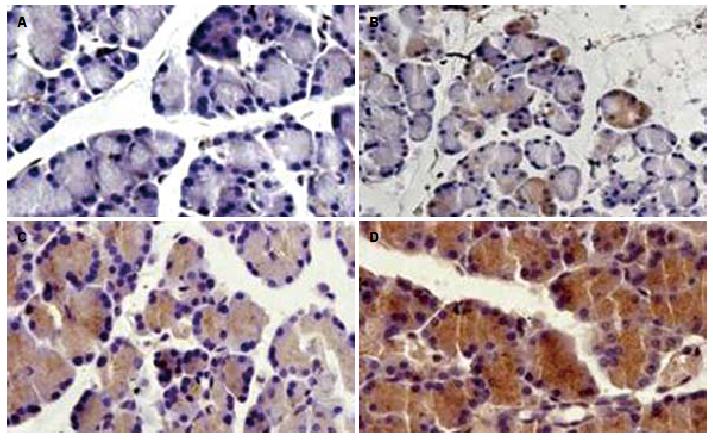
LC3阳性表达见于细胞质, 细胞核中未见表达. SO组各时间点大鼠胰腺细胞胞质见少量LC3阳性细胞. 在ANP组中, 制模3 h后腺泡细胞胞质中LC3阳性细胞增多,并持续增高, 在6、12 h呈强表达, 胞质棕褐色, 着色加深, 胰岛细胞的表达多于腺泡细胞(图1). SO组各时间点腺泡细胞内LC3阳性表达无明显差别, ANP组比SO组各相应时间点胰腺LC3阳性细胞表达增加, 差异具有统计学意义(P<0.05); ANP组各时间点比较, 6 h组比3 h组胰腺LC3阳性细胞表达增加, 12 h比6 h阳性细胞增多, 差异具有统计学意义(P<0.05, 表2).
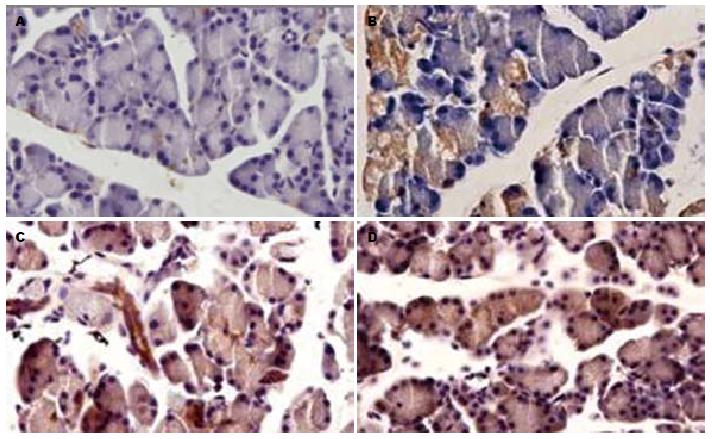
Beclin1阳性表达主要见于细胞质, 正常胰腺Beclin1阳性细胞低表达, 在ANP各组胰腺腺泡细胞有阳性表达, 其中, 在ANP 12 h呈强表达(图2), ANP组与SO组比较, 腺泡细胞LC3和Beclin1阳性在各时间点表达有明显增加, ANP组各时间点比较, Beclin1阳性细胞表达有明显差别, 差异具有统计学意义(P<0.05, 表2).
自噬是细胞利用溶酶体降解自身受损的细胞器和大分子物质的过程, 是真核细胞特有的生命现象, 主要通过对长寿命蛋白以及细胞器的降解和再利用, 对细胞进行调节[9]. 现研究表明, 自噬是细胞生长发育、成熟分化及死亡的重要调控机制, 又是细胞对不良环境的一种防御机制[10]. 除此之外, 自噬参与多种疾病的病理过程, 如肿瘤、神经退行性病变、心脏疾病、病原体感染等密切相关[11-16]. 随着对细胞自噬的分子机制的深入研究, 自噬在疾病中的作用引起了广泛的重视.
AP的发病率呈增加趋势. 尽管近年来有关AP的发病机制和临床诊治有了一定的进展, 但AP尤其是重症急性胰腺炎(severe acute pancreatitis, SAP)依然是临床常见且严重危及患者生命的急性炎症性疾病. SAP可发展为全身炎症反应综合征、胰腺坏死进而并发多器官功能障碍, 导致患者死亡[17,18], 然而目前针对SAP尚无确切有效的治疗方法. 最近的研究表明自噬活性的异常与AP关系密切[19-21], 已成为目前探讨AP发生发展研究的新靶点.
LC3是哺乳动物细胞中酵母ATG8(Aut7/Apg8)基因的同源物, 定位于前自噬泡和自噬泡膜表面, 参与自噬体的形成. LC3有Ⅰ型和Ⅱ型之分. 未发生自噬时, 细胞内合成的LC3经过加工, 成为胞质可溶性的Ⅰ型LC3, 常规表达. 当自体吞噬发生时, Ⅰ型LC3经泛素样加工修饰过程, 与自噬膜表面的磷脂酰乙醇胺结合, 形成Ⅱ型LC3. LC3-Ⅱ结合并始终位于胞内自噬体的膜上, 其含量的多少与自噬泡数量的多少成正比[3,22]. 因此LC3表达强度与自噬活性密切相关. 最近研究提示, LC3-Ⅱ在雨蛙肽、酒精等诱导的ANP时明显增加[23-25]. 本研究结果显示在SO组胰腺组织中LC3以低表达为主, 在牛黄胆酸钠诱导的ANP组, LC3的表达在3 h增强且随时间延长表达增加, 与前述报道相似. SO组胰腺LC3表达水平显著低于ANP组, 提示在5%牛黄胆酸钠所致的ANP中, 自噬被激活, 胰腺组织中存在LC3表达增强, 主要在细胞质中表达, 且6-12 h达到高峰, 表明在ANP时, 自噬活性增强可能是腺泡细胞对损伤的一种反应.
Beclin1是酵母ATG6的同系物, 也是哺乳动物参与自噬的特异性基因[26], 通过与ClassⅢ PI3K形成复合物参与自噬体的形成通过与ClassⅢPI3K形成复合体, 从而使磷脂酰肌醇磷酸化, 产生PI3P, 在自噬前体复合物的形成及自噬小体膜的来源中发挥重要作用[27,28]. 研究表明, 在雨蛙肽诱导的AP中, 胰腺组织中Beclin1的表达增加且与自噬空泡变化一致, 提示自噬被激活且参与腺泡细胞的自噬空泡的形成[24]. 本研究发现, Beclin1在ANP发生后3 h增加, 在6 h和12 h持续升高, 与LC3的表达基本一致, 提示自噬在ANP时被激活, 可能与AP的发生发展有关.
然而, 在哺乳动物中关于自噬发生的机制仍然不明确[29], 自噬相关基因Beclin1和LC3在ANP后上调在其发生中的具体作用亦尚不清楚, 通过对Atg5基因敲除的老鼠注射雨蛙肽, 建立AP模型, 发现在Atg5基因敲除的老鼠, 仅表现局部的轻微炎症, 且胰蛋白酶原的激活有很大的减少, 故认为在AP早期的胰腺腺泡细胞内, 自噬通过在胰蛋白酶原激活为胰蛋白酶过程中可能扮演一个不好的作用[23]. 本次研究我们观察AP后自噬相关基因Beclin1和LC3表达均增加, 而且LC3和Beclin1 的表达同ANP发生时间呈一定程度的相关性, 随着时间的延长, LC3和Beclin1的表达逐渐升高, 推测激活的LC3和Beclin1可能参与AP的早期发生过程. 另外, 通过对AMY、TNF-α和胰腺的病理学检测, 我们发现, 随着时间延长, 胰腺的炎症程度和病理改变增加, 与相关报道一致[30]. 另外, 随着AP的炎症程度增加, LC3和Beclin1表达也进一步增加, 故认为ANP后LC3和Beclin1的升高与AP的炎症程度相关, 推测ANP早期自噬的激活参与到腺泡细胞的炎症过程, 但自噬激活如何引起炎症因子的变化有待于进一步研究.
总之, LC3与Beclin1在5%牛黄胆酸钠诱导的ANP胰腺组织中的表达上调, 且升高的程度与ANP的炎症程度相一致, 提示自噬在ANP早期被激活, 参与到ANP发生发展过程. 但自噬激活的具体机制目前尚未完全明确, 随着对自噬研究的不断深入, 进一步阐明AP后自噬激活的机制, 明确其在AP发生发展中的作用, 从而为寻新的治疗靶点提供重要的理论依据.
自噬是细胞生长发育、成熟分化及死亡的重要调控机制, 又是细胞对不良环境的一种防御机制. Beclin1蛋白是自噬通路必须的磷脂酰肌醇3磷酸激酶(PI3K)复合物的组成部分. 微管相关蛋白1轻链3(LC3)是目前观察自噬现象是否存在、研究自噬活性较为可靠的生物学标志物.
郭晓钟, 教授, 中国人民解放军沈阳军区总医院消化内科
随着对细胞自噬的分子机制的深入研究, 自噬在疾病中的作用引起了广泛的重视. 最近的研究表明自噬活性的异常与AP关系密切, 已成为目前探讨AP发生发展研究的新靶点.
研究表明, 在雨蛙肽诱导的AP中, 胰腺组织中Beclin1的表达增加且与自噬空泡变化一致, 提示自噬被激活且参与腺泡细胞的自噬空泡的形成.
大鼠ANP后胰腺组织Beclin1和LC3增多, 表明ANP后胰腺自噬活性增强, 其表达与炎症变化程度相关, 细胞自噬增强是可能对损伤的反应.
本文内容详实, 具有一定的临床借鉴意义, 但科学性及创新性一般.
编辑: 李薇 电编:何基才
| 1. | Klionsky DJ, Emr SD. Autophagy as a regulated pathway of cellular degradation. Science. 2000;290:1717-1721. [PubMed] [DOI] |
| 2. | Levine B, Klionsky DJ. Development by self-digestion: molecular mechanisms and biological functions of autophagy. Dev Cell. 2004;6:463-477. [PubMed] [DOI] |
| 3. | Shintani T, Klionsky DJ. Autophagy in health and disease: a double-edged sword. Science. 2004;306:990-995. [PubMed] [DOI] |
| 4. | Liang XH, Jackson S, Seaman M, Brown K, Kempkes B, Hibshoosh H, Levine B. Induction of autophagy and inhibition of tumorigenesis by beclin 1. Nature. 1999;402:672-676. [PubMed] [DOI] |
| 5. | Kihara A, Kabeya Y, Ohsumi Y, Yoshimori T. Beclin-phosphatidylinositol 3-kinase complex functions at the trans-Golgi network. EMBO Rep. 2001;2:330-335. [PubMed] [DOI] |
| 6. | Mizushima N. Methods for monitoring autophagy. Int J Biochem Cell Biol. 2004;36:2491-2502. [PubMed] [DOI] |
| 7. | Kabeya Y, Mizushima N, Ueno T, Yamamoto A, Kirisako T, Noda T, Kominami E, Ohsumi Y, Yoshimori T. LC3, a mammalian homologue of yeast Apg8p, is localized in autophagosome membranes after processing. EMBO J. 2000;19:5720-5728. [PubMed] [DOI] |
| 8. | 张 明钧, 姚 玮艳, 乔 敏敏, 诸 琦, 袁 耀宗. 肠壁穿刺逆行胰胆管注射牛黄胆酸钠重症急性胰腺炎造模. 上海交通大学学报(医学版). 2006;26:488-490. |
| 9. | Duprez L, Wirawan E, Vanden Berghe T, Vandenabeele P. Major cell death pathways at a glance. Microbes Infect. 2009;11:1050-1062. [PubMed] [DOI] |
| 10. | Monastyrska I, Klionsky DJ. Autophagy in organelle homeostasis: peroxisome turnover. Mol Aspects Med. 2006;27:483-494. [PubMed] [DOI] |
| 11. | Mizushima N, Levine B, Cuervo AM, Klionsky DJ. Autophagy fights disease through cellular self-digestion. Nature. 2008;451:1069-1075. [PubMed] [DOI] |
| 12. | Hippert MM, O'Toole PS, Thorburn A. Autophagy in cancer: good, bad, or both? Cancer Res. 2006;66:9349-9351. [PubMed] [DOI] |
| 14. | Tannous P, Zhu H, Nemchenko A, Berry JM, Johnstone JL, Shelton JM, Miller FJ, Rothermel BA, Hill JA. Intracellular protein aggregation is a proximal trigger of cardiomyocyte autophagy. Circulation. 2008;117:3070-3078. [PubMed] [DOI] |
| 15. | Yang Q, She H, Gearing M, Colla E, Lee M, Shacka JJ, Mao Z. Regulation of neuronal survival factor MEF2D by chaperone-mediated autophagy. Science. 2009;323:124-127. [PubMed] [DOI] |
| 16. | Hara T, Nakamura K, Matsui M, Yamamoto A, Nakahara Y, Suzuki-Migishima R, Yokoyama M, Mishima K, Saito I, Okano H. Suppression of basal autophagy in neural cells causes neurodegenerative disease in mice. Nature. 2006;441:885-889. [PubMed] [DOI] |
| 18. | Kylänpää ML, Repo H, Puolakkainen PA. Inflammation and immunosuppression in severe acute pancreatitis. World J Gastroenterol. 2010;16:2867-2872. [PubMed] [DOI] |
| 19. | Vaccaro MI. Autophagy and pancreas disease. Pancreatology. 2008;8:425-429. [PubMed] [DOI] |
| 20. | Ohmuraya M, Yamamura K. Autophagy and acute pancreatitis: a novel autophagy theory for trypsinogen activation. Autophagy. 2008;4:1060-1062. [PubMed] |
| 21. | Fortunato F, Kroemer G. Impaired autophagosome-lysosome fusion in the pathogenesis of pancreatitis. Autophagy. 2009;5:850-853. [PubMed] |
| 22. | Levine B, Yuan J. Autophagy in cell death: an innocent convict? J Clin Invest. 2005;115:2679-2688. [PubMed] [DOI] |
| 23. | Mareninova OA, Hermann K, French SW, O'Konski MS, Pandol SJ, Webster P, Erickson AH, Katunuma N, Gorelick FS, Gukovsky I. Impaired autophagic flux mediates acinar cell vacuole formation and trypsinogen activation in rodent models of acute pancreatitis. J Clin Invest. 2009;119:3340-3355. [PubMed] |
| 24. | Hashimoto D, Ohmuraya M, Hirota M, Yamamoto A, Suyama K, Ida S, Okumura Y, Takahashi E, Kido H, Araki K. Involvement of autophagy in trypsinogen activation within the pancreatic acinar cells. J Cell Biol. 2008;181:1065-1072. [PubMed] [DOI] |
| 25. | Fortunato F, Bürgers H, Bergmann F, Rieger P, Büchler MW, Kroemer G, Werner J. Impaired autolysosome formation correlates with Lamp-2 depletion: role of apoptosis, autophagy, and necrosis in pancreatitis. Gastroenterology. 2009;137:350-360, 360.e1-e5. [PubMed] |
| 26. | Meijer AJ, Codogno P. Regulation and role of autophagy in mammalian cells. Int J Biochem Cell Biol. 2004;36:2445-2462. [PubMed] [DOI] |
| 27. | Friedman LS, Ostermeyer EA, Lynch ED, Szabo CI, Anderson LA, Dowd P, Lee MK, Rowell SE, Boyd J, King MC. The search for BRCA1. Cancer Res. 1994;54:6374-6382. [PubMed] |
| 28. | Takahashi Y, Coppola D, Matsushita N, Cualing HD, Sun M, Sato Y, Liang C, Jung JU, Cheng JQ, Mulé JJ. Bif-1 interacts with Beclin 1 through UVRAG and regulates autophagy and tumorigenesis. Nat Cell Biol. 2007;9:1142-1151. [PubMed] [DOI] |
| 29. | Reggiori F, Klionsky DJ. Autophagosomes: biogenesis from scratch? Curr Opin Cell Biol. 2005;17:415-422. [PubMed] [DOI] |
| 30. | Long J, Song N, Liu XP, Guo KJ, Guo RX. Nuclear factor-kappaB activation on the reactive oxygen species in acute necrotizing pancreatitic rats. World J Gastroenterol. 2005;11:4277-4280. [PubMed] |