修回日期: 2011-03-25
接受日期: 2011-04-11
在线出版日期: 2011-04-18
目的: 探讨食管鳞癌细胞凋亡抑制蛋白1(c-IAP1)表达与化疗敏感性的相关性.
方法: 食管鳞癌组织芯片免疫组织化学染色, 分析食管鳞癌组织及其配对癌旁食管上皮中c-IAP1的表达和定位及其与肿瘤临床分级的关系. 免疫印迹分析食管癌细胞c-IAP1和Smac表达, 用RNA干扰技术敲降Smac表达, MTT法检测细胞对化疗药物敏感性的影响. 统计分析采用卡方检验.
结果: 与癌旁食管上皮(54%, 28/52)相比, c-IAP1在食管癌组织中高表达(67%, 35/52), 但与肿瘤病理分级、年龄和性别无关. c-IAP1定位于组织细胞质和细胞核, 在46%(24/52)的肿瘤组织中, 细胞质c-IAP1表达水平显著高于配对癌旁食管上皮4%(2/52), 具有统计学意义(P<0.001). 食管癌EC0156、KYSE510、KYSE30、KYSE180和KYSE170细胞普遍表达c-IAP1, 其中KYSE170细胞表达最高. 经RNA干扰敲降Smac分子, 可显著降低KYSE170细胞对化疗药物的敏感性.
结论: c-IAP1蛋白在食管癌组织细胞质中表达率高, 经化疗药物处理后, Smac介导c-IAP1降解, 增加了食管癌细胞对化疗药物的敏感性, c-IAP1在调控食管癌化疗敏感性中发挥重要作用.
引文著录: 许杨, 刘芳, 周兰萍, 赵晓航. c-IAP1在食管鳞癌中的表达及其对化疗敏感性的影响. 世界华人消化杂志 2011; 19(11): 1138-1144
Revised: March 25, 2011
Accepted: April 11, 2011
Published online: April 18, 2011
AIM: To investigate the expression of cellular inhibitor of apoptosis protein 1 (c-IAP1) in esophageal squamous cell carcinoma (ESCC) and to evaluate the correlation between c-IAP1 expression and chemosensitivity of ESCC cell lines.
METHODS: Immunohistochemistry staining was performed to determine the expression of c-IAP1 in ESCC on tissue microarray. The chi-square test was used to analyze the correlation between c-IAP1 expression and clinicopathologic parameters of ESCC. The expression of c-IAP1 and Smac in several ESCC cell lines was detected by Western blot. The chemosensitivity of ESCC cell lines was evaluated by RNA interference with Smac gene expression and MTT assay.
RESULTS: c-IAP1 expression was found in 67% (35/52) of ESCC tissue specimens and in 54% (28/52) of tumor-adjacent normal tissue specimens. c-IAP1 expression was not correlated with age, gender, tumor stage (all P > 0.05). c-IAP1 was localized to both the cytoplasm and nucleus. Cytoplasmic c-IAP1 expression was detected more frequently in ESCC than in tumor-adjacent tissue specimens [45% (24/52) vs 4% (2/52), P < 0.001]. c-IAP1 and Smac were widely expressed in ESCC cell lines, including EC0156, KYSE510, KYSE180, KYSE170, and KYSE30. Knockdown of Smac significantly reduced chemosensitivity of KYSE170 cell line to anticancer drugs.
CONCLUSION: The expression of c-IAP1 was up-regulated in both ESCC cell lines and tumor tissue. Smac mediates the degradation of c-IAP1 after cisplatin treatment. c-IAP1 and Smac might regulate chemosensitivity of ESCC cell lines.
- Citation: Xu Y, Liu F, Zhou LP, Zhao XH. c-IAP1 expression and tumor chemosensitivity in esophageal squamous cell carcinoma. Shijie Huaren Xiaohua Zazhi 2011; 19(11): 1138-1144
- URL: https://www.wjgnet.com/1009-3079/full/v19/i11/1138.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i11.1138
凋亡抑制蛋白(inhibitor of apoptosis proteins, IAPs)是一类高度保守的内源性抗细胞凋亡因子家族, 主要通过抑制caspase3、7、9等酶活性和参与调节NF-κB的作用而抑制细胞凋亡[1,2]. Roy等1995年首次从脊髓性肌萎缩症研究中, 发现IAP蛋白是神经元性凋亡抑制蛋白(neuronal apoptotic inhibitor protein, NAIP). 此后人们陆续发现了细胞凋亡抑制蛋白(cellular IAP1, 2, c-IAP l、2)、X染色体连锁凋亡抑制因子(X-linked IAP, XIAP)等, 至今已发现8个人类IAPs家族蛋白成员[3]. 细胞凋亡是机体消除有害细胞防止细胞过度增殖的正常生理过程, 是维持机体正常的细胞更新和增殖的关键. 肿瘤的发生往往是细胞存活与凋亡失衡导致细胞过度增生的结果. 目前研究已证实c-IAP1在多种恶性肿瘤的发生发展过程中发挥了重要作用. c-IAP1是一种广泛存在的胞质蛋白, 与恶性肿瘤发生发展密切相关. 在白血病、淋巴瘤、肺癌、卵巢癌、肾细胞癌、黏膜和色素瘤、腺样囊性癌等恶性肿瘤组织中c-IAP1蛋白表达升高[4-9]. 食管癌是我国常见消化系恶性肿瘤, 主要以食管鳞状细胞癌(esophageal squamous cell carcinoma, ESCC)为主. 文献调研显示关于c-IAP1在食管癌发生发展及对化疗敏感性中作用的研究报道较少. 本研究采用免疫组织化学、Western blot等方法, 分析了c-IAP1在人食管鳞癌细胞系和食管鳞癌组织中的表达和定位, 及c-IAP1表达与临床病理参数的关系; 利用RNA干扰和MTT方法分析了c-IAP1和Smac对食管癌化疗敏感性的影响, 对认识c-IAP1在食管鳞癌发生发展及化疗敏感性的作用和机制方面具有重要意义.
人食管鳞癌细胞系EC0156由本实验室建立[10], KYSE510、KYSE180、KYSE170和KYSE30由日本京都大学Shimada博士惠赠. 抗体购买来源: c-IAP1(R&D Systems公司)、Smac(Calbiochem和Merk公司)和β-actin(Sigma公司). 含有56对食管癌组织微阵列芯片由本室自制, 其中28对食管鳞状细胞癌/癌旁远端配对组织样本取自中国医学科学院肿瘤医院胸外科单纯手术治疗患者, 另28对食管鳞状细胞癌/癌旁远端配对组织样本取自山西阳泉高发现场肿瘤研究所, 病例取材得到患者本人知情同意, 患者术前未接受输血和放化疗. EliVisionTM plus试剂盒购自福建迈新生物有限公司.
1.2.1 细胞培养: EC0156细胞培养含100 mL/L胎牛血清的DMEM培养基. KYSE170、KYSE150、KYSE140和KYSE30细胞培养于含100 mL/L胎牛血清的RPMI 1640培养基中. 两种培养基在使用前添加100 kIU/L青霉素和100 g/L链霉素. 所有细胞均置于含50 mL/L CO2的37 ℃孵育箱内培养, 每3-5 d传代1次.
1.2.2 免疫组织化学分析: 组织芯片经二甲苯脱蜡, 梯度乙醇水化处理, 用1×PBS(pH7.4)洗3次, 经10 mmol/L pH6.0枸橼酸盐缓冲液, 100 ℃孵育10 mins后, 1×PBS洗3次; 3% H2O2室温孵育10 min后, 1×PBS洗3次; 一抗孵育4 ℃过夜, 1×PBS洗3次; 酶标聚合物孵育30 min, 1×PBS洗3次; DAB染色、复染、脱水、透明、封片. 相同含量无关免疫球蛋白替代一抗, 作为阴性对照. 上述方法参见EliVisionTM plus试剂盒说明书操作. 结果判断: 高倍镜下, 胞质出现黄色颗粒判断为阳性, 如无明显变化则视为阴性.
1.2.3 总蛋白的提取: 使用直径10 cm的培养皿培养细胞, 待细胞数达到约107时备用. 使用4 ℃预冷的1×PBS洗2次, 在培养皿中加入预冷的细胞裂解液0.7 mL, 用细胞刮子迅速刮下细胞并收集至2 mL离心管中, 冰上超声, 4 ℃离心, 12 000 g 15 min, 收集上清分装. 上清中吸出20 μL, 用Bradford法进行蛋白定量.
1.2.4 Western blot方法检测c-IAP1和Smac: 提取的细胞系总蛋白经15% SDS-PAGE电泳, 用湿转法将蛋白质转移至PVDF膜, 10%脱脂奶粉室温封闭3 h, 然后与1:200比例稀释的c-IAP1抗体室温孵育3 h或4 ℃过夜, 再与辣根过氧化物酶(HRP)标记二抗孵育1 h后, ECL化学发光作用3 min后曝光、显影和定影(所有实验均重复至少3次以上).
1.2.5 细胞转染: 应用Promega公司质粒提取试剂盒, 大量提取去内毒素重组质粒psilencer_shRNA_smac(具体操作过程见说明书), 并进行DNA定量. 将正常培养的KYSE170细胞用胰酶消化, 1 000 r/min离心, 培养液重悬细胞, 于6孔板中, 每孔加入6×108个/L的等量细胞, 置37 ℃培养, 待细胞生长占培养板底约89%-90%时, 更换无抗生素完全培养液. 采用Invitrogen公司lipofectamine2000转染重组质粒psilencer_shRNA_smac, 转染6 h后更换含10%胎牛血清的完全培养基继续培养24 h. 采用1 mg/L的嘌呤霉素(puromycin)筛选3 wk, 存活的细胞为已转染质粒的细胞.
1.2.6 MTT法检测药物敏感性: KYSE170及Smac敲降的细胞接种于96孔板, 培养24 h后分别加入不同浓度的顺铂(终浓度分别10、20、40、100 μmol/L), 每个浓度孔设4个复孔, 以未加CDDP孔作为对照. 培养24和48 h后, 每孔加入浓度为5 g/L的MTT 20 μL, 孵育4 h, 弃上清, 加入DMSO 200 μL, 振荡混匀, 酶标仪测定570 nm吸光度值(A值). 实验重复3次, 计算肿瘤细胞的抑制率, 细胞抑制率(%) = (1-实验孔A值/对照孔A值)×100%.
统计学处理 数据分析使用SPSS16.0统计软件. 采用行×列表χ2检验进行统计分析, 当P<0.05时认为差异有统计学意义.
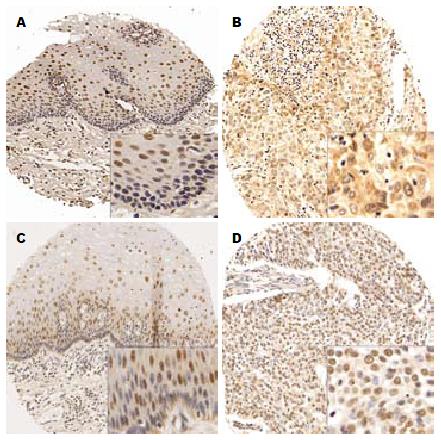
食管鳞癌组织微阵列经c-IAP1免疫组织化学染色, 其中52例食管癌及其配对正常食管上皮有效染色. c-IAP1蛋白在28例正常食管上皮组织中表达阳性, 阳性率为54%(28/52), 其中4%(2/52)为胞质着色; 在35例食管癌组织中表达阳性, 阳性率为67%(35/52), 其中46%(24/52)呈胞质阳性着色. c-IAP1在食管癌和癌旁食管上皮中位于胞质和胞核(图1).
c-IAP1在食管癌细胞质表达显著高于在癌旁食管上皮胞质的表达, 具有统计学意义[46%(24/52) vs 4%(2/52), P<0.001], c-IAP1在食管癌组织胞质中表达显著升高. 而总的c-IAP1表达和胞核内的c-IAP1表达在食管癌与癌旁组织之间无显著差异(P = 0.16); c-IAP1在表达与性别、年龄及食管癌组织病理分级无关(均P>0.05, 表1).
| 临床参考 | n = 52 | c-IAP1 n(%) | P值 | |
| 阳性 | 阴性 | |||
| 性别 | ||||
| 男 | 31 | 13(54.2) | 18(64.3) | |
| 女 | 21 | 11(45.8) | 10(35.7) | 0.573 |
| 年龄(岁) | ||||
| ≥60 | 28 | 16(66.7) | 12(42.9) | |
| <60 | 24 | 8(33.3) | 16(57.1) | 0.102 |
| 分化 | ||||
| 高分化 | 16 | 6(25.0) | 10(35.7) | |
| 中分化 | 24 | 11(45.8) | 13(46.4) | |
| 低分化 | 12 | 7(29.2) | 5(17.9) | 0.549 |
| 组织(胞质+细胞核) | ||||
| 食管癌 | 52 | 35(67.0) | 17(37.0) | |
| 正常食管上皮 | 52 | 28(54.0) | 24(46.0) | 0.160 |
| 细胞质表达 | ||||
| 食管癌 | 52 | 24(46.0) | 28(54.0) | |
| 正常 | 52 | 2(4.0) | 50(96.0) | <0.001 |
| 细胞核 | ||||
| 食管癌 | 52 | 27(50.0) | 25(50.0) | |
| 正常 | 52 | 29(56.0) | 23(46.0) | 0.694 |
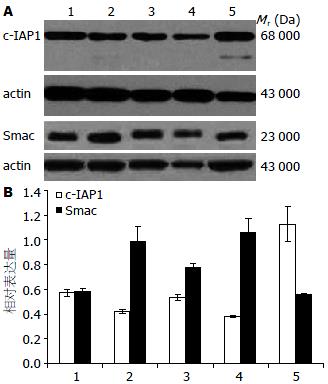
c-IAP1蛋白在EC0156、KYSE510、KYSE30、KYSE180和KYSE170等食管癌细胞中均表达, 呈现相对分子质量为68 000 Da蛋白条带; Smac蛋白也在上述5种食管癌细胞中表达, 呈现相对分子质量为23 000 Da的蛋白条带(图2).
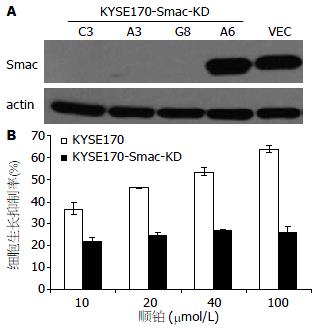
食管癌细胞KYSE170转染psilencer_shRNA_smac质粒和空载体对照质粒后, 经多轮筛选分离鉴定Smac敲低表型的细胞克隆KYSE170-Smac-KD C3、A3和G8和Smac稳定表达细胞KYSE170-Smac-KD A6. Western blot结果显示, 与Smac稳定表达细胞KYSE170-Smac-KD A6相比, Smac敲低细胞KYSE170-Smac-KD C3、A3和G8中Smac蛋白表达显著降低(图3A).
Smac敲降细胞KYSE170-Smac-KD G8和KYSE170对照细胞分别经10、20、40和100 μmol/L等不同浓度化疗药物顺铂作用24 h后, 用MTT法对比细胞对化疗药物的敏感性. 结果显示, Smac敲低细胞KYSE170-Smac-KD G8对顺伯的敏感性降低, 显著增加了细胞对化疗药物的耐药性(图3B).
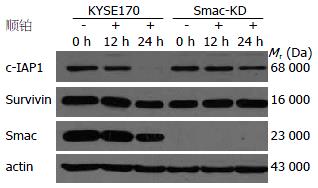
食管癌细胞KYSE170和Smac敲降细胞KYSE170-Smac-KD G8分别经20 μmol/L顺铂作用12和24 h后, 比较凋亡相关分子c-IAP1、Survivin和Smac的表达改变. 结果显示, KYSE170细胞经顺铂作用24 h后, c-IAP1蛋白表达显著降低, Smac和Survivin蛋白表达部分降低. Smac敲降细胞KYSE170-Smac-KD G8, Smac蛋白几乎不表达, 经顺铂作用24 h后, 凋亡抑制蛋白c-IAP1和Survivin蛋白表达降低不明显(图4).
细胞凋亡紊乱与肿瘤的发生发展及对化疗药物的耐药性密切相关, 常伴随凋亡抑制分子的表达改变. 研究发现, 在IAPs家族蛋白成员中, c-IAP N端包含3个杆状病毒IAP重复序列(baculoviral IAP repeat, BIR), C端包含或不包含一个指环结构, 而caspase活化募集结构域(caspase activation and recruitment domain, CARD)位于BIR与指环结构域之间的一段序列, 由6个螺旋构成的结构域, 介导蛋白和蛋白相互作用. c-IAP1通过CARD结构域与包含此结构域的蛋白形成寡聚体; 通过BIR结构域与caspase3、7、9结合抑制caspase酶活性, 调节细胞凋亡; 通过指环结构发挥泛素连接酶E3的功能, 调节NF-κB的作用, 促进细胞存活[5,11,12]. 在凋亡过程中, c-IAP1/2蛋白可被裂解生成N端和C端的两个片断, C端片段包含CARD和指环结构域, 具有促凋亡的作用. c-IAP1可调控含有指环结构的c-IAP1、c-IAP2、XIAP和Livin等其他IAP家族蛋白, 经泛素-蛋白酶体降解, 而不影响缺乏指环结构的NAIP和Survivin蛋白表达[13]. Nemoto等[14]采用定量RT-PCR分析了34例食管癌组织及正常黏膜中c-IAP1、c-IAP2、NAIP和XIAP的表达, 发现这些凋亡相关分子在肿瘤组织中表达增高. 低分化食管癌与高分化食管癌相比, c-IAP1表达增高. 凋亡细胞比例与Survivin表达呈负相关. Tanimoto等[15]采用免疫组织化学方法在57例舌鳞癌组织标本和4株细胞系中, 分析了c-IAP1、caspase3和Smac蛋白表达与头颈癌临床病理参数的相关性. 结果显示核型的c-IAP1表达阳性率为30%, 与淋巴结转移相关和晚期疾病相关. Lopes等[16]研究了19例胰腺癌细胞系IAP蛋白的表达, 在胰腺癌中IAP家族蛋白高表达. 敲低IAP, 增敏细胞对化疗药物效应. Gordon等[17]分析了9个恶性间皮瘤细胞, 40例恶性间皮瘤RNA芯片和66例组织芯片中, IAP家族蛋白的表达. 结果显示c-IAP1和Survivin的表达与患者短的生存期相关, 除了c-IAP1和Survivin在恶性间皮瘤的核内表达, 其他IAP家族蛋白在胞质表达. 本文在食管癌组织微阵列上应用免疫组织化学染色分析c-IAP1表达, 结果显示c-IAP1在食管癌组织中表达阳性率为67%(35/52), 其中胞质阳性率为46%(24/52); 而在正常食管上皮组织中c-IAP1阳性率为54%(28/52), 其中胞质阳性率为4%(2/52). 胞质和细胞核的总c-IAP1蛋白表达在食管癌组织与癌旁之间无显著差异(P = 0.16); 而c-IAP1在肿瘤组织胞质中的表达显著高于癌旁食管上皮, 具有显著的统计学意义(P<0.001), 提示c-IAP1在食管癌组织胞质中表达显著升高, 可能与食管癌的发生发展密切相关.
为进一步研究人类c-IAP1抑制细胞凋亡及与内源拮抗分子Smac相互作用对细胞凋亡的影响并探讨其可能的机制, 我们进一步在食管癌细胞系水平分析了c-IAP1和Smac蛋白的表达, 结果显示c-IAP1和Smac分子在多个食管癌细胞株中广泛表达. Smac基因编码一种由线粒体释放的促凋亡蛋白, 是参与细胞凋亡线粒体内源通路二级反应蛋白, 促进细胞凋亡. Smac蛋白是由细胞核编码的线粒体蛋白, 通过线粒体定位信号介导进入线粒体膜间隙, 经蛋白酶水解形成23 000 Da的成熟蛋白[18]. 当细胞受到外源刺激, Smac蛋白由线粒体释放进入细胞质, 其N末端Ala-Val-Pro-Ile(AVPI)4肽序列结构, 与IAPs家族蛋白的BIR2和BIR3结构形成双价结合, 竞争IAP的BIR结构与caspase相互作用, 释放活化的caspase, 促进细胞凋亡. 我们前期的研究结果提示Smac蛋白在食管癌组织中表达下调, 因此, 在高表达c-IAP1的KYSE170细胞中, 利用RNA干扰技术, 敲低Smac基因并筛选KYSE170-Smac-KD细胞克隆. 细胞经化疗药物处理, 采用MTT法分析Smac敲降, c-IAP1高表达对细胞化疗敏感性的影响. 实验结果显示, 在高表达c-IAP1蛋白的KYSE170细胞中完全敲降Smac显著增加了细胞对化疗药物顺铂的耐药性. 同时, 免疫印迹结果显示细胞经顺铂处理24 h可诱导KYSE170细胞c-IAP1蛋白降解及Survivin的部分降解, 而在Smac敲降的KYSE170细胞中, 经顺铂处理24 h未见c-IAP1蛋白显著降解. 结果提示Smac通过介导c-IAP1蛋白的降解, 促进细胞凋亡.
研究表明, c-IAP1除了通过直接抑制caspase酶活性, 还可通过其RING结构域调控TNF-α介导的NF-κB通路活性. c-IAP1可与TNF-α受体相关因子2(TNF-α receptor associated factor 2, TRAF2)结合, 通过TGF-β活化激酶1(TGF-beta activated kinase 1, TAK1)信号途径激活NF-κB经典途径. 当细胞受到TNF-α刺激, TNF-α与TNF-R1结合, c-IAP1/2和受体相互作用蛋白1(receptor-interacting protein, RIP1)被迅速募集到TNF-R1上, c-IAP1/2蛋白可作为E3泛素连接酶, 靶向RIP通过K63位点进行多聚泛素化, 进一步募集TAK1和TAK1结合蛋白(TAK1 binding protein, TAB), 形成一个大的蛋白激酶复合体磷酸化IκB激酶, 催化IκB磷酸化与降解, 释放并活化NF-κB因子, 促进细胞存活. RIP的多聚泛素化依赖c-IAP1/2的E3连接酶活性[2,19,20]. 近年来人们设计了Smac N端4肽模拟物, 靶向c-IAP1和c-IAP2的小分子拮抗剂, 有效地介导XIAP和c-IAP1在细胞内的降解, 促进了细胞凋亡[21-24]. Checinska等[25]运用Smac模拟物联合化疗药物作用于非小细胞肺癌细胞, 显著促进了顺铂诱导的细胞凋亡. Smac小分子模拟物促进caspase3活化, 介导肿瘤细胞凋亡. 基于此, 我们推测肿瘤细胞经化疗药刺激后, 胞质线粒体释放的Smac蛋白介导了c-IAP1蛋白的降解, 阻断了c-IAP1蛋白对caspase酶的活化, 同时抑制了NK-κB通路的活化, 促进了细胞凋亡. 在食管癌肿瘤组织中, 相对c-IAP1在食管癌组织中胞质的高表达, Smac蛋白在食管癌组织中下调表达, c-IAP1蛋白与内源拮抗蛋白Smac的反向差异表达, 提示可能与食管癌的化疗敏感性密切相关.
本文发现c-IAP1在食管癌细胞中广泛表达, 组织芯片结果表明食管癌组织中c-IAP1定位细胞质和细胞核, 在肿瘤组织胞质中的表达显著高于癌旁食管上皮表达c-IAP1, 与文献报道的其他恶性肿瘤中c-IAP1阳性表达率升高的结果一致, 提示c-IAP1在食管癌细胞的发生发展中发挥重要作用. 高表达c-IAP1食管癌细胞KYSE170, 通过敲降Smac基因, 显著增强了食管癌细胞对化疗药物的耐药性, 提示拮抗分子Smac与c-IAP1及相互作用介导了c-IAP1分子降解, 促进细胞凋亡. 在食管癌肿瘤组织中, c-IAP1蛋白与内源拮抗蛋白Smac的反向差异表达, 提示可能与食管癌的化疗敏感性密切相关.
细胞凋亡抑制蛋白1(c-IAP1)是一种细胞凋亡抑制因子, 主要通过抑制caspase3、7、9等酶活性和参与调节NF-κB的作用而抑制细胞凋亡. c-IAP1在多种恶性肿瘤的发生发展过程中发挥了重要作用, 而在我国常见恶性肿瘤食管癌中鲜见报道.
刘萱, 副主任医师, 首都医科大学附属北京友谊医院消化科; 李刚, 教授, 北京大学医学部生物化学与分子生物学系
c-IAP1即通过抑制caspase酶活性调节细胞凋亡, 又通过泛素连接酶E3活性而调节核因子NF-κB的作用, 促进细胞存活. 目前对c-IAP1的研究主要集中在探讨c-IAP1在恶性肿瘤发生发展过程的作用机制, 涉及c-IAP1在恶性肿瘤中的表达改变和功能变化、c-IAP1对抗肿瘤药物作用的影响, 以及研制模拟c-IAP1作用的小分子靶向药物等方面.
Tanimoto等采用免疫组织化学方法在57例舌鳞癌组织标本和4株细胞系中, 分析了c-IAP1、caspase3和Smac蛋白表达与头颈癌临床病理参数的相关性. 结果显示核型的c-IAP1表达阳性率为30%, 与淋巴结转移相关和晚期疾病相关.
本文探讨了c-IAP1蛋白在人食管鳞癌细胞和组织中表达升高, 化疗药物处理肿瘤细胞后, 由Smac蛋白介导c-IAP1降解, 从而增加了食管癌细胞对化疗药物的敏感性, c-IAP1在调控食管癌化疗敏感性中发挥重要作用.
本研究提示, 胞质c-IAP1表达水平与食管癌细胞对DNA损伤类化疗药物的敏感性密切相关, c-IAP1有可能作为了解食管癌化疗敏感性的潜在分子标志.
本文选题较好, 设计合理, 对食管癌的治疗奠定了实验基础.
编辑: 李军亮 电编:何基才
| 1. | Wang L, Du F, Wang X. TNF-alpha induces two distinct caspase-8 activation pathways. Cell. 2008;133:693-703. [PubMed] [DOI] |
| 2. | Mahoney DJ, Cheung HH, Mrad RL, Plenchette S, Simard C, Enwere E, Arora V, Mak TW, Lacasse EC, Waring J. Both cIAP1 and cIAP2 regulate TNFalpha-mediated NF-kappaB activation. Proc Natl Acad Sci U S A. 2008;105:11778-11783. [PubMed] [DOI] |
| 3. | Roy N, Mahadevan MS, McLean M, Shutler G, Yaraghi Z, Farahani R, Baird S, Besner-Johnston A, Lefebvre C, Kang X. The gene for neuronal apoptosis inhibitory protein is partially deleted in individuals with spinal muscular atrophy. Cell. 1995;80:167-178. [PubMed] [DOI] |
| 4. | Tamm I, Kornblau SM, Segall H, Krajewski S, Welsh K, Kitada S, Scudiero DA, Tudor G, Qui YH, Monks A. Expression and prognostic significance of IAP-family genes in human cancers and myeloid leukemias. Clin Cancer Res. 2000;6:1796-1803. [PubMed] |
| 5. | Dai Z, Zhu WG, Morrison CD, Brena RM, Smiraglia DJ, Raval A, Wu YZ, Rush LJ, Ross P, Molina JR. A comprehensive search for DNA amplification in lung cancer identifies inhibitors of apoptosis cIAP1 and cIAP2 as candidate oncogenes. Hum Mol Genet. 2003;12:791-801. [PubMed] [DOI] |
| 6. | Psyrri A, Yu Z, Bamias A, Weinberger PM, Markakis S, Kowalski D, Camp RL, Rimm DL, Dimopoulos MA. Evaluation of the prognostic value of cellular inhibitor of apoptosis protein in epithelial ovarian cancer using automated quantitative protein analysis. Cancer Epidemiol Biomarkers Prev. 2006;15:1179-1183. [PubMed] [DOI] |
| 7. | Kempkensteffen C, Hinz S, Christoph F, Köllermann J, Krause H, Schrader M, Schostak M, Miller K, Weikert S. Expression parameters of the inhibitors of apoptosis cIAP1 and cIAP2 in renal cell carcinomas and their prognostic relevance. Int J Cancer. 2007;120:1081-1086. [PubMed] [DOI] |
| 8. | Liao Y, Zeng H, Wang X, Huang Y, Chen N, Ge B, Tang L, Luo Q. Expression patterns and prognostic significance of inhibitor of apoptosis proteins in adenoid cystic carcinoma and pleomorphic adenoma of lachrymal gland. Exp Eye Res. 2009;88:4-11. [PubMed] [DOI] |
| 9. | Grzybowska-Izydorczyk O, Cebula B, Robak T, Smolewski P. Expression and prognostic significance of the inhibitor of apoptosis protein (IAP) family and its antagonists in chronic lymphocytic leukaemia. Eur J Cancer. 2010;46:800-810. [PubMed] [DOI] |
| 10. | Wang Q, Xu Y, Zhao X, Chang Y, Liu Y, Jiang L, Sharma J, Seo DK, Yan H. A facile one-step in situ functionalization of quantum dots with preserved photoluminescence for bioconjugation. J Am Chem Soc. 2007;129:6380-6381. [PubMed] [DOI] |
| 11. | Bertrand MJ, Milutinovic S, Dickson KM, Ho WC, Boudreault A, Durkin J, Gillard JW, Jaquith JB, Morris SJ, Barker PA. cIAP1 and cIAP2 facilitate cancer cell survival by functioning as E3 ligases that promote RIP1 ubiquitination. Mol Cell. 2008;30:689-700. [PubMed] [DOI] |
| 12. | Burke SP, Smith L, Smith JB. cIAP1 cooperatively inhibits procaspase-3 activation by the caspase-9 apoptosome. J Biol Chem. 2010;285:30061-30068. [PubMed] [DOI] |
| 13. | Cheung HH, Plenchette S, Kern CJ, Mahoney DJ, Korneluk RG. The RING domain of cIAP1 mediates the degradation of RING-bearing inhibitor of apoptosis proteins by distinct pathways. Mol Biol Cell. 2008;19:2729-2740. [PubMed] [DOI] |
| 14. | Nemoto T, Kitagawa M, Hasegawa M, Ikeda S, Akashi T, Takizawa T, Hirokawa K, Koike M. Expression of IAP family proteins in esophageal cancer. Exp Mol Pathol. 2004;76:253-259. [PubMed] [DOI] |
| 15. | Tanimoto T, Tsuda H, Imazeki N, Ohno Y, Imoto I, Inazawa J, Matsubara O. Nuclear expression of cIAP-1, an apoptosis inhibiting protein, predicts lymph node metastasis and poor patient prognosis in head and neck squamous cell carcinomas. Cancer Lett. 2005;224:141-151. [PubMed] |
| 16. | Lopes RB, Gangeswaran R, McNeish IA, Wang Y, Lemoine NR. Expression of the IAP protein family is dysregulated in pancreatic cancer cells and is important for resistance to chemotherapy. Int J Cancer. 2007;120:2344-2352. [PubMed] [DOI] |
| 17. | Gordon GJ, Mani M, Mukhopadhyay L, Dong L, Edenfield HR, Glickman JN, Yeap BY, Sugarbaker DJ, Bueno R. Expression patterns of inhibitor of apoptosis proteins in malignant pleural mesothelioma. J Pathol. 2007;211:447-454. [PubMed] [DOI] |
| 18. | Du C, Fang M, Li Y, Li L, Wang X. Smac, a mitochondrial protein that promotes cytochrome c-dependent caspase activation by eliminating IAP inhibition. Cell. 2000;102:33-42. [PubMed] [DOI] |
| 19. | Vanlangenakker N, Vanden Berghe T, Bogaert P, Laukens B, Zobel K, Deshayes K, Vucic D, Fulda S, Vandenabeele P, Bertrand MJ. cIAP1 and TAK1 protect cells from TNF-induced necrosis by preventing RIP1/RIP3-dependent reactive oxygen species production. Cell Death Differ. 2011;18:656-665. [PubMed] [DOI] |
| 20. | Vince JE, Pantaki D, Feltham R, Mace PD, Cordier SM, Schmukle AC, Davidson AJ, Callus BA, Wong WW, Gentle IE. TRAF2 must bind to cellular inhibitors of apoptosis for tumor necrosis factor (tnf) to efficiently activate nf-{kappa}b and to prevent tnf-induced apoptosis. J Biol Chem. 2009;284:35906-35915. [PubMed] [DOI] |
| 21. | Sasaki Y, Minamizawa M, Ambo A, Sugawara S, Ogawa Y, Nitta K. Cell-penetrating peptide-conjugated XIAP-inhibitory cyclic hexapeptides enter into Jurkat cells and inhibit cell proliferation. FEBS J. 2008;275:6011-6021. [PubMed] [DOI] |
| 22. | Cossu F, Mastrangelo E, Milani M, Sorrentino G, Lecis D, Delia D, Manzoni L, Seneci P, Scolastico C, Bolognesi M. Designing Smac-mimetics as antagonists of XIAP, cIAP1, and cIAP2. Biochem Biophys Res Commun. 2009;378:162-167. [PubMed] [DOI] |
| 23. | Vince JE, Wong WW, Khan N, Feltham R, Chau D, Ahmed AU, Benetatos CA, Chunduru SK, Condon SM, McKinlay M. IAP antagonists target cIAP1 to induce TNFalpha-dependent apoptosis. Cell. 2007;131:682-693. [PubMed] [DOI] |
| 24. | Varfolomeev E, Blankenship JW, Wayson SM, Fedorova AV, Kayagaki N, Garg P, Zobel K, Dynek JN, Elliott LO, Wallweber HJ. IAP antagonists induce autoubiquitination of c-IAPs, NF-kappaB activation, and TNFalpha-dependent apoptosis. Cell. 2007;131:669-681. [PubMed] [DOI] |
| 25. | Checinska A, Hoogeland BS, Rodriguez JA, Giaccone G, Kruyt FA. Role of XIAP in inhibiting cisplatin-induced caspase activation in non-small cell lung cancer cells: a small molecule Smac mimic sensitizes for chemotherapy-induced apoptosis by enhancing caspase-3 activation. Exp Cell Res. 2007;313:1215-1224. [PubMed] [DOI] |