修回日期: 2011-02-18
接受日期: 2011-03-08
在线出版日期: 2011-04-18
目的: 研究蛋氨酸-胆碱缺乏(MCD)饮食诱导的非酒精性脂肪性肝炎(NASH)小鼠肝脏脂肪变性及炎症发生、发展的病理特点.
方法: 将40只C57/BL6小鼠随机分成2组, 分别喂养MCD饮食(模型组)和对照蛋氨酸-胆碱充足(MCS)饮食(空白组), 于造模的第1-5周动态连续取材, 小鼠血清ALT、AST、TG及肝TG等生化指标通过全自动生化分析仪进行测定, 肝脏标本通过油红O、HE染色对脂肪变性及炎症进行评分.
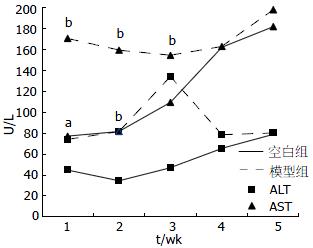
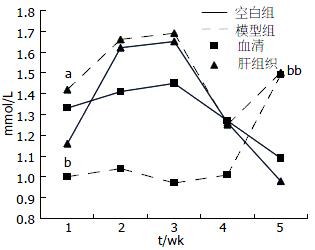
结果: MCD饮食喂养2-3 wk后, 肝脏病理切片可见脂肪变及炎症, 小鼠血清ALT(U/L)、AST(U/L)明显升高, 与空白组相比有统计学差异(133.9±6.3 vs 47.3±1.3; 154.3±24.6 vs 109.2±50.4, 均P<0.05). 在第3周时, 模型组血清TG(mmol/L)含量较空白组明显降低(0.97±0.14 vs 1.45±0.32, P<0.01), 而在第5周时, 模型组肝TG(mmol/L)含量较空白组明显升高(1.50±0.22 vs 0.98±0.16, P<0.01). 肝脏炎症坏死以腺泡1区为主为重, 5 wk时肝内纤维化表现开始出现.
结论: MCD饮食诱导的NASH小鼠模型重复率高, 造模2-3 wk时模型稳定性最好.
引文著录: 苏冬梅, 诸葛丽, 李健, 杨美娟, 刘云霞, 李军祥. 蛋氨酸-胆碱缺乏饮食诱导的非酒精性脂肪性肝炎小鼠模型的建立及动态监测. 世界华人消化杂志 2011; 19(11): 1122-1129
Revised: February 18, 2011
Accepted: March 8, 2011
Published online: April 18, 2011
AIM: To establish a mouse model of non-alcoholic steatohepatitis (NASH) by feeding a methionine-choline-deficient (MCD) diet and to dynamically monitor the pathological features of hepatic steatosis and inflammation in these mice.
METHODS: Forty mice were randomly divided into two groups and fed an MCD diet or a methionine-choline-sufficient (MCS) diet. At weeks 1 to 5, these mice were sacrificed to take serum samples for biochemical measurements and liver samples for HE staining and oil red O staining to grade the degree of fatty change and inflammation.
RESULTS: Steatosis and inflammation could be seen in mice fed an MCD diet for 2-3 wk. Serum ALT (U/L), AST (U/L) levels increased significantly (133.9 ± 6.3 vs 47.3 ± 1.3; 154.3 ± 24.6 vs 109.2 ± 50.4, both P < 0.05), whereas TG (mmol/L) levels decreased (0.97 ± 0.14 vs 1.45 ± 0.32, P < 0.01) at week 3 in rats fed an MCD diet than in those fed an MCS diet. At wk 5, TG (mmol/L) levels in the liver increased significantly in rats fed an MCD diet than in controls (1.50 ± 0.22 vs 0.98 ± 0.16, P < 0.01). Fibrosis could be seen at week 5 in mice fed an MCD diet.
CONCLUSION: A mouse model of NASH has been created successfully by feeding an MCD diet.
- Citation: Su DM, Zhuge L, Li J, Yang MJ, Liu YX, Li JX. A mouse model of non-alcoholic steatohepatitis induced by feeding a methionine-choline-deficient diet: establishment and dynamic monitoring. Shijie Huaren Xiaohua Zazhi 2011; 19(11): 1122-1129
- URL: https://www.wjgnet.com/1009-3079/full/v19/i11/1122.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i11.1122
如今, 非酒精性脂肪性肝病(non-alcoholic fatty liver disease, NAFLD)已成为临床常见的肝脏疾病之一, 其中非酒精性脂肪性肝炎(non-alcoholic steatohepatitis, NASH)是非酒精性脂肪肝(non-alcoholic fatty liver, NAFL)向非酒精性脂肪性肝硬化转化过程中一个非常重要的环节, 是隐源性肝硬化的重要原因之一[1]. 研究表明, NASH的预后不佳, 约50%的NASH患者随访6年后可进展成肝纤维化, 10%-15%在10-20年内可进展成肝硬化, 而9%-26%在随访的4-10年内可因终末期肝病死亡[2-7]. 因此, 研究NASH的防治策略是目前国内外肝病界的热点之一. NASH的发病机制至今尚不完全清楚, 需要通过大量的动物实验开展深入的研究. 然而, 目前国内外的NASH动物模型杂乱不一, 缺少统一的标准, 在一定程度上限制了NASH病理机制及治疗药物的深入研究.
理论上, 理想的动物模型不仅能再现人类疾病的病理改变, 且能显示疾病的发生和发展规律. 目前国内外常用的NASH动物模型主要包括3类[8,9]: (1)基因敲除或基因突变模型; (2)营养、药物或毒物诱发模型; (3)复合模型(联合应用基因模型和营养模型). 其中蛋氨酸-胆碱缺乏(methionine-choline-deficient, MCD)饮食诱发的NASH模型是国际上被广泛认可的动物模型, 操作简便, 成模率高, 成为研究NASH发病机制及防治药物的主要动物模型. 但已有的MCD饮食诱导NASH动物模型的研究, 缺少对整个造模过程动物血清学及病理学改变的动态观察数据. 为此, 本研究通过动态取材, 监测了MCD饮食饲喂的NASH小鼠血清生化指标及肝组织病理的变化规律, 对NASH发生、发展的轮廓做了系统研究.
MCD配方[10](L-氨基酸175.7 g/kg、蔗糖441.9 g/kg、玉蜀黍淀粉150.0 g/kg、右旋麦芽糖50.0 g/kg、纤维素30.0 g/kg、玉米油100.0 g/kg、碳酸氢钠7.4 g/kg、盐混合物35.0 g/kg、维生素混合物10.0 g/kg)、蛋氨酸-胆碱充足(methionine-choline-sufficient, MCS)对照饮食MCS配方是MCD饮食配方, 加上胆碱2 g/kg、蛋氨酸3 g/kg. MCD及MCS饲料均由江苏南通特洛菲饲料有限公司加工制作, 为清洁级饲料, 4 ℃低温保存[11]. 本实验选用8-12周龄C57/BL6♂小鼠, 体质量20 g±2 g(北京维通利华实验动物技术有限公司提供). 实验动物常规饲养于北京中医药大学清洁级动物房, 12 h光照和黑夜循环, 温度22 ℃±2 ℃, 湿度50%-60%. ALT、AST、TG检测试剂购于南京建成生物公司; 油红O及HE染色相关试剂购自美国Sigma公司; 血清及肝组织匀浆生化指标的测定采用全自动生化分析仪(北京华英测试公司提供)
1.2.1 分组及处置: 40只小鼠予普通饲料适应性饲喂1 wk后随机分成2组, 其中空白组20只, 饲喂MCS饮食; 模型组20只, 饲喂MCD饮食, 自由摄食、饮水. 每周计量动物体质量1次, 每天观察动物进食、饮水、行为、活动、精神状态、毛发及二便等情况; 于造模1、2、3、4及5 wk时分别随机抽取3只动物, 禁食/水12 h后, 称质量、麻醉、摘眼球取血; 肝脏称质量后部分液氮冻存, 部分4%多聚甲醛固定.
1.2.2 血清及肝组织ALT、AST、TG含量测定: 小鼠血清ALT、AST、TG采用全自动生化分析仪进行测定; 精确称取肝组织0.5 g, 采用超声匀浆机制成匀浆(冰水中进行), 取1%肝匀浆, 离心后取上清测定肝脏TG含量, 试剂盒及仪器均由北京华英测试中心提供.
1.2.3 肝组织病理学检测: 小鼠肝组织冰冻切片, 行常规油红O染色; 肝组织石蜡切片, 行常规HE染色. 油红O及HE切片光镜下评估肝脏脂肪变性和炎症活动情况. NASH的病理诊断标准采用"亚太地区非酒精性脂肪性肝病诊断与治疗共识"推荐的美国国立卫生研究院NASH临床研究网络病理委员会2005年所定指南[12], 根据其制定的NAFLD活动度积分(NAFLD activity score, NAS)进行评估. NAS组织学评分系统对14项病理改变, 3项指标进行了半定量评估计分: 肝脂肪变(按发生脂肪变性实质细胞/总细胞数, <5%、5%-33%、33%-66%、>66%, 分别计0-3分)、小叶内炎症(按无病灶、<2、2-4、>4, 分别计0-3分)、肝细胞气球样变(按无、少量气球样细胞、较多/显著气球样变, 分别计0-2分), 其中NAS≥5分者可明确NASH的诊断, NAS<3分则可排除NASH, 两者之间者为NASH可能. 油红O及HE切片使用Olympus摄像系统进行观察和摄片.
统计学处理 计数资料用mean±SD表示, 两组之间采用重复测量方差分析进行统计分析, 统计学显著性用双侧检验P<0.05, 统计软件采用SPSS17.0.
各组小鼠均无死亡, 与空白组相比, 模型组的毛发紊乱、无光泽, 体质量明显减轻, 活动减弱, 精神萎靡. 各检测点模型组小鼠的体质量均低于空白组(1 wk: P = 0.058; 2 wk: P = 0.025; 3-5 wk: P = 0.0009), 随着造模时间延长, 小鼠体质量呈下降趋势; 3 wk和5 wk时, 模型组小鼠肝指数明显高于空白组(表1).
与空白组相比, 模型组小鼠的血清ALT、AST均升高(表2, 图1). 随着造模时间的延长, ALT呈先升高后降低趋势, 在3 wk时达高峰; 而AST则呈先降低后升高趋势, 在3 wk时达低谷. 血脂方面, 与空白组相比, 模型组小鼠血清TG含量降低, 而肝TG含量升高, 其中1 wk和5 wk时两组间差异显著(均P<0.05, 表3, 图2).
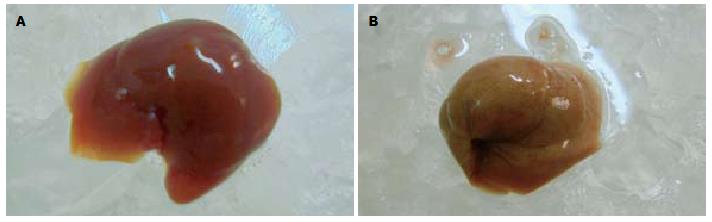
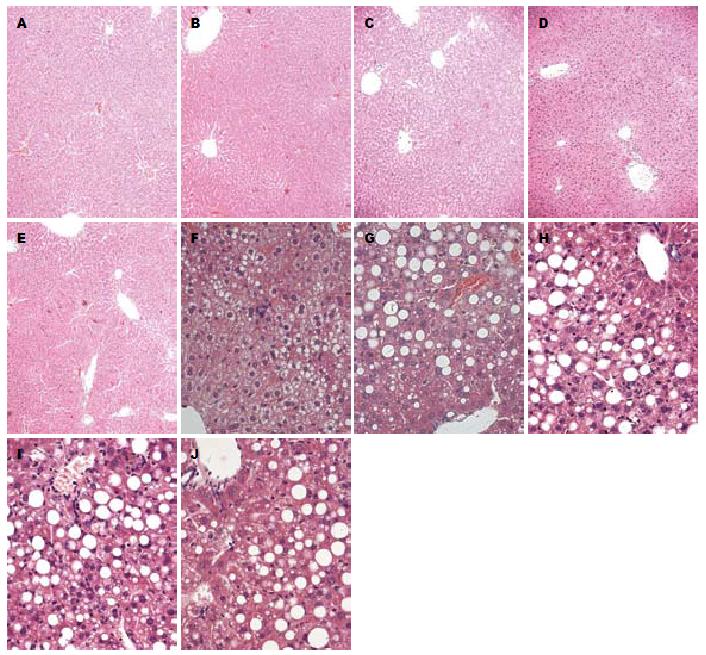
各检测点空白组小鼠肝脏外观表现无肿胀增大, 呈深红色, 有光泽, 质软, 边缘锐利, 密度正常(图3A), 而模型组小鼠肝脏则逐渐肿胀增大, 色泽由土黄色变为暗黄色, 边缘钝, 时可见黄色脂肪斑, 标本漂浮于中性甲醛液面上(密度降低)(图3B).
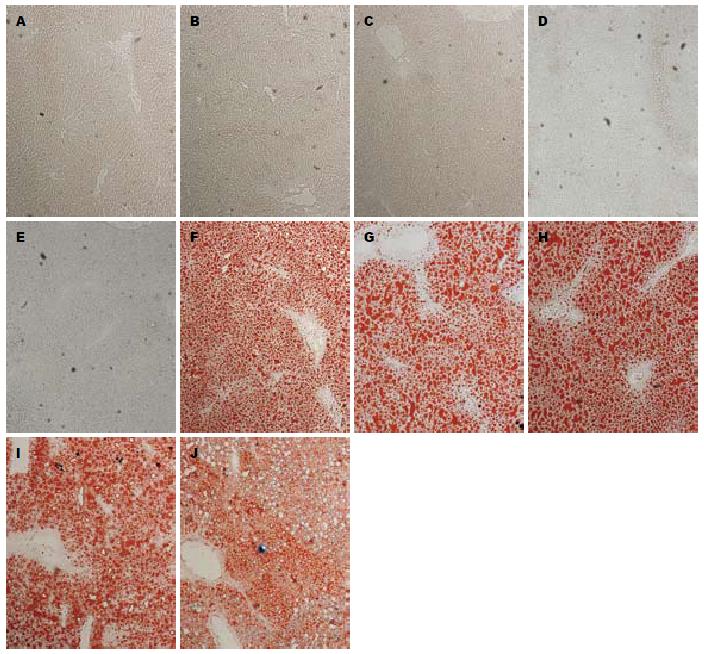
油红O染色结果显示: 各检测点空白组小鼠肝组织未见红色脂滴; 而模型组小鼠肝组织于造模1 wk即可见红色脂滴, 表现为脂滴弥漫浸润入肝细胞中, 肝小叶内含脂滴细胞数/总细胞数约为25%-35%; 随着造模时间的延长, 肝小叶内脂滴逐渐融合成片, 且脂滴细胞所占的比例越来越大, 2-3 wk时脂滴细胞数所占比例最大约为60-70%; 4-5 wk时脂滴细胞数所占比例有所减低约为50-60%(图4).
HE染色结果显示: 各检测点空白组小鼠肝组织形态结构均正常; 模型组小鼠肝组织于造模1 wk时即出现脂肪变, 表现为肝细胞肿胀呈圆形, 体积较正常明显增加, 胞质内可见脂肪空泡, 其中汇管区和小叶内可见少量炎性细胞浸润, 并随着造模时间的延长而加重; 2-3 wk时肝细胞内充满大量脂肪空泡, 肝细胞呈气球样变, 炎性细胞浸润明显, 呈灶状分布; 4-5 wk时肝小叶内脂肪空泡、肝细胞气球样变、炎性细胞灶性浸润并存, 并逐渐出现肝纤维化表现; 其中肝细胞损害主要集中在腺泡1区, 炎性细胞以淋巴细胞为主(图5).
NAS组织学病理评分结果显示: 模型组小鼠于造模2 wk时NAS评分为6.67±0.58, 表明2 wk时模型成立(表4).
| 检测点 | 脂肪变 | 炎症 | 气球样变 | 总分 |
| 1 wk | 1.00±0.00 | 1.40±0.55 | 1.00±0.00 | 3.40±0.55 |
| 2 wk | 2.67±0.58 | 2.00±0.00 | 2.00±0.00 | 6.67±0.58 |
| 3 wk | 3.00±0.00 | 2.33±0.58 | 2.00±0.00 | 7.33±0.58 |
| 4 wk | 2.00±0.00 | 2.33±0.58 | 2.00±0.00 | 6.33±0.58 |
| 5 wk | 2.00±0.00 | 2.67±0.58 | 2.00±0.00 | 6.67±0.58 |
MCD饮食诱导脂肪性肝炎模型最初由Shinozuka提出, 该模型脂肪性肝炎发展速度较快, 3 wk左右可见明显的脂肪性肝炎病变, 8 wk可见肝纤维化, 其引起的病理病变与人类的NASH类似[13]. 其发病机制与蛋氨酸、胆碱缺乏导致线粒体β-氧化功能障碍和极低密度脂蛋白(very low density lipoprotein, VLDL)合成障碍有关[8,14], 贯穿了NASH疾病发病机制的两次打击学说, 成为国际公认的、经典的NASH饮食诱导动物模型. 目前, 国际上对本动物模型的研究较多, 国内也逐渐开展中, 如钱晓武等[15]运用改良MCD配方饲喂大鼠NASH模型, 但对于该模型造模过程的动态监测研究未见报道. 故本研究以动态监测该动物模型整个造模过程中小鼠血清学及病理学的变化为目的, 对MCD饮食饲喂小鼠模型的可重复性及稳定性进行了探讨.
蛋氨酸和胆碱是肝细胞卵磷脂生物合成的必需前体物质, 是VLDL合成和分泌的重要基底物质, 当蛋氨酸胆碱缺乏时, VLDL的合成和分泌受损[16,17]. 而VLDL是运输内源性TG出肝细胞的主要形式, 从而使TG在肝细胞内积聚迅速沉积, 导致肝细胞脂肪变性. 由于肝细胞的脂肪变性, 线粒体对游离脂肪酸(free fatty acid, FFA)的摄入减少了, 促使FFA的β-氧化增加, 导致活性氧自由基的合成和脂质过氧化反应; 另一方面, 胆碱蛋氨酸的缺乏, 可导致活性甲基减少, 而活性甲基是谷胱甘肽等肝内抗氧化物合成的前体物质, 因而MCD饮食使肝内抗氧化物严重缺乏, 抗氧化防御屏障受损[18-24]. 脂质过氧化反应以及抗氧化屏障的损伤, 可激活ROS系统和氧化应激反应, 从而引起肝细胞的炎症反应和凋亡等, 促进有毒物质的合成并损伤线粒体和肝细胞[25]. 其中肝内脂肪的堆积构成了"第一次打击", 使得肝脏对其他损伤的敏感性增加[26]. 而氧化应激和脂质过氧化是脂肪肝到脂肪性肝炎中"二次打击"的重要病理机制[27].
本研究结果显示: MCD饮食喂养的小鼠2 wk时肝细胞内即可见明显的脂肪浸润及炎症细胞浸润, 肝脏脂肪变性的评分与MCS饮食喂养小鼠有显著差异, NAS>5分; 同时血清ALT、AST升高, TG下降, 而肝内TG含量升高; 且随着造模时间的延长, 模型组小鼠体质量较空白组明显下降, 符合MCD饮食饲喂动物模型的特点[13,23,28,29], 表明本研究NASH模型成立. 本研究动态连续监测结果显示: (1)在造模2-3 wk时, 模型组小鼠血清ALT、AST达到高峰, 但随着造模时间的延长, 以及纤维化的出现, 血清ALT、AST呈逐渐下降趋势, 但仍比空白组高; 造模第2-3 wk时, MCD小鼠血清及病理学等各项指标均相对比较平稳, 处于模型稳定期, 可作为今后临床或者基础研究的切入点和干预时机点; (2)与高脂饮食诱导等其他营养诱导动物模型不同, 本研究MCD小鼠的血清TG含量低, 而肝TG含量高, 也是符合本动物模型造模特点. 本模型为MCD饮食模型, 当蛋氨酸、胆碱缺乏时, VLDL的合成及分泌减少, 肝内TG转运障碍, 从而引起肝内TG的堆积, 而血清TG含量减少, 因此, MCD饮食喂养小鼠血清内TG下降, 而肝内TG含量升高; (3)HE切片显示, 模型组肝内炎症坏死以肝脏腺泡1区为主为重, 而中央静脉周围腺泡3区病变相对轻微, 此结果也与高脂饮食诱导等其他动物模型以腺泡3区炎症坏死为主的表现不同[30-32]. 肝内腺泡区的血液供应是从腺泡1区到3区的, 腺泡1区血供最为丰富, 而腺泡3区的血供差, 一旦肝细胞发生损伤时, 一般以腺泡3区损伤为重为先; 而MCD饮食模型主要是由于饮食中缺少人类必需营养成分-蛋氨酸、胆碱, 当MCD饲料经小鼠肠系膜吸收, 进入肝细胞后, 首先到达肝腺泡1区, 此时, 由于缺乏蛋氨酸胆碱, 肝细胞的营养代谢出现障碍, TG等脂质物质在肝腺泡1区的细胞内堆积, 从而引起脂肪变性、炎症坏死等损伤, 故MCD饮食模型肝损伤以腺泡1区为先为重.
本研究系统动态连续观察了MCD小鼠病理及血清学的变化, 从而了解了MCD小鼠模型重复性、稳定性, 以及NASH疾病发展的基本轮廓, 为今后临床干预提供理想的切入点及时机, 也为今后NASH病理机制的深入研究及防治提供理想稳定的动物模型.
非酒精性脂肪性肝炎(NASH)为目前常见的肝脏疾病之一, 其预后不佳, 可转化为肝纤维化、肝硬化, 而导致肝衰甚至死亡. 目前本病的发病机制尚未明确, 现代医学尚无特效药物治疗. 为了探究本病发病机制, 以更好地防治本病, 大量的动物研究正在开展中.
黄晓东, 主任医师, 武汉市中心医院消化内科
由于NASH发病机制不清, 且无特效的防治药物, 本病已成为目前肝病界的研究热点. 其中, 稳定、成熟、简便的动物模型研究更是成为本病研究的重点. 但目前仍缺乏与人类NASH发病机制相识度高、稳定的高效动物模型.
钱晓武等运用改良MCD配方饲喂大鼠NASH模型, 但对于该模型造模过程的动态监测研究未见报道.
本研究重点在动态监测MCD饮食饲喂NASH动物模型造模过程中血清学及病理学的变化, 以明确该模型的稳定性及本病发生、发展的基本轮廓.
本文为今后NASH的发病机制及防治研究提供理想稳定的动物模型及最佳干预时机.
本文结果明确, 有系统的理论分析和有价值的科学结论, 能较好地反映我国肝病学基础研究的先进水平.
编辑: 李军亮 电编:李薇
| 2. | Adams LA, Sanderson S, Lindor KD, Angulo P. The histological course of nonalcoholic fatty liver disease: a longitudinal study of 103 patients with sequential liver biopsies. J Hepatol. 2005;42:132-138. [PubMed] [DOI] |
| 3. | Angulo P, Keach JC, Batts KP, Lindor KD. Independent predictors of liver fibrosis in patients with nonalcoholic steatohepatitis. Hepatology. 1999;30:1356-1362. [PubMed] [DOI] |
| 4. | Kashi MR, Torres DM, Harrison SA. Current and emerging therapies in nonalcoholic fatty liver disease. Semin Liver Dis. 2008;28:396-406. [PubMed] [DOI] |
| 5. | Hui JM, Kench JG, Chitturi S, Sud A, Farrell GC, Byth K, Hall P, Khan M, George J. Long-term outcomes of cirrhosis in nonalcoholic steatohepatitis compared with hepatitis C. Hepatology. 2003;38:420-427. [PubMed] [DOI] |
| 6. | Hashimoto E, Yatsuji S, Kaneda H, Yoshioka Y, Taniai M, Tokushige K, Shiratori K. The characteristics and natural history of Japanese patients with nonalcoholic fatty liver disease. Hepatol Res. 2005;33:72-76. [PubMed] [DOI] |
| 7. | Sanyal AJ, Banas C, Sargeant C, Luketic VA, Sterling RK, Stravitz RT, Shiffman ML, Heuman D, Coterrell A, Fisher RA. Similarities and differences in outcomes of cirrhosis due to nonalcoholic steatohepatitis and hepatitis C. Hepatology. 2006;43:682-689. [PubMed] [DOI] |
| 8. | London RM, George J. Pathogenesis of NASH: animal models. Clin Liver Dis. 2007;11:55-74, viii. [PubMed] [DOI] |
| 10. | Lee GS, Yan JS, Ng RK, Kakar S, Maher JJ. Polyunsaturated fat in the methionine-choline-deficient diet influences hepatic inflammation but not hepatocellular injury. J Lipid Res. 2007;48:1885-1896. [PubMed] [DOI] |
| 11. | Kirsch R, Clarkson V, Shephard EG, Marais DA, Jaffer MA, Woodburne VE, Kirsch RE, Hall Pde L. Rodent nutritional model of non-alcoholic steatohepatitis: species, strain and sex difference studies. J Gastroenterol Hepatol. 2003;18:1272-1282. [PubMed] [DOI] |
| 12. | Kleiner DE, Brunt EM, Van Natta M, Behling C, Contos MJ, Cummings OW, Ferrell LD, Liu YC, Torbenson MS, Unalp-Arida A. Design and validation of a histological scoring system for nonalcoholic fatty liver disease. Hepatology. 2005;41:1313-1321. [PubMed] [DOI] |
| 13. | Shinozuka H, Lombardi B, Sell S, Iammarino RM. Early histological and functional alterations of ethionine liver carcinogenesis in rats fed a choline-deficient diet. Cancer Res. 1978;38:1092-1098. [PubMed] |
| 14. | Fan JG, Qiao L. Commonly used animal models of non-alcoholic steatohepatitis. Hepatobiliary Pancreat Dis Int. 2009;8:233-240. [PubMed] |
| 15. | 钱 晓武, 范 竹萍, 汪 晓红, 盛 黎, 奚 志峰, 邱 德凯. 改良蛋氨酸胆碱缺乏饮食喂养的非酒精性脂肪性肝炎大鼠模型的建立. 世界华人消化杂志. 2007;15:2983-2989. [DOI] |
| 16. | Vance JE, Vance DE. The role of phosphatidylcholine biosynthesis in the secretion of lipoproteins from hepatocytes. Can J Biochem Cell Biol. 1985;63:870-881. [PubMed] [DOI] |
| 17. | Yao ZM, Vance DE. The active synthesis of phosphatidylcholine is required for very low density lipoprotein secretion from rat hepatocytes. J Biol Chem. 1988;263:2998-3004. [PubMed] |
| 18. | Hensley K, Kotake Y, Sang H, Pye QN, Wallis GL, Kolker LM, Tabatabaie T, Stewart CA, Konishi Y, Nakae D. Dietary choline restriction causes complex I dysfunction and increased H(2)O(2) generation in liver mitochondria. Carcinogenesis. 2000;21:983-989. [PubMed] [DOI] |
| 19. | Anstee QM, Goldin RD. Mouse models in non-alcoholic fatty liver disease and steatohepatitis research. Int J Exp Pathol. 2006;87:1-16. [PubMed] [DOI] |
| 20. | Dela Peña A, Leclercq I, Field J, George J, Jones B, Farrell G. NF-kappaB activation, rather than TNF, mediates hepatic inflammation in a murine dietary model of steatohepatitis. Gastroenterology. 2005;129:1663-1674. [PubMed] [DOI] |
| 21. | Ghoshal AK, Ahluwalia M, Farber E. The rapid induction of liver cell death in rats fed a choline-deficient methionine-low diet. Am J Pathol. 1983;113:309-14. [PubMed] |
| 22. | Diehl AM. Cytokine regulation of liver injury and repair. Immunol Rev. 2000;174:160-171. [PubMed] [DOI] |
| 23. | Leclercq IA, Farrell GC, Field J, Bell DR, Gonzalez FJ, Robertson GR. CYP2E1 and CYP4A as microsomal catalysts of lipid peroxides in murine nonalcoholic steatohepatitis. J Clin Invest. 2000;105:1067-1075. [PubMed] [DOI] |
| 25. | Schreuder TC, Verwer BJ, van Nieuwkerk CM, Mulder CJ. Nonalcoholic fatty liver disease: an overview of current insights in pathogenesis, diagnosis and treatment. World J Gastroenterol. 2008;14:2474-2486. [PubMed] [DOI] |
| 26. | Day CP, James OF. Steatohepatitis: a tale of two "hits"? Gastroenterology. 1998;114:842-845. [PubMed] [DOI] |
| 27. | Reid AE. Nonalcoholic steatohepatitis. Gastroenterology. 2001;121:710-723. [PubMed] [DOI] |
| 28. | Weltman MD, Farrell GC, Liddle C. Increased hepatocyte CYP2E1 expression in a rat nutritional model of hepatic steatosis with inflammation. Gastroenterology. 1996;111:1645-1653. [PubMed] [DOI] |
| 29. | Koteish A, Diehl AM. Animal models of steatosis. Semin Liver Dis. 2001;21:89-104. [PubMed] [DOI] |