修回日期: 2011-02-27
接受日期: 2011-03-08
在线出版日期: 2011-04-08
目的: 探讨肝上皮样血管平滑肌脂肪瘤的病理诊断及鉴别诊断.
方法: 收集武钢总医院病理科2007-2009年手术切除肝上皮样血管平滑肌脂肪瘤标本2例, 对2例肝上皮样血管平滑肌脂肪瘤相关临床资料、病理学特征及免疫组织化学进行观察分析并复习相关文献.
结果: 2病例均为女性, 巨检境界较清楚, 镜下见肿瘤主要由弥漫的上皮样细胞构成, 排列呈不规则梁索状结构, 瘤细胞圆形或多角形, 核呈圆形或卵圆形, 无明显异型性. 免疫组织化学示HMB45、Melan-A和SMA均有阳性表达.
结论: 肝上皮样血管平滑肌脂肪瘤是极为罕见的间叶性肿瘤, 其诊断及鉴别诊断主要依靠组织病理学及免疫组织化学.
引文著录: 马华玲, 杨赤兵, 陈卫斌, 张文娟, 李玲. 肝上皮样血管平滑肌脂肪瘤2例. 世界华人消化杂志 2011; 19(10): 1071-1074
Revised: February 27, 2011
Accepted: March 8, 2011
Published online: April 8, 2011
AIM: To investigate the clinicopathologic characteristics of hepatic epithelioid angiomyolipoma (EAML).
METHODS: Two cases of hepatic EAML treated at General Hospital of Wuhan Iron and Steel Corporation from 2007 to 2009 were analyzed in this study. The clinicopathologic and immunohistochemical characteristics of the disease were described and the related literature was reviewed.
RESULTS: Both patients are female. Both cases of hepatic EAML had clear boundaries. The tumors were characterized by diffused epithelioid neoplastic cells. The epithelioid cells were round with eosinophilic or clear cytoplasm, and few neoplastic cells showed cellular atypia. Immunohistochemically, the neoplastic cells were diffusely positive for HMB45, Melan-A and SMA.
CONCLUSION: Hepatic EAML is a rare mesenchymal neoplasm. The diagnosis and differentiatial diagnosis of EAML rely mainly on histopathology and immunohistochemistry.
- Citation: Ma HL, Yang CB, Chen WB, Zhang WJ, Li L. Hepatic epithelioid angiomyolipoma: an analysis of two cases. Shijie Huaren Xiaohua Zazhi 2011; 19(10): 1071-1074
- URL: https://www.wjgnet.com/1009-3079/full/v19/i10/1071.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i10.1071
典型的血管平滑肌脂肪瘤是血管周上皮样细胞肿瘤, 他由血管、平滑肌、脂肪3种成分组成[1]. 上皮样血管平滑肌脂肪瘤(epithelioid angiomyolipoma, EAML)亦称单形性上皮样血管平滑肌脂肪瘤, 肿瘤仅由上皮样平滑肌细胞组成, EAML多见于肾脏[2]; 近年来发生在肝脏的EAML引起了医师的兴趣. 发生在肝脏的EAML国内、外报道少见. 本文报道2例肝EAML, 结合其临床表现、组织形态和免疫表型, 探讨肝EAML的临床病理特征和鉴别诊断依据, 以提高病理及临床医师对该病的认识.
2例肝上皮样血管平滑肌脂肪瘤是武钢总医院病理科2007-2009年手术切除标本. 患者1: 女, 38岁, 体检发现肝脏占位; B超显示肝脏右叶有一占位性病变5.0 cm×4.0 cm×3.5 cm, 境界清楚, 混合密度, 未见肝脏以外的脏器有病变; 实验室检查: 包括AFP在内的所有项目均在正常范围内. 患者2: 女, 53岁, 无诱因上腹不适感3 mo, 腹胀, 轻微疼痛; CT显示肝右叶见8.0 cm×8.0 cm×7.0 cm巨大实性占位, 边界清晰, 似有假包膜, 肿块内见较丰富的血流信号, 考虑肝细胞癌可能性大; 实验室检查: 肝功正常, 血清AFP、CA-199阴性. 2例患者均行部分肝切除术, 未行其他辅助治疗, 分别随访17及12 mo, 均病情稳定, 未见复发或转移.
2例标本经40 g/L甲醛溶液固定, 常规石蜡包埋, 连续组织切片, 4-5 μm厚, 进行苏木精-伊红(HE)染色. 在光镜下观察其组织病理学特点. 并选取典型病变区域, 采用SP法分别进行HMB45、Melan-A、SMA、PCK、EMA、AFP、CEA及S-100的免疫组织化学染色. 抗体均购自福州迈新生物技术开发公司. 用PBS代替一抗做阴性空白对照; 阳性对照采用已知阳性组织切片; DAB显色, 苏木素复染, 常规脱水透明封片.
2.1.1 巨检: 患者1: 部分肝组织6.0 cm×5.0 cm×4.0 cm, 切面见灰红色肝组织中有一灰白色肿块5.0 cm×4.2 cm×3.5 cm, 境界清楚, 硬度中等, 质地细腻, 无出血坏死. 患者2: 部分肝组织10.0 cm×10.0 cm×8.0 cm大小, 切面见8.0 cm×8.0 cm×7.0 cm包块, 肿瘤与周边挤压的肝组织界限清楚, 无包膜, 呈淡黄色颗粒状, 局部区域见小出血灶, 质脆.
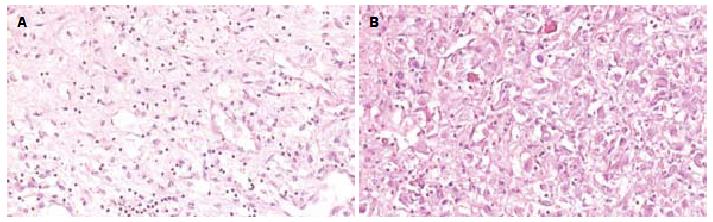
2.1.2 镜检: 2例肿瘤形态相似, 失去正常肝小叶结构, 细胞多弥漫呈巢状和片状排列(图1A). 主要由大、多边形上皮样细胞构成, 排列呈不规则梁索状结构, 被丰富窦隙状薄壁血管网分隔; 瘤细胞圆形或多角形, 胞质丰富, 呈弱嗜酸性或透明状; 核呈圆形或卵圆形, 染色质细, 无明显异型性, 核仁清楚, 核分裂象罕见(图1B); 可见单核或多核的上皮样细胞、平滑肌及脂肪组织不规则分布在瘤组织内, 血管成分的形态不一, 可有厚壁血管和薄壁血管, 瘤组织中可见梭形细胞的聚集和灶状经典的血管平滑肌脂肪瘤区域. 肿瘤周边肝组织未见特殊改变.
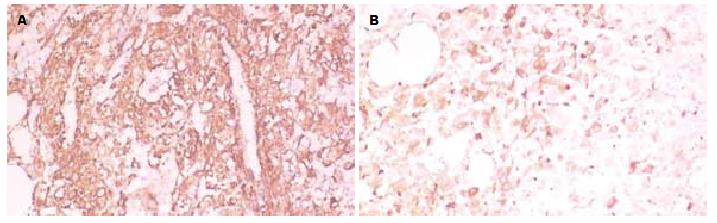
肿瘤HMB45、Melan-A和SMA均有阳性表达, 阳性信号均为黄色、棕黄色颗粒, 定位于胞质, 呈弥漫性或灶性分布. 其中SMA表达较为弥漫, 且呈强阳性(图2A); Melan-A和HMB45呈弥漫或灶性表达(图2B). 2病例肿瘤细胞均不表达PCK、EMA、AFP、CEA及S-100.
病理诊断患者为肝EAML.
Mai等[3]1996年报道了第1例肾脏EAML, 近年来人们逐渐认识和接受了EAML, 并认为此类肿瘤是一种具有恶性潜能的间叶肿瘤. 关于EAML的来源问题, 更多的人接受EAML属于血管周上皮样细胞瘤(perivascular epithelioid cell tumor, PECom)家族成员的理论[4]. PECom家族包括肾AML、肺透明细胞"糖"瘤、镰状韧带透明细胞黑色素细胞肿瘤、肺淋巴管肌瘤病、肾被膜瘤、肾微小错构瘤、镰状韧带/圆韧带的透明细胞上皮样肿瘤等. 这些肿瘤共同特点是肿瘤细胞表达黑色素细胞标记, 同时不同程度表达平滑肌源性标记. 本文中2例EAML中黑色素细胞标记(HMB45、Melan-A)和平滑肌源性标记(SMA)均呈阳性表达, 具备一般PEComa的免疫组织化学特点.
文献报道, 肝EAML患者发病年龄范围较广[26-60(平均年龄47)岁], 男女之比为1:4, 女性明显多见, 肿瘤较小时多无临床症状, 偶尔体检时被发现; 肿瘤较大时可有腹胀、腹部包块等症状[5,6]. 本组2例均为女性与文献基本相符. 由于EAML缺乏脂肪成分, 在超声和CT检查时很难与其他间叶肿瘤及癌区别[6,7]. 实验室检查一般项目均在正常范围内. 肝EAML的发现靠术前CT、B超发现肝脏包块, 最后确诊有赖于病理学检查. EAML属于具有"恶性潜能"的肿瘤, 出现细胞的多形性甚至异型性、核分裂以及血管内瘤栓都不足以作为恶性的诊断依据, 诊断恶性EAML的确凿证据是发现远处转移[8]. 一旦明确诊断应首选手术切除, 预后较好. 考虑EMAL的潜在恶性倾向, 术后定期随访、复查是必要的. 该2例患者术后未进行后续治疗, 分别随访17及12 mo, 均病情稳定, 未复发或转移.
大体所见肝脏EAML一般为界限清楚或有假包膜的实性肿块. 边缘与邻近肝实质通常是推挤而不是浸润的关系; 肿块切面灰白、灰黄, 可伴有出血及坏死. 瘤组织主要由大的多边形、圆形上皮样细胞构成, 排列成不规则梁索状结构, 并由大小不等的丰富窦隙状薄壁血管网分隔. 瘤细胞有两种形态: 一种胞质透亮, 周边有空泡形成, 中央嗜伊红细颗粒聚集成块; 另一种胞质内充满嗜伊红细颗粒, 细胞周边深染, 中央淡染, 类似于印戒细胞. 瘤细胞核为圆形、卵圆形, 染色质细, 核仁较明显, 核分裂象罕见. 瘤组织中可见梭形细胞的聚集和灶状经典的AML区域. 周围肝组织未见硬化等特殊改变. 部分区域肿瘤细胞可能退变、坏死, 肿瘤间质中可见不等量散在的淋巴细胞、浆细胞、嗜酸性粒细胞等炎细胞浸润. Li等[9]在51例肝EAML研究示HMB45的阳性率为98.04%, SMA的阳性率为95.92%. 肿瘤细胞特征性的免疫表型是黑色素细胞(HMB45、Melan-A)和平滑肌细胞(SMA)标记阳性, 而上皮细胞标记(CK、EMA)阴性. 该免疫组织化学结果与文献在肾的EAML研究中一致[10]. 文献[9]报道EAML的超微结构: 有具有平滑肌细胞特性的梭形细胞; 有些梭形细胞内含有脂滴, 提示为平滑肌细胞和脂肪细胞间的转换型细胞. 细胞内可见类似黑色素小体的结构及致密颗粒.
肝EAML的诊断一般借助HE、免疫组织化学均能明确诊断. 肝EAML诊断时要与其他肿瘤鉴别[11], 这些肿瘤包括: (1)肝细胞癌, 尤其透明细胞型肝细胞癌由上皮样细胞构成, 胞质透亮, 核仁嗜酸性, 易与肝EAML混淆. 肝细胞肝癌中癌细胞皆有不同程度的异型性及较多的核分裂象, 有假腺样结构及胆汁淤积, 周围肝组织常有肝硬化; 免疫组织化学: 肝细胞癌CK及AFP均阳性, 而HMB45及SMA标记阴性; (2)原发/转移的黑色素瘤, 肝原发性黑色素瘤极为罕见, 转移性黑色素瘤有黑色素瘤的病史, 镜下黑色素瘤细胞有明显的异型性和较多的核分裂, 免疫组织化学S-100、HMB45和Melan-A阳性, 但SMA呈阴性. 肝EAML弥漫表达HMB-45、SMA, 而且肝EAML有经典的AML成分残留; (3)转移性肾透明细胞癌, 需结合病史、临床表现和免疫组织化学进行鉴别, 癌细胞CK、EMA阳性, HMB-45、SMA阴性; 与肝EAML相反. 肝脏EAML还应与肝血管肉瘤、肉瘤样癌、透明细胞肉瘤、肝母细胞瘤、副节瘤、嗜酸细胞腺瘤等进行鉴别.
总之, 肝EAML发病率很低, 是一种极为罕见的具有恶性潜能间叶性肿瘤, 他起源于血管周上皮样细胞, 有特定的组织学特点和免疫组织化学表达, 手术切除后预后较好; 诊断肝EAML时应与肝脏的原发和转移性肿瘤进行鉴别.
肝上皮样血管平滑肌脂肪瘤(EAML)是一种罕见间叶性肿瘤, 近年本病报道呈上升趋势; 因此肝EAML的准确诊断对于提高该类肿瘤的认识显得尤为重要.
王鲁平, 主任医师, 中国人民解放军北京军区总医院病理科
本文就2例罕见的EAML的临床病例病理特点进行总结, 可提高病理及临床医师对该病的认识.
与一般的肝脏肿瘤相比, 肝EAML的形态学特征有一定差异, 当不易与其他肿瘤鉴别时, 可应用免疫组织化学及电镜观察.
本文选题恰当, 但可读性一般.
编辑: 曹丽鸥 电编:何基才
| 1. | Folpe AL, Mentzel T, Lehr HA, Fisher C, Balzer BL, Weiss SW. Perivascular epithelioid cell neoplasms of soft tissue and gynecologic origin: a clinicopathologic study of 26 cases and review of the literature. Am J Surg Pathol. 2005;29:1558-1575. [PubMed] [DOI] |
| 2. | Morioka M, Kinugawa K, Funabiki S, Matsuda T, Furukawa Y, Wani Y. Monotypic epithelioid angiomyolipoma of the kidney: a case report. Int J Urol. 2006;13:1240-1242. [PubMed] [DOI] |
| 3. | Mai KT, Perkins DG, Collins JP. Epithelioid cell variant of renal angiomyolipoma. Histopathology. 1996;28:277-280. [PubMed] [DOI] |
| 4. | Armah HB, Parwani AV. Perivascular epithelioid cell tumor. Arch Pathol Lab Med. 2009;133:648-654. [PubMed] |
| 5. | Park HK, Zhang S, Wong MK, Kim HL. Clinical presentation of epithelioid angiomyolipoma. Int J Urol. 2007;14:21-25. [PubMed] [DOI] |
| 6. | Zeng JP, Dong JH, Zhang WZ, Wang J, Pang XP. Hepatic angiomyolipoma: a clinical experience in diagnosis and treatment. Dig Dis Sci. 2010;55:3235-3240. [PubMed] [DOI] |
| 8. | Kato I, Inayama Y, Yamanaka S, Ohshiro H, Gomi K, Shirai S, Aoki I, Uemura H, Miyoshi Y, Kubota Y. Epithelioid angiomyolipoma of the kidney. Pathol Int. 2009;59:38-43. [PubMed] [DOI] |
| 9. | Li T, Fan J, Qin LX, Zhou J, Sun HC, Wang L, Ye QH, Qiu SJ, Tang ZY. [A clinicopathologic study of hepatic angiomyolipoma]. Zhonghua Waike Zazhi. 2009;47:1536-1539. [PubMed] |
| 10. | 王 兆亮, 朱 建善, 陈 以明, 王 莉. 肾脏上皮样血管平滑肌脂肪瘤的免疫组织化学检测. 上海交通大学学报(医学版). 2010;30:722-725. |
| 11. | Ding GH, Liu Y, Wu MC, Yang GS, Yang JM, Cong WM. Diagnosis and treatment of hepatic angiomyolipoma. J Surg Oncol. 2011; Jan 31 [Epub ahead of print]. [PubMed] |