修回日期: 2011-03-01
接受日期: 2011-03-16
在线出版日期: 2011-04-08
目的: 探讨一氧化氮(NO)含量变化对伴高脂血症急性出血坏死性胰腺炎(ANP)大鼠胰腺、肾损害的作用和对肾小球足细胞的影响.
方法: ♂SD大鼠30只, 高脂饲料喂养4 wk建立大鼠高脂血症模型, 将大鼠随机等分为3组; A组即高脂血症+ANP; B组即高脂血症+ANP+L-精氨酸(L-arg); C组即高脂血症+ANP+L-硝基精氨酸甲基酯(L-name), 3组均逆行胰胆管注射3.5%牛磺脱氧胆酸钠制作大鼠SAP模型. A组给予适量生理盐水, B组给予L-arg, 每次250 mg/kg, C组给予L-name, 每次10 mg/kg, 3组均在造模前30 min和造模后2 h给药. 术后6 h监测血清淀粉酶(Amyl)、肌酐(Cr)、血尿素氮(BUN)、NO水平, 胰腺组织NO和内皮型一氧化氮合成酶(eNOS)含量变化, 光镜观察胰腺组织病理学变化, 电镜观察肾小球足细胞病理学变化, 免疫组织化学技术分析肾小球足细胞nephrin蛋白的表达情况.
结果: 与B组比较, A、C组Amyl(U/L)、Cr(μmol/L)、BUN(mmol/L)水平显著升高(Amyl: 4 219.8±900.0, 6 643.2±1 135.4 vs 2 434.4±831.6; Cr: 15.8±1.6, 22.4±3.3 vs 9.9±0.8; BUN: 135.9±23.6, 206.4±23.4 vs 103.2±13.2, 均P<0.01), 胰腺组织及肾脏足细胞损伤加重, 血清和胰腺组织NO(μmol/L)水平显著降低(59.46±11.21, 44.84±10.72 vs 78.88±9.76; 5.23±0.48, 4.39±0.45 vs 6.18±0.57, 均P<0.01), 胰腺组织eNOS、肾脏足细胞nephrin蛋白表达降低.
结论: 在伴高脂血症ANP合并肾功能障碍时, eNOS催化产生的NO不仅可以保护胰腺组织, 并且对肾小球足细胞和肾脏功能也具有一定的保护作用.
引文著录: 吴婷, 王昭智. 一氧化氮在伴高脂血症急性出血坏死性胰腺炎大鼠胰腺及肾损害中的作用. 世界华人消化杂志 2011; 19(10): 1022-1027
Revised: March 1, 2011
Accepted: March 16, 2011
Published online: April 8, 2011
AIM: To determine whether nitric oxide (NO) protects against pancreatic and renal injury in rats with acute necrotizing pancreatitis (ANP) and hyperlipidemia.
METHODS: Forty male Sprague-Dawley rats were fed a high-fat diet for 4 weeks to induce hyperlipidemia. The rats were randomly divided into three groups: group A (hyperlipidemia + ANP + normal saline), group B ( hyperlipidemia + ANP + L-arg), and group C (hyperlipidemia + ANP + L-Name). ANP was induced by retrograde injection of 3.5% sodium taurocholate into the biliopancreatic duct. Each group was treated 30 min before and 2 h after ANP induction. At 6 h after ANP induction, serum amylase (Amyl), creatinine (Cr), urea nitrogen (BUN), NO, and pancreatic NO and endothelial nitric oxide synthetase (eNOS) were measured; pancreatic histopathology was detected by light microscopy; ultrastructure of glomerular podocytes was observed by election microscopy; and expression of nephrin in glomerular podocytes was examined by immunohistochemistry.
RESULTS: Serum Amyl, Cr and BUN in group B were significantly lower than those in groups A and C (Amyl: 4 219.8 ± 900.0, 6 643.2 ± 1 135.4 vs 2 434.4 ± 831.6; Cr: 15.8 ± 1.6, 22.4 ± 3.3 vs 9.9 ± 0.8; BUN: 135.9 ± 23.6, 206.4 ± 23.4 vs 103.2 ± 13.2; all P < 0.01). Pancreatic injury and changes in glomerular podocytes were milder in group B than in groups A and C. The levels of serum and pancreatic NO (59.46 ± 11.21, 44.84 ± 10.72 vs 78.88 ± 9.76; 5.23 ± 0.48, 4.39 ± 0.45 vs 6.18 ± 0.57; all P < 0.01) and pancreatic eNOS, and expression of nephrin in glomerular podocytes were significantly higher in group B than in groups A and C.
CONCLUSION: NO produced by eNOS can protect against pancreatic and renal injury in rats with ANP and hyperlipidemia.
- Citation: Wu T, Wang ZZ. Nitric oxide protects against pancreatic and renal injury in rats with acute necrotizing pancreatitis and hyperlipidemia. Shijie Huaren Xiaohua Zazhi 2011; 19(10): 1022-1027
- URL: https://www.wjgnet.com/1009-3079/full/v19/i10/1022.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i10.1022
急性肾功能障碍是急性坏死性胰腺炎(acute necrotizing pancreatitis, ANP)常见的并发症之一[1]. ANP合并肾损害的发病机制尚不完全清楚, 一般认为血流动力学异常, 微循环障碍(microcirculatory disorder, MCD)和炎症介质、细胞因子的作用是ANP并发肾损害的主要原因. 内皮型一氧化氮合酶(endothelial nitric oxide synthase, eNOS)产生的NO可能参与调节血压和器官的血流分布, 抑制血小板的黏附和活化, 抑制多核粒细胞的聚集. 在ANP时, 外源性增加或减少体内NO含量, 是否加重或减轻胰肾损害程度, 以及对肾小球足细胞有怎样影响, 目前少有研究报道. 高脂血症作为ANP继发于胆源性, 酒精性之后的常见病因之一[2], 近年来呈上升趋势. 本研究拟通过建立伴高脂血症ANP大鼠模型, 应用L-精氨酸(L-arg)和L-硝基精氨酸甲基酯(L-name)对实验大鼠进行干预, 观察NO含量变化对胰肾损害和肾小球足细胞的影响.
健康♂SD大鼠30只, 体质量180-220 g (购自上海斯莱克实验动物有限公司). 3.5%牛磺脱氧胆酸钠(购自厦门泰京生物技术有限公司), L-arg, L-name, DAB显色试剂盒(购自中山金桥生物技术有限公司), NO试剂盒(购自南京建成生物工程研究所), 兔抗大鼠eNOS多克隆抗体(购自美国Santa公司), 兔抗大鼠nephrin多克隆抗体(购自美国Biaworld公司).
1.2.1 造模: ♂SD大鼠30只, 清洁级, 质量180-220 g. 全部大鼠高脂饲料(主要成分为87.8%基础饲料+10%猪油+2%胆固醇+0.2%胆酸钠)喂养4 wk, 建立高脂血症模型[3]. 随机等分为3组, 每组10只, 实验前12 h开始禁食, 自由饮水, 10%(3 mL/kg)水合氯醛ip麻醉, 无菌条件下经上腹正中切口进腹, 暴露胰腺, 5号头皮针经肠壁从十二指肠乳头插人胆胰管约1 cm, 用动脉夹固定针头近十二指肠乳头处. 近肝门处也用动脉夹阻断胆总管, 用微量注射泵注入3.5%牛磺脱氧胆酸钠1.0 mL/kg[4], 注射速度0.2 mL/min, 保持压力7 min. A组制备ANP模型前30 min和后2 h ip注射适量生理盐水(NS)[5], B组相同时间和途径给予L-arg(每次250 mg/kg), C组相同时间和途径给予L-name(每次10 mg/kg).
1.2.2 标本采集: 各组大鼠于造模6 h后麻醉开腹, 经右心房取血3-5 mL, 3 000 r/min离心10 min, 部分上清液置于-20 ℃冰箱, 部分置于-80 ℃冰箱待测. 切取胰腺组织, 一部分-80 ℃冰箱冻存; 另一部分置于40 g/L中性甲醛溶液固定备用. 切取右肾上极组织, 一部分置于40 g/L中性甲醛溶液固定备用, 另一部分切取1 mm×1 mm×1 mm组织3-5块, 放入1%锇酸溶液中固定.
1.2.3 检测指标及方法: (1)血清淀粉酶(amylase, Amyl)、肌酐(creatinine, Cr)、血尿素氮(blood urea nitrogen, BUN)检测: 吸取-20 ℃冰箱冻存的各组实验大鼠血清上清液1 mL, 用全自动生化分析仪(美国Beckman公司)检测; (2)血清、胰腺组织NO测定: 吸取-80 ℃冰箱冻存的各组实验大鼠血清上清液0.1 mL, 采用硝酸还原酶比色法测定血清NO2-/NO3-含量, 间接反应NO的生成量. 将冻存于-80 ℃冰箱的各组实验大鼠胰腺组织匀浆, 2 000 r/min离心10 min, 取上清液0.5 mL, 其余操作同血浆NO测定, 按说明书进行操作. 试剂盒购自南京建成生物工程研究所; (3)胰腺组织形态学检查及光镜下胰腺组织损伤定量评估: 取固定于40 g/L甲醛的各组大鼠胰腺组织, 常规石蜡包埋、切片, 苏木素-伊红(HE)染色, 光学显微镜下观察胰腺组织病理改变, 并参照Grewal等[6]对胰腺组织损伤进行定量评估. 评分标准: 水肿: 0分 = 无水肿, 1分 = 轻度叶间隙增宽, 2分 = 重度叶间隙增宽, 3分 = 腺泡间隙增宽, 4分 = 细胞间隙增宽; 炎症: 以每高倍视野计, 每5个炎细胞计0.5分, 超过40个计4分; 出血: 0分 = 无出血, 1分 = 有出血; 坏死: 0分 = 无坏死, 1分 = 坏死面积1%-10%, 2分 = 坏死面积11%-20%, 3分 = 坏死面积21%-30%, 4分 = 坏死面积>30%; (4)电镜下肾小球足细胞组织形态学观察: 取固定于1%锇酸溶液的肾脏组织, 逐级酒精、丙酮脱水, 环氧树脂618包埋, 半薄切片定位、超薄切片经醋酸铀和枸橼酸铅双重染色, Philips EM208S型透射按常规制备超薄切片, 电镜观察肾小球足细胞的组织形态学改变; (5)免疫组织化学技术检测胰腺组织eNOS、肾小球足细胞nephrin表达水平: 取固定于40 g/L甲醛的各组大鼠胰腺组织和肾脏组织, 常规石蜡包埋、切片, 采用兔超敏二步法, DAB显色. 以PBS代替一抗作为空白对照. 试剂盒购自中山金桥生物有限公司. 具体判定标准如下: 将染色程度分为4级: 基本不着色者为0分, 着色淡者为1分, 着色适中者2分, 着色深者为3分; 着色细胞占计数细胞百分率≤5%为0分、6%-25%为1分、26%-50%为2分、≥51%为3分. 将每个点阵着色程度与着色细胞百分率得分乘积, 为其最后得分. 0-1分为阴性(-), 2-3分为弱阳性(+), 4-6分为阳性(++), 6分以上为强阳性(+++).
统计学处理 本实验采用SPSS17.0统计软件, 计量资料用tevene法进行方差齐性检验, 组间两两比较用LSD-t(方差齐)或Tamhane's T2(方差不齐)法进行显著性分析, 等级资料用两个独立样本比较的Wilcoxon秩和检验. P<0.05为有统计学意义.
与A组比较, B组Amyl、Cr、BUN水平显著降低, C组上述各项指标显著升高, 均具有统计学意义(P<0.01, 表1).
与A组比较, B组血清、胰腺组织NO浓度显著升高, C组这些指标显著降低, 均具有统计学意义(P<0.01, 表2).
A组: 叶间隙及腺泡间隔显著扩张, 大量炎症细胞浸润, 可见较多红细胞, 面积不等的腺细胞坏死. B组: 叶间隙轻度增宽, 炎症细胞浸润, 红细胞较A组减少, 偶见腺细胞坏死. C组: 同样出现水肿、炎症细胞浸润、出血、坏死等改变, 尤以坏死更为严重, 部分细胞内可见脂质空泡形成. 参照Grewal法, 与A组比较, B组水肿、炎症、出血、坏死均减轻, C组明显加重, 差异有统计学意义(P<0.05, 表3).
| 分组 | 水肿(分) | 坏死(分) | 炎症(分) | 出血(分) | ||||||||||||||||
| 0 | 1 | 2 | 3 | 4 | 0 | 1 | 2 | 3 | 4 | 0.5 | 1 | 1.5 | 2 | 2.5 | 3 | 3.5 | 4 | 0 | 1 | |
| A组 | 0 | 0 | 7 | 3 | 0 | 0 | 1 | 3 | 6 | 0 | 0 | 0 | 0 | 0 | 2 | 6 | 2 | 0 | 6 | 4 |
| B组 | 0 | 8 | 2 | 0 | 0 | 0 | 7 | 3 | 0 | 0 | 0 | 1 | 0 | 5 | 3 | 2 | 0 | 0 | 3 | 7 |
| C组 | 0 | 0 | 1 | 7 | 2 | 0 | 0 | 0 | 2 | 8 | 0 | 0 | 0 | 0 | 0 | 1 | 1 | 8 | 0 | 10 |
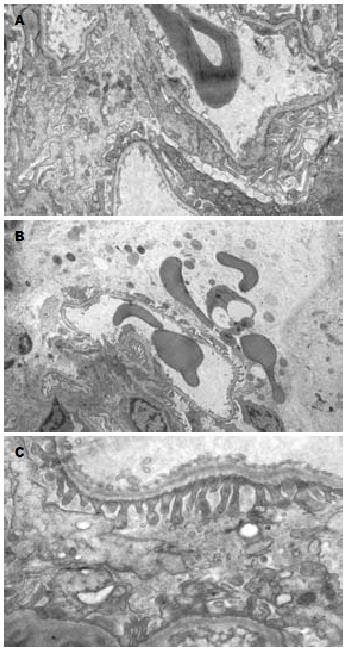
A组: 足细胞结构尚完整, 胞质密度下降, 体积增大, 细胞内空泡形成, 部分细胞器消失. B组: 足细胞足突宽度明显增加, 部分可见融合, 并有微绒毛形成. C组: 足细胞线粒体等细胞器消失, 细胞膜消失, 细胞结构及完整性破坏, 并可见红细胞自血管袢溢出(图1).
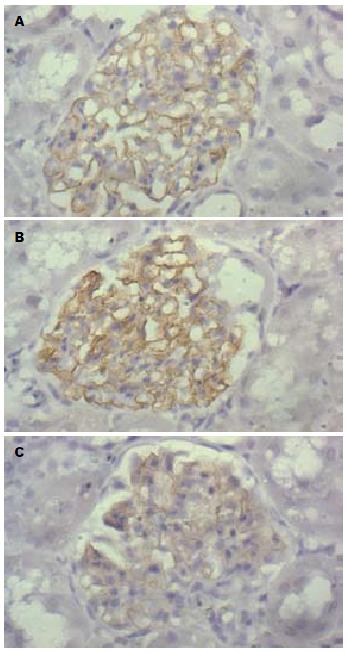
与A组比较, B组胰腺组织eNOS、肾小球足细胞nephrin染色程度较深, 全部细胞均染色, C组染色程度浅, 染色细胞较A组明显减少. 差异有统计学意义(P<0.05, 表4, 图2, 3).
| 分级 | eNOS | nephrin | ||||
| A组 | B组 | C组 | A组 | B组 | C组 | |
| - | 0 | 0 | 8 | 0 | 0 | 7 |
| + | 3 | 0 | 2 | 8 | 2 | 2 |
| ++ | 7 | 2 | 0 | 2 | 1 | 1 |
| +++ | 0 | 0 | 0 | 7 | 0 | |
ANP常并发多器官功能不全综合征(multiple organ dysfunction syndrome, MODS), 在胰外器官损伤中, 肾功能障碍发生率仅次于肺功能障碍[1], 大约在14%-43%. 其发病机制仍不明确, 目前认为可能与以下因素有关: (1)毛细血管渗漏综合征的发生, 大量炎性渗液和组织液进入第三间隙, 同时释放大量血管活性物质, 造成有效循环血容量不足, 血流量减少, 引起肾脏局部的血液动力学改变, MCD; (2)炎症介质、细胞因子直接损伤肾小球内皮细胞和肾小管上皮细胞[7]; (3)大量腹腔炎性渗液吸收进入血液循环对肾脏的毒性作用. 其中血液动力学改变, MCD和炎症介质、细胞因子的作用被认为是ANP时肾功能障碍的重要因素[8]. 因此, 改善血液动力学、MCD, 抑制炎症介质和细胞因子成为治疗ANP合并肾功能障碍的关键.
NO是一种很强生物活性物质, 具有广泛且重要的生物学功能. 在体内L-arg通过一氧化氮合成酶(nitric oxide synthase, NOS)作用合成NO是NO的唯一合成途径. eNOS是3种NOS中的一种, 由内皮细胞产生. eNOS催化作用下合成的NO能有效改善胰腺微循环, 抑制白细胞内皮细胞相互作用, 抑制血小板黏附和聚集, 抗血栓形成[9]. 近年来有研究结果显示NO可以减轻ANP的损害作用[10,11]. L-name属于非选择性底物抑制剂, 但对eNOS的抑制作用最强[12]. 本研究显示, 实验大鼠在注射L-arg之后, 与A组比较, eNOS表达升高, 血清NO, 胰腺组织NO水平亦随之升高, Amyl明显下降, 胰腺及肾小球足细胞病理损伤减轻, 血清Cr, BUN水平随之降低, nephrin表达升高, 而C组与A组比较, 则得出相反实验结果. 这说明增加体内NO水平, 不仅降低ANP的严重程度, 而且可以有效改善胰肾功能障碍, 对肾小球足细胞也起到一定的保护作用. 同时也从正反两方面证明了体内NO含量与eNOS的表达水平呈正相关.
肾小球足细胞是位于肾小球基底膜外侧的一种终末期分化细胞, 是维持肾小球滤过屏障结构和功能正常的主要细胞之一, 其裂孔隔膜是避免机体蛋白丢失的最后一道屏障. 目前认为, 特异性表达于足细胞裂孔膜上的蛋白分子nephrin是肾小球滤过屏障选择性功能的关键, 参与细胞的信号转导、维持足细胞的正常形态和功能[13]. 有文献报道, 当肾功能障碍时, 足细胞足突融合, 细胞脱落或发生凋亡, 功能受损, 数量减少, nephrin表达明显减少[14,15], 因此肾小球足细胞nephrin水平可以作为检测肾小球足细胞功能的可靠指标. 本实验研究表明, ANP导致肾功能障碍时, 血清Cr、BUN升高, 足细胞结构及完整性破坏, 裂孔隔膜的屏障滤过作用消失, 红细胞溢出, nephrin表达减少, 并且血清Cr、BUN升高的程度与肾小球足细胞病理损伤程度呈正相关, 而与nephrin表达水平呈负相关.
高脂血症作为ANP的危险因素之一, 可激活血小板, 损伤血管内皮细胞, 促进eNOS向细胞膜上的caveolae内转位, 从而影响其活性, 减少NO生成[16], 而伴高脂血症的ANP两种损害因素的作用下有可能使NO生成减少更加重, 因而补充外源性NO就成为一种必要的治疗措施[17,18]. 本实验研究中也证实, eNOS表达产生的NO在伴高脂血症ANP合并肾功能障碍时, 不仅缓解ANP的病情发展, 而且对肾脏也有一定的保护作用, 其机制可能与改善肾脏MCD, 调节肾血流量和抑制白细胞黏附和激活, 抑制血小板聚集有关. 然而, NO对肾小球足细胞的保护机制还不清楚, 仍有待进一步研究.
急性胰腺炎(AP)是消化科常见的急腹症, 约25%的患者发生全身炎症反应综合征(SIRS), 继之发展为多器官功能不全综合征(MODS), 成为急性出血坏死性胰腺炎(ANP), 并发症涉及全身各脏器. AP时胰腺外器官损伤中肾功能障碍的发生率仅次于肺功能障碍, 大约在14%-43%. ANP伴发急性肾功能衰竭(ARF)的死亡率高达71%-84%.
沈薇, 教授, 重庆医科大学附属第二医院消化内科
NO已成为近年来研究的热点, NO对于ANP作用方面的研究也层出不穷.
多数研究结果显示高脂血症不仅能诱发急性胰腺炎(AP), 而且能加重AP的损伤程度. 本研究采用3.5%牛磺脱氧胆酸钠(而非5%牛磺脱氧胆酸钠)建立伴高脂血症ANP大鼠模型, 不仅确保建模成功, 还可降低大鼠死亡率, 为成功建立伴高脂血症ANP大鼠模型提供实验依据.
本实验通过建立高脂血症型ANP大鼠模型, 应用L-arg和L-name对模型进行干预, 探讨NO在伴高脂血症ANP大鼠合并肾损害时对胰腺和肾功能的作用, 并通过检测大鼠肾小球足细胞nephrin的表达情况, 探讨对肾小球足细胞的可能作用, 旨在为临床防治伴高脂血症ANP合并肾损害扩宽思路, 并提供新的实验基础.
本文新颖性较好, 具有一定的临床参考价值.
编辑: 曹丽鸥 电编:何基才
| 1. | Pupelis G. Renal failure in acute pancreatitis. Timing of dialysis and surgery. Przegl Lek. 2000;57 Suppl 5:29-31. [PubMed] |
| 2. | Chang MC, Su CH, Sun MS, Huang SC, Chiu CT, Chen MC, Lee KT, Lin CC, Lin JT. Etiology of acute pancreatitis--a multi-center study in Taiwan. Hepatogastroenterology. 2003;50:1655-1657. [PubMed] |
| 5. | Ang AD, Adhikari S, Ng SW, Bhatia M. Expression of nitric oxide synthase isoforms and nitric oxide production in acute pancreatitis and associated lung injury. Pancreatology. 2009;9:150-159. [PubMed] [DOI] |
| 6. | Grewal HP, Mohey el Din A, Gaber L, Kotb M, Gaber AO. Amelioration of the physiologic and biochemical changes of acute pancreatitis using an anti-TNF-alpha polyclonal antibody. Am J Surg. 1994;167:214-218; discussion 218-219. [PubMed] [DOI] |
| 8. | Yekebas EF, Strate T, Zolmajd S, Eisenberger CF, Erbersdobler A, Saalmüller A, Steffani K, Busch C, Elsner HA, Engelhardt M. Impact of different modalities of continuous venovenous hemofiltration on sepsis-induced alterations in experimental pancreatitis. Kidney Int. 2002;62:1806-1818. [PubMed] [DOI] |
| 10. | Sánchez-Bernal C, García-Morales OH, Domínguez C, Martin-Gallán P, Calvo JJ, Ferreira L, Pérez-González N. Nitric oxide protects against pancreatic subcellular damage in acute pancreatitis. Pancreas. 2004;28:e9-e15. [PubMed] [DOI] |
| 11. | Cosen-Binker LI, Binker MG, Cosen R, Negri G, Tiscornia O. Influence of nitric oxide-donating nonsteroidal anti-inflammatory drugs on the evolution of acute pancreatitis. Shock. 2006;25:190-203. [PubMed] [DOI] |
| 13. | 申 焕蓉, 曹 灵. 足细胞表型的改变与肾脏疾病. 中国中西医结合肾病杂志. 2009;10:279-280. |
| 14. | 谭 会斌, 傅 淑霞, 杨 林. 缬沙坦联合苯那普利对糖尿病大鼠足细胞损伤的影响及肾脏保护机制的研究. 中国中西医结合肾病杂志. 2008;9:338-341. |
| 15. | Siu B, Saha J, Smoyer WE, Sullivan KA, Brosius FC 3rd. Reduction in podocyte density as a pathologic feature in early diabetic nephropathy in rodents: prevention by lipoic acid treatment. BMC Nephrol. 2006;7:6. [PubMed] [DOI] |
| 16. | Yang B, Rizzo V. TNF-alpha potentiates protein-tyrosine nitration through activation of NADPH oxidase and eNOS localized in membrane rafts and caveolae of bovine aortic endothelial cells. Am J Physiol Heart Circ Physiol. 2007;292:H954-H962. [PubMed] [DOI] |
| 17. | Tsuchihashi S, Kaldas F, Chida N, Sudo Y, Tamura K, Zhai Y, Qiao B, Busuttil RW, Kupiec-Weglinski JW. FK330, a novel inducible nitric oxide synthase inhibitor, prevents ischemia and reperfusion injury in rat liver transplantation. Am J Transplant. 2006;6:2013-2022. [PubMed] [DOI] |
| 18. | Sukhotnik I, Helou H, Mogilner J, Lurie M, Bernsteyn A, Coran AG, Shiloni E. Oral arginine improves intestinal recovery following ischemia-reperfusion injury in rat. Pediatr Surg Int. 2005;21:191-196. [PubMed] [DOI] |