修回日期: 2011-03-19
接受日期: 2011-03-23
在线出版日期: 2011-04-08
目的: 研究外源性血管内皮生长因子对肝硬化大鼠肝脏组织内血管的影响, 以检测肝硬化大鼠肝脏微循环变化.
方法: 25只肝硬化门静脉高压造模成功SD♂大鼠, 体质量180-220 g, 随机分为肝硬化门静脉高压对照组(B组, n = 10)和肝硬化门静脉高压实验组(C组, n = 15), C组应用Alzet微渗泵从大鼠门静脉连续泵入血管内皮生长因子持续2 wk, 正常对照组(A组, n = 10)和B组开腹后关腹作对照, 2 wk后对各组大鼠在光镜和电镜下进行肝组织病理学观察, 用免疫组织化学方法, 以Ⅷ因子相关抗原标记微血管数目, 检测大鼠肝脏微血管变化.
结果: 光镜下观察C组肝纤维化程度较B组减轻, 电镜下观察B组肝窦内皮细胞形态不规则, 窗孔缺失, 基底膜形成, C组病变减轻. 免疫组织化学显示, 在肝脏间质组织中, C组肝脏微血管数目较B组数目增加(2.04±0.61 vs 1.26±0.30, P<0.01), 在肝脏实质组织中, C组微血管数目较B组数目减少(0.74±0.05 vs 1.32±0.48, P<0.01). 在肝脏实质与间质组织中, B组和C组微血管数目均高于A组(1.26±0.30, 2.04±0.61 vs 0.70±0.07; 1.32±0.48, 0.74±0.05 vs 0.28±0.08, 均P<0.05).
结论: 外源性血管内皮生长因子能够增加肝硬化大鼠肝脏间质组织中微血管数目, 并同时减少肝脏实质组织中微血管数目, 能够改善肝脏的微循环情况.
引文著录: 蒋伟伟, 赵金满, 于良立. 外源性血管内皮生长因子对肝硬化大鼠肝组织血管的影响. 世界华人消化杂志 2011; 19(10): 1009-1014
Revised: March 19, 2011
Accepted: March 23, 2011
Published online: April 8, 2011
AIM: To investigate the effect of portal vein administration of vascular endothelial growth factor on the density of hepatic microvessels in rats with liver cirrhosis.
METHODS: Twenty-five male Sprague-Dawley rats with portal hypertension were randomly divided into two groups: treatment group (n = 15) and model group (n = 10). The treatment group was given recombinant rat vascular endothelial growth factor 165 (30 ng/d) via the portal vein for 2 weeks. The model group underwent only sham operation. Ten normal rats were used as normal controls. After treatment, liver histopathology was examined by light microscopy and sinusoidal ultrastructure was observed by transmission electron microscopy. The density of hepatic microvessels was detected by immunostaining of von Willebrand factor (vWF).
RESULTS: Light microscopy examination showed that hepatic fibrosis improved in the treatment group compared with the model group. Electron microscopy analysis showed decreased number of fenestrations in sinusoidal endothelial cells, basement membrane formation, and irregular hepatic sinus endothelial cells. These pathological changes were more severe in the model group than in the treatment group. Microvessel density was higher in fibrotic stroma (2.04 ± 0.61 vs 1.26 ± 0.30, P < 0.01) but lower in liver parenchyma (0.74 ± 0.05 vs 1.32 ± 0.48, P < 0.01) in the treatment group than in the model group. However, microvessel density in both liver stroma and parenchyma was higher in the treatment and model groups than in the normal control group (1.26 ± 0.30, 2.04 ± 0.61 vs 0.70 ± 0.07; 1.32 ± 0.48, 0.74 ± 0.05 vs 0.28 ± 0.08, all P < 0.05).
CONCLUSION: Exogenous administration of vascular endothelial growth factor is capable of increasing the number of microvessels in fibrotic stroma but decreasing that in liver parenchyma.
- Citation: Jiang WW, Zhao JM, Yu LL. Effect of exogenous administration of vascular endothelial growth factor on hepatic microvessel density in rats with liver cirrhosis. Shijie Huaren Xiaohua Zazhi 2011; 19(10): 1009-1014
- URL: https://www.wjgnet.com/1009-3079/full/v19/i10/1009.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i10.1009
门静脉高压(portal hypertension, PHT)是肝硬化失代偿期主要临床表现, 由此引起的上消化道出血及腹水等严重并发症[1-3], 是引起高死亡率的主要原因. 肝硬化是以缺血为特征, 由此引起微循环障碍, 导致肝脏内血管阻力增加是PHT的主要机制. 我国是慢性乙型肝炎大国, 研究肝硬化PHT的发生机制, 改善肝脏微循环状况[4], 从而降低门静脉压力, 是一种具有高可行性和价值性的研究. 本文旨在通过血管生成方法, 应用血管内皮生长因子(vascular endothelial growth factor, VEGF)干预肝硬化PHT大鼠后, 检测肝脏微血管变化, 以研究肝硬化大鼠肝脏微循环变化.
SD大鼠50只, ♂, 体质量180-220 g, 购于中国医科大学实验动物部. 硫代乙酰胺(thioacetamide, TAA)购于国药集团化学试剂有限公司. 重组大鼠血管内皮生长因子165(recombinant rat vascular endothelial growth factor 165, rr-VEGF165)购于美国PeproTech公司. 兔抗人第Ⅷ因子相关抗原(von willebrand factor, vWF)多克隆抗体, 免疫组织化学兔二步法检测试剂盒(辣根过氧化物酶)购于北京中山生物科技有限公司. 液体DAB底物显色试剂盒购于福州迈新生物技术开发公司. Alzet微渗泵(Alzet osmotic minipump, 2002型)购于美国健康医疗仪器国际公司.
1.2.1 分组及造模: 50只大鼠随机分为: 正常对照组10只(A组, n = 10), 给予正常饮水, 正常进食; 肝硬化PHT诱导组40只, 采用TAA法造模[5,6], 共成模25只, 1-5 wk使用0.03% TAA, 6-10 wk使用0.04% TAA作为其饮水, 10 wk后[7]随机将其分为肝硬化PHT对照组(B组, n = 10)和肝硬化PHT实验组(C组, n = 15), C组应用Alzet微渗泵通过门静脉将rr-VEGF165(30 ng/d)[8]持续泵入门静脉2 wk, A组及B给予开腹后关腹对照处理, 术后3 d每天肌注4万U青霉素预防感染.
1.2.2 肝纤维化病理光镜观察: 第12周末, 取各组大鼠肝左叶相同部位肝组织, 大小约1.5 cm×1.5 cm×0.5 cm于40 g/L中性甲醛固定, 常规石蜡包埋、脱水, 切片厚4 μm, 做苏木素-伊红(HE)染色, 进行肝脏组织学观察.
1.2.3 肝脏超微结构观察: 第12周末, 各组大鼠随机选取2例肝左叶相同部位新鲜肝组织, 约1 mm×1 mm×1 mm, 立即置于预冷的2.5%戊二醛中于4 ℃冰箱中固定后, 二甲砷酸钠缓冲液(pH7.3)洗2次后, 1%四氧化锇后固定、包埋、超薄切片, 然后依次染色、观察、拍照、冲片, 透射电镜观察.
1.2.4 免疫组织化学检测vWF标记微血管数目[9]: 多聚赖氨酸处理的石蜡切片脱蜡至水, PBS冲洗3×5 min, 微波抗原修复, 冷却至室温, 滴加内源性过氧化物酶阻断剂50 μL, 室温10 min, PBS冲洗3×5 min, 滴加一抗(vWF: 1:100)50 μL室温孵育60 min, PBS冲洗3×5 min, 滴加辣根过氧化物酶标记羊抗兔IgG 50 μL, 室温孵育30 min, DAB显色, 显微镜下控制显色时间, 自来水流水冲洗, 苏木素复染, 梯度酒精脱水, 二甲苯透明, 中性树胶封片. 阴性对照以PBS代替一抗. 光镜下观察染色结果, vWF标记血管染色为棕黄色, 表示阳性, 与背景同色为阴性.
1.2.5 免疫组织化学染色图片分析: 每组大鼠各随机选取5张来自不同大鼠的切片, 首先在光镜下放大100倍观察, 确定待观察区域, 后在400倍镜下每张切片连续观察10个视野, 计数每视野下vWF标记的微循环血管数目, 以平均血管数目为记录结果.
统计学处理 所有数据输入计算机建立数据库, 采用SPSS16.0软件包进行数据统计分析, 计量资料以mean±SD表示, 不同组微血管数目组间比较用方差分析(ANOVA), P<0.05有统计学意义.
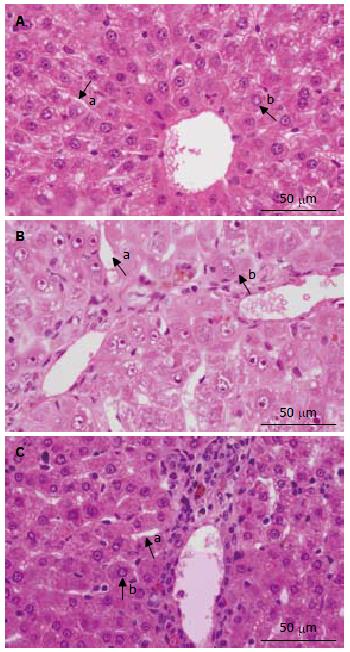
12 wk末各组大鼠肝组织行HE染色显示, A组肝脏肝细胞索排列整齐, 肝细胞直径约13 μm, 肝窦腔隙规则可见, 宽约4 μm(图1A); B组肝脏正常肝小叶结构消失或破坏而被假小叶所取代, 部分假小叶由几个不完整的肝小叶构成, 肝细胞的排列和血窦的分布极不规则, 肝细胞可有不同程度的水肿、脂肪浸润, 直径约22 μm, 肝窦腔隙扩张, 宽约6 μm(图1B); C组肝脏假小叶结构不明显, 肝细胞索排列较B组规则, 肝细胞水肿减轻, 直径约16 μm, 肝窦腔隙宽约5 μm(图1C).
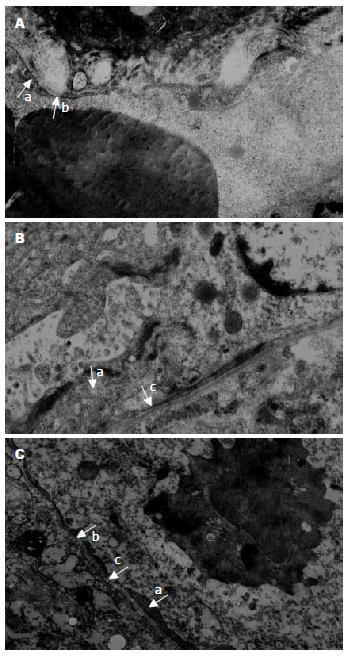
12 wk末各组大鼠肝组织标本在电镜下观察显示, A组大鼠肝窦内皮细胞扁平, 有窗孔存在, 内皮下缺乏基底膜(图2A). 在B组大鼠肝组织, 可见肝窦内皮细胞形态不规则, 增厚, 窗孔减少或缺失, 有基底膜形成(图2B). 在PHT实验组大鼠肝组织, 内皮细胞变薄, 窗孔存在但数量减少, 内皮下基底膜不连续、减少或消失(图2C).
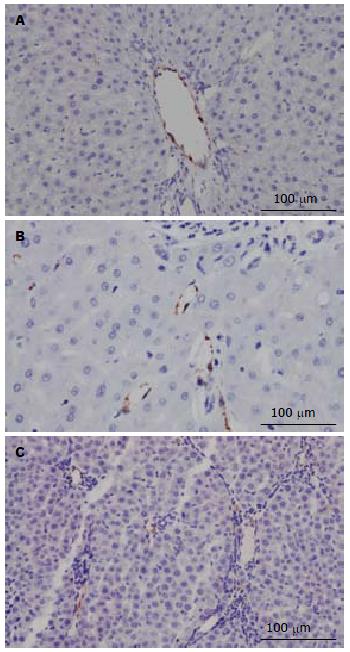
正常对照组大鼠vWF标记血管阳性表达仅见于中央静脉和汇管区门静脉血管内皮, 肝窦壁几乎未见阳性表达(图3A); B组大鼠肝组织vWF标记血管阳性表达明显增多, 在大多数纤维间隔内表达较多, 在再生的肝结节的肝窦内皮及肝小叶中央静脉附近肝窦可见较多的微血管表达(图3B). C组大鼠vWF标记血管在纤维间隔内表达较B组增多, 但在肝窦壁微血管表达较B组表达减少(图3C).
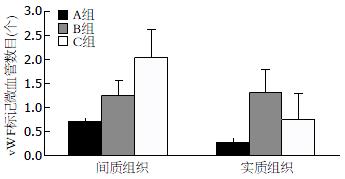
在肝脏间质纤维组织中, C组微血管数目高于B组, 两者相比差异有统计学意义(P<0.01), 且二者均高于A组(均P<0.05, 表1); 在肝脏实质组织中, C组微血管数目低于B组, 两者相比差异有统计学意义(P<0.01), 二者均高于A组(均P<0.05, 表1, 图4).
| 分组 | 间质组织微血管数目 | P值 | 实质组织微血管数目 | P值 |
| A组 | 0.70±0.07 | 0.28±0.08 | ||
| B组 | 1.26±0.30 | <0.05 | 1.32±0.48 | <0.01 |
| C组 | 2.04±0.61 | <0.01 | 0.74±0.05 | <0.01 |
肝脏的微循环是以窦状隙为中心, 包括流入窦状隙的门静脉、肝动脉末梢支及流出窦状隙的肝静脉末梢支. 良好的肝内循环能够保证肝细胞从外界获得充足的养分, 并带走代谢物质, 从而维持肝脏正常的功能[10]. 肝硬化时肝内微循环障碍, 引起门静脉血管阻力增加导致门静脉压升高是肝硬化PHT发生的重要机制. 肝纤维化、再生结节形成和肝内血管狭窄是肝硬化引起血管阻力增加的典型机制. 最新研究表明血管生成可作为门静脉分流通道"疏通"压力[4], 同时一些抑制血管生成的干预实验在临床前研究中提供了有害的证据[11,12], 改善肝硬化时血管异常可以改善肝脏微循环[13], 从而减轻肝硬化.
VEGF在促进血管生成方面的生物学作用近年受到研究者的重视[14]. VEGF诱导内皮细胞表达的生物学特点使治疗性血管生成疗法成为研究新热点[15-17]. 最近Brodsky等[18]表明在肝硬化早期阶段VEGF表达及微血管数目增加, 而在肝硬化晚期阶段VEGF及微血管数目减少, VEGF表达与血管数目呈正相关. Ueno等[19]的研究证明肝移植血管生成细胞具有治疗肝纤维化的作用和改善肝功能的作用. 国内外应用VEGF治疗PHT少见, 且大都通过大鼠尾静脉注入VEGF[20], 并已有统计学意义. 由于VEGF半衰期较短, 仅为6 min, 考虑到通过尾静脉间断注射用药难以维持稳定的有效血药浓度, 且经过体循环后影响靶器官有效药物浓度. 本实验应用Alzet微渗泵通过导管持续2 wk将rr-VEGF-A直接泵入门静脉干预大鼠肝硬化门静脉压力, 解决了VEGF半衰期短的问题, 且目前在国内外尚未见报道.
vWF是第Ⅷ因子相关抗原, 主要由血管内皮细胞合成, 并在血管基膜下与Ⅳ型胶原纤维(type Ⅳ collagen, Coll Ⅳ)构成联合体, 免疫组织化学技术中vWF及Coll Ⅳ可使血管基膜着色, 因此常被用作血管标志物计数微血管密度[21]. 最近研究表明, 肝脏疾病中vWF合成增加, 而vWF mRNA浓度在肝纤维化患者中最高, 肝组织的免疫组织化学染色证实了这一观察[22]. 郝菁华等[23]研究发现检测vWF表达可以反映肝纤维化的程度. vWF作为血管生成的直接标志物, 可反映肝纤维化形成过程中血管生成及肝窦毛细血管化[10]. 研究表明, 肝脏实质中肝窦毛细血管化能够导致肝脏微循环障碍[24].
本实验应用Alzet微渗泵通过导管将VEGF直接泵入C组大鼠门静脉, 持续2 wk后, 应用vWF标记肝脏微血管数目, 并对各组大鼠微血管数目进行半定量分析, 发现在肝脏间质组织与实质组织中各组大鼠微血管数目分布特点不同, 在肝脏间质组织中, C组大鼠微血管数目较B组增加(P<0.01), 而在肝脏实质组织中, C组较B组有明显降低(P<0.01), 在间质组织及实质组织中, B组及C组大鼠血管数目均高于A组(P<0.05). 我们的前期研究工作已经证实, 大鼠门静脉及肝动脉系统均有VEGF受体分布, VEGF受体2在内皮细胞增殖最终形成新生血管中起重要作用[25]. 本实验结果提示, 在肝硬化大鼠肝组织中微血管数目较A组增加, 表明肝硬化过程中, 由于缺血缺氧等原因导致血管的代偿性增生, 但这种增生会产生肝窦毛细血管化引起肝脏微循环异常[13]. 我们在应用VEGF进行干预后, 在肝脏间质组织中, C组大鼠vWF标记的微血管数目较B组增加, 表明肝硬化PHT治疗组应用VEGF后, VEGF与相应受体结合, 产生新生毛细血管, 形成分流通道, 能够疏通肝脏微循环[4]. 在肝脏实质组织中, C组大鼠微血管数目较B组减少, 表明外周间质组织新生血管能够穿过纤维隔代偿性增加肝实质细胞供血[20], 同时我们实验中光镜及电镜下观察肝细胞水肿减轻、肝窦腔隙变窄、基底膜变薄, 说明应用VEGF后, 肝细胞形态及功能逐渐恢复, 原有的代偿性血管增生被抑制, 肝窦毛细血管化减轻.
本实验中光镜下观察C组较B组假小叶结构减轻, 肝细胞直径变小、水肿减轻、肝窦排列较规则、腔隙变小, 表明应用VEGF治疗后, 肝脏微循环血管得到"疏通", 肝窦压力降低, 肝细胞新生及修复. 电镜下观察PHT实验组比B组肝窦内皮细胞变薄、窗孔增加、基底膜减少或消失, 提示VEGF可促进内皮细胞窗孔形成[26,27], 增加内皮细胞通透性[28], 肝脏血管阻塞减轻, 肝脏结构得到改善. 实验结果表明, 肝脏结构发生病理改变导致微循环障碍引起门静脉血管阻力增加是肝硬化PHT发生的重要机制[29], 应用VEGF后微循环改善, 肝脏组织新生重构, 使肝脏结构得到不同程度的恢复, 增加了肝细胞与肝窦的血流量, 最终使肝细胞获取更多的氧气和营养, 进一步改善肝脏功能[19,30].
本实验应用VEGF血管生成疗法检测肝硬化PHT大鼠肝组织血管数目变化, 反映肝脏微循环状况. 结果显示VEGF可使肝硬化PHT大鼠肝脏微循环得到改善, 为进一步探讨在临床中应用VEGF改善肝硬化患者微循环状况提供了实验依据.
门静脉高压是肝硬化失代偿期主要临床表现, 由此引起的上消化道出血及腹水等严重并发症是引起高死亡率的主要原因. 目前临床治疗中外科手术, 内科药物及介入手术均存在不同的风险, 且不能从根本上降低门静脉压力.
高润平, 教授, 吉林大学第一医院肝病科
肝硬化是以缺血为特征, 由此导致肝脏微循环障碍, 从而引起一系列临床症状和体征. 近年来血管生成疗法成为研究热点, 旨在通过血管生成以改善肝脏的微循环状态.
Brodsky等表明在肝硬化早期阶段VEGF表达及微血管数目增加, 而在肝硬化晚期阶段VEGF及微血管数目减少, VEGF表达与血管数目呈正相关.
本文综合分析考虑应用外源性血管内皮生长因子(VEGF), 半衰期短, 只有6 min, 且不能过长时间应用, 否则将导致血管过度增生, 引起不良反应, 本实验应用了Alzet微渗泵持续通过大鼠门静脉泵入VEGF 2 wk, 解决了以上问题, 目前国内外尚未见报道.
本实验结果表明, 应用外源性血管内皮生长因子可以改善肝硬化大鼠肝脏微循环, 对于临床探讨应用血管生成疗法对肝硬化门脉高压进行治疗具有实际意义.
本文科学性较好, 对于临床探讨肝硬化门静脉高压的治疗具有实际意义.
编辑: 曹丽鸥 电编:何基才
| 1. | Møller S, Bendtsen F. [Portal pressure should be measured on suspicion of portal hypertension]. Ugeskr Laeger. 2010;172:3411-3413. [PubMed] |
| 2. | Dittrich S, Mattos AA, Mattos AZ, Alves AV, Araújo FB. [Relationship between portal pressure gradient and ascites in cirrhotic patients]. Arq Gastroenterol. 2010;47:174-177. [PubMed] [DOI] |
| 3. | Povero D, Busletta C, Novo E, di Bonzo LV, Cannito S, Paternostro C, Parola M. Liver fibrosis: a dynamic and potentially reversible process. Histol Histopathol. 2010;25:1075-1091. [PubMed] |
| 4. | Thabut D, Shah V. Intrahepatic angiogenesis and sinusoidal remodeling in chronic liver disease: new targets for the treatment of portal hypertension? J Hepatol. 2010;53:976-980. [PubMed] [DOI] |
| 8. | Nicoletti JN, Shah SK, McCloskey DP, Goodman JH, Elkady A, Atassi H, Hylton D, Rudge JS, Scharfman HE, Croll SD. Vascular endothelial growth factor is up-regulated after status epilepticus and protects against seizure-induced neuronal loss in hippocampus. Neuroscience. 2008;151:232-241. [PubMed] [DOI] |
| 10. | Vollmar B, Menger MD. The hepatic microcirculation: mechanistic contributions and therapeutic targets in liver injury and repair. Physiol Rev. 2009;89:1269-1339. [PubMed] [DOI] |
| 11. | Stockmann C, Kerdiles Y, Nomaksteinsky M, Weidemann A, Takeda N, Doedens A, Torres-Collado AX, Iruela-Arispe L, Nizet V, Johnson RS. Loss of myeloid cell-derived vascular endothelial growth factor accelerates fibrosis. Proc Natl Acad Sci U S A. 2010;107:4329-4334. [PubMed] [DOI] |
| 12. | Patsenker E, Popov Y, Stickel F, Schneider V, Ledermann M, Sägesser H, Niedobitek G, Goodman SL, Schuppan D. Pharmacological inhibition of integrin alphavbeta3 aggravates experimental liver fibrosis and suppresses hepatic angiogenesis. Hepatology. 2009;50:1501-1511. [PubMed] [DOI] |
| 13. | Bosch J, Abraldes JG, Fernández M, García-Pagán JC. Hepatic endothelial dysfunction and abnormal angiogenesis: new targets in the treatment of portal hypertension. J Hepatol. 2010;53:558-567. [PubMed] [DOI] |
| 14. | Chen J, Braet F, Brodsky S, Weinstein T, Romanov V, Noiri E, Goligorsky MS. VEGF-induced mobilization of caveolae and increase in permeability of endothelial cells. Am J Physiol Cell Physiol. 2002;282:C1053-C1063. [PubMed] |
| 15. | Nagy JA, Feng D, Vasile E, Wong WH, Shih SC, Dvorak AM, Dvorak HF. Permeability properties of tumor surrogate blood vessels induced by VEGF-A. Lab Invest. 2006;86:767-780. [PubMed] |
| 16. | Ballermann BJ. Contribution of the endothelium to the glomerular permselectivity barrier in health and disease. Nephron Physiol. 2007;106:p19-p25. [PubMed] [DOI] |
| 17. | Bokeriya LA, Golukhova EZ, Eremeeva MV, Aslanidi IP, Merzlyakov VY, Georgiev GP, Kiselev SL, Berishvili II, Vakhromeeva MN, Serov RA. Use of human VEGF(165) gene for therapeutic angiogenesis in coronary patients: first results. Bull Exp Biol Med. 2005;140:106-112. [PubMed] [DOI] |
| 18. | Brodsky SV, Mendelev N, Melamed M, Ramaswamy G. Vascular density and VEGF expression in hepatic lesions. J Gastrointestin Liver Dis. 2007;16:373-377. [PubMed] |
| 19. | Ueno T, Nakamura T, Torimura T, Sata M. Angiogenic cell therapy for hepatic fibrosis. Med Mol Morphol. 2006;39:16-21. [PubMed] [DOI] |
| 22. | Hollestelle MJ, Geertzen HG, Straatsburg IH, van Gulik TM, van Mourik JA. Factor VIII expression in liver disease. Thromb Haemost. 2004;91:267-275. [PubMed] |
| 26. | Pandya NM, Dhalla NS, Santani DD. Angiogenesis--a new target for future therapy. Vascul Pharmacol. 2006;44:265-274. [PubMed] [DOI] |
| 27. | Perry BN, Arbiser JL. The duality of angiogenesis: implications for therapy of human disease. J Invest Dermatol. 2006;126:2160-2166. [PubMed] [DOI] |
| 28. | Grover TR, Parker TA, Markham NE, Abman SH. rhVEGF treatment preserves pulmonary vascular reactivity and structure in an experimental model of pulmonary hypertension in fetal sheep. Am J Physiol Lung Cell Mol Physiol. 2005;289:L315-L321. [PubMed] [DOI] |
| 29. | 吕 立权, 李 松华. 肝窦内皮细胞与门静脉高压. 国外医学•消化系疾病分册. 2002;22:100-102. |
| 30. | Xu H, Shi BM, Lu XF, Liang F, Jin X, Wu TH, Xu J. Vascular endothelial growth factor attenuates hepatic sinusoidal capillarization in thioacetamide-induced cirrhotic rats. World J Gastroenterol. 2008;14:2349-2357. [PubMed] [DOI] |