修回日期: 2011-02-18
接受日期: 2011-03-02
在线出版日期: 2011-04-08
目的: 建立及改良符合我国萎缩性胃炎(atrophic gastritis, AG)发病特点的大鼠模型并对模型进行评价.
方法: 健康、清洁级、♂、Wistar大鼠51只, 随机分为空白对照组(10只), 假手术组(10只), 造模2 mo组(10只), 造模3 mo组(10只), 造模4 mo组(11只), 空白组大鼠常规饲养, 待造模组大鼠手术完成后, 生理盐水灌胃2次/wk, 共4 wk. 假手术组手术过程同造模组但不植入弹簧, 术后生理盐水灌胃2次/wk, 共4 wk. 造模2、3、4 mo组行弹簧幽门植入术后, 予高盐热淀粉糊灌胃2次/wk, 分别在灌胃2、3、4 mo末取材, 放射免疫法测定灌胃4 mo末时血清PGE2、胃泌素(gastrin)水平, HE染色法连续观察灌胃2、3、4 mo时胃黏膜的病理变化.
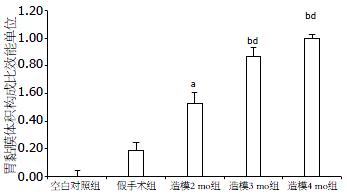
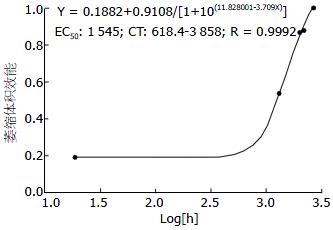
结果: 造模4 mo时, 与空白对照组和假手术组比较, 其血清PGE2、gastrin水平均明显下降(P<0.05或0.01), 造模组胃黏膜符合AG表现, 且病变随造模时间延长逐渐加重; 与空白对照组比较, 假手术组、造模2、3、4 mo组的胃黏膜体积构成比依次降低3.30%(P>0.05)、9.82%(P<0.05)、17.28%(P<0.01)、20.44%(P<0.01); 胃黏膜体积构成比效能单位由低到高为空白对照组(0.000), 假手术组(0.1884), 模型2 mo组(0.527), 模型3 mo组(0.868), 模型4 mo组(1.000), 胃黏膜萎缩效能(Y, 体积变化相对百分百)与对数造模时间(X, h)的时效曲线方程为Y=0.1882+0.9108/[1+10(11.828001-3.709X)](R = 0.9992), 胃黏膜萎缩半效时间为1 545 h(95%CI: 618.4 h-3 858 h), 约2 mo.
结论: 采用弹簧幽门植入术配合高盐热淀粉糊灌胃法制备的大鼠AG模型, 符合长期胆汁反流、饮食过热过咸造成的AG, 是一种符合我国人群AG发病特点、稳定而便捷的大鼠AG模型.
引文著录: 史瑞, 李晓红, 方蕾, 李健, 蔡大勇, 李军祥, 刘礼剑. 弹簧幽门植入术结合高盐热淀粉糊灌胃诱导大鼠萎缩性胃炎模型的方法及评价. 世界华人消化杂志 2011; 19(10): 1001-1008
Revised: February 18, 2011
Accepted: March 2, 2011
Published online: April 8, 2011
AIM: To establish a novel rat model of atrophic gastritis according to the characteristics of the disease in Chinese patients.
METHODS: Fifty-one healthy male Wistar rats were randomized into five groups: control group (n = 10), sham operation group (n = 10), 2-mo model group (n = 10), 3-mo model group (n = 10), and 4-mo model group (n = 11). Atrophic gastritis was induced in rats of the three model groups by implanting a spring into the pylorus and intragastrically administering hot salty starch paste. The control group did not underwent any operation and was treated with saline twice a week, i.g., for 4 wk, while the sham operation group underwent the same operation as model rats except for spring implantation and was treated with saline for the same duration. Serum levels of PGE2 and gastrin were measured by radioimmunoassay. Pathological assessment of gastric changes was performed after intragastric administration.
RESULTS: Serum levels of PGE2 and gastrin in the 4-mo model group were lower than those in the control and sham operation groups (all P < 0.05 or 0.01). All the rats of the model groups had histological manifestations in gastric mucosa mimicking atrophic gastritis. These pathological changes deteriorated in a time-dependent manner. The 4-mo model group had the highest constituent ratio of gastric mucosal volume (relative to the control group), followed by the 3- and 2-mo model groups and sham operation group (20.44%, 17.28%, 9.82 %, 3.30 %). The 4-mo model group also had the highest potency unit of gastric mucosa volume, followed by the 3- and 2-mo model groups, sham operation group and control group (1.000, 0.868, 0.527, 0.1884, 0.000). Time-response curve equation of gastric mucosa atrophy potency (Y, volume change relative percentage) and logarithmic time required to induce model (X, h) was Y = 0.1882+0.9108/[1+10(11.828001-3.709X)] (R = 0.9992), and half atrophy time was 1 545 h (95% CI: 618.4 h -3 858 h) (approximately 2 mo).
CONCLUSION: A rat model of atrophic gastritis was successfully established by implanting a spring into the pylorus and intragastrically administering hot salty starch paste.
- Citation: Shi R, Li XH, Fang L, Li J, Cai DY, Li JX, Liu LJ. Development of a rat model of atrophic gastritis by implantation of a spring into the pylorus in combination with intragastric administration of hot salty starch paste. Shijie Huaren Xiaohua Zazhi 2011; 19(10): 1001-1008
- URL: https://www.wjgnet.com/1009-3079/full/v19/i10/1001.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i10.1001
萎缩性胃炎(atrophic gastritis, AG)是消化系统的常见病和疑难病之一, 由于AG调整患病率与胃癌调整死亡率呈明显正相关[1], 研究逆转AG的方法对预防胃癌的发生具有非常重要的意义, 故亟待建立一种稳定、便捷、符合我国人群AG发病特点的AG动物模型, 这是进一步深入研究该领域的基础. 我国人群AG多见B型萎缩, 即以胃窦黏膜萎缩为主, 胃体无明显萎缩, 而以自身免疫为基础的A型AG只有少数病例报道, 且极少数中重度AG患者经长期的演变可发展成胃癌[2]. 目前AG的动物模型主要有: (1)生物法: 如幽门螺杆菌(Helicobacter pylori, H.pylori)感染造模法[3-6]; (2)免疫法: 如主动免疫法[7]; (3)化学刺激法: 如水杨酸钠[8]、氨水[9]、去氧胆酸钠[10]、阿司匹林[11]、致癌剂[12-14]、乙醇[13]、雷尼替丁[12,14]、热盐水[15]灌胃; (4)放射法, 如运用放射元素60Co分次照射腹部[16]; (5)胃肠吻合术法[17,18]; (6)基因工程法[19,20]. 但大多耗时较长, 造模时间大多在6 mo以上; 有些模型并不符合AG临床发病特点, 如以N-甲基-N'-硝基-N-亚硝基胍(N-methyl-N'-nitro-N-nitrosoguanidine, MNNG)诱导的AG模板致癌率过高, 主动免疫法制备的自身免疫型AG不符合我国AG患者发病特点. 故研究一种符合我国人群AG患病特点, 且稳定、便捷的动物模型很有必要. 本AG模型的造模方法从1993年开始摸索, 经过多次改进, 逐步摸索而成[21-25]. 本模型采用幽门弹簧植入术配合高盐热淀粉糊灌胃造模, 符合长期胆汁反流、过多摄入过热过咸食物而致AG的特点. 本次实验在造模过程中动态观察胃黏膜病理, 旨在摸索该模型的最适造模时间、稳定性和血清学特点, 为今后更深入研究AG奠定坚实的基础.
Wistar大鼠51只, ♂, 体质量200 g±20 g, 清洁级, 由北京维通利华实验动物技术有限公司提供, 实验动物许可证编号: SCXK(京)2006-0009. 大鼠饲养于清洁级实验室, 恒温(20 ℃±1 ℃)恒湿(50%-60%), 分笼饲养, 常规喂养清洁级标准颗粒饲料, 自由饮用除菌水. 前列腺素E2(prostaglandin E2, PGE2)放射免疫测定试剂盒(北京华英生物技术研究所)、胃泌素(gastrin)放射免疫测定试剂盒(北京华英生物技术研究所). 活性金属环型165宫内节育器(上海医用缝合针厂); 氯化钠(分析纯, 北京化工厂); 可溶性淀粉(分析纯, 天津福晨化学试剂厂); 温度计; 防干烧电热杯; 分析天平(上海精密科学仪器有限公司天平仪器厂制造, 型号JA2003N); r-911全自动放免计数仪(中国科技大学实业总公司生产); SLEE MTM-全密闭真空组织处理机; SLEE石蜡切片机; 蔡司荧光正置显微镜(型号AXIO IMAGER A1)系统.
1.2.1 AG模型制备: (1)制备幽门弹簧: 将活性金属环型165宫内节育器中硅橡胶和铜丝去掉, 拉直, 使弹簧螺距约0.02-0.03 cm, 并剪成约2 cm长的小段弹簧, 将该小段弹簧的两边断端弯入弹簧内, 确保其两端光滑, 不损伤胃黏膜. 所有弹簧高温蒸汽(137.3 kPa, 120 ℃, 30 min)灭菌后备用; (2)弹簧幽门植入术: 将♂Wistar大鼠(体质量240-260 g)禁食不禁水16 h后, 称质量, 以3.5%(10 mL/kg)的水合氯醛腹腔注射麻醉, 固定大鼠四肢及头部, 在无菌条件下开腹, 暴露胃, 在腺胃胃前壁距幽门环0.2 cm无或少血管处切一小口, 将一长约2 cm, 直径约0.2 cm的金属弹簧前1/3插过其幽门环进入十二指肠, 用缝线将弹簧两端及中央固定, 按手术常规逐层缝合胃及腹壁切口. 手术后禁食不禁水24 h, 连续3 d予青霉素(每只40万U/d)腹腔注射, 预防术后感染, 恢复性饲养1 wk; (3)药物造模方法: 术后第2周开始药物造模. 给予高盐热淀粉糊(含15%氯化钠, 25%可溶性淀粉, 60-70 ℃)灌胃, 每只2 mL/d; 每周2次(周二、周五), 连续4 mo.
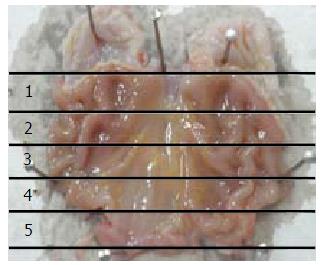
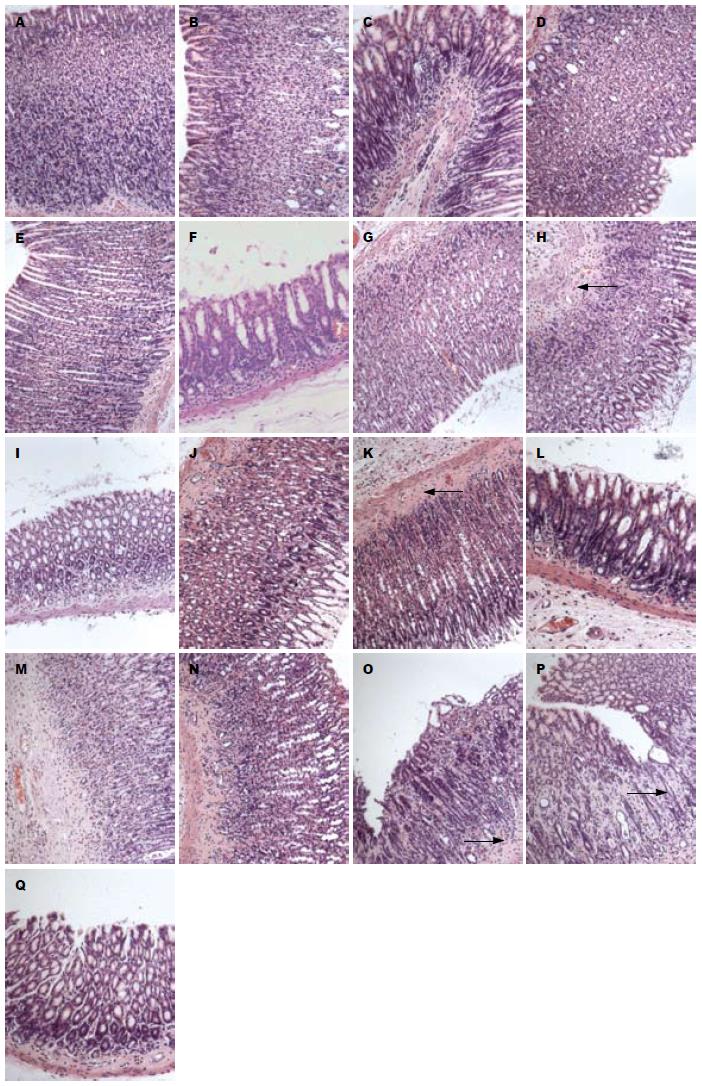
1.2.2 取材: (1)血清: 分别在造模2 mo末、3mo末、4 mo末随机抽取10只大鼠和相应的空白组、假手术组大鼠, 常规麻醉, 腹主动脉取血, 室温静置1 h以上, 常温3 000 r/min离心10 min, 取血清备用; (2)胃组织: 取血后, 沿贲门、幽门剪开, 取出胃, 沿胃大弯剪开, 用自来水冲洗干净后, 取幽门与前胃与腺胃交界线连线的2/5部分(图1, 4号码所示区域为取材部位), 40 g/L中性甲醛固定24 h后换成PBS后备用.
1.2.3 放射免疫法测定: 运用放射免疫法测定大鼠血清中PGE2、胃泌素的水平.
1.2.4 肉眼观察: 按动物病理解剖规范, 观察记录标本的大体形态和解剖病变.
1.2.5 苏木素-伊红染色及形态计量: 常规梯度酒精脱水, 石蜡包埋, 6 μm切片, HE染色, 20倍物镜下光镜观察质控苏木素分化时间(4 s最清晰), 光镜下观察记录的组织结构和细胞病变. 针对模型动物病变, 各组10倍物镜下随机采图10张, 使用Image-Pro Plus6.0图像分析系统, 对胃黏膜体积构成比进行形态计量; Prism软件计算取材部位所代表胃黏膜萎缩效能(Y, 体积变化相对百分百)与对数造模时间(X, h)的时效曲线方程, 得出胃黏膜萎缩半效时间.
统计学处理 计量资料采用mean±SD表示, 采用单因素方差分析, 数据采用SPSS16.0统计软件包进行统计分析.
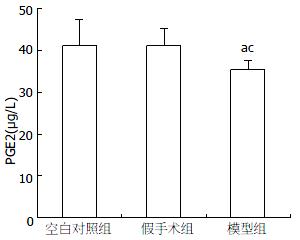
2.1.1 PGE2: 弹簧幽门植入术后高盐热淀粉糊灌胃4 mo即为模型组, 模型组血清中PGE2水平明显低于空白对照组(F = 4.34, P = 0.018)和假手术组(F = 4.34, P = 0.019, 表1, 图2).
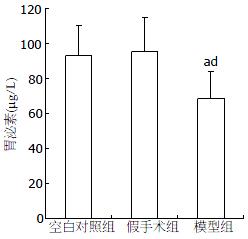
2.1.2 胃泌素: 弹簧幽门植入术后高盐热淀粉糊灌胃4 mo即为模型组, 模型组血清中胃泌素水平明显低于空白对照组(F = 5.856, P = 0.011)和假手术组(F = 5.856, P = 0.005, 表1, 图3).
空白对照组和假手术组: 前胃无明显变化, 腺胃黏膜被覆较多黏液; 模型组: 前胃无明显变化, 腺胃黏膜表面黄染, 胃窦小弯侧及其邻近前后壁黏膜皱襞略显平坦, 胃小凹密度增加, 肌层明显增厚(表2).
| 分组 | n | 黏膜变薄 | 瘀点 | 溃疡 |
| 空白对照组 | 10 | 0 | 0 | 0 |
| 假手术组 | 10 | 0 | 0 | 0 |
| 造模2 mo组 | 10 | 5 | 0 | 0 |
| 造模3 mo组 | 10 | 10 | 4 | 0 |
| 造模4 mo组 | 11 | 11 | 5 | 2 |
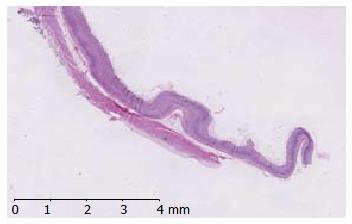
大鼠胃组织结构清楚. 取材、固定、切片、染色等技术操作合格; 无组织缺失. 按照胃大弯、胃大弯与胃小弯之间、胃小弯的顺序观察(图4). (1)空白对照组: 正常胃黏膜, 胃黏膜分为上皮、固有层、黏膜肌层, 层次分明, 结构清晰; 固有层胃底腺主细胞、壁细胞结构正常(图5A, B, C); (2)假手术组: 正常胃黏膜, 胃黏膜分为上皮、固有层、黏膜肌层, 层次分明, 结构清晰; 固有层胃底腺主细胞、壁细胞结构正常(图5D, E, F); (3)模型2 mo组: 10倍物镜下, 从黏膜肌层到被覆上皮的腺体厚度变薄, 腺腔扩大而腺体变小, 腺腔内容物质稀薄, 黏膜肌层轻度增厚, 并向固有层伸延. 40倍物镜下, 被覆上皮可找到杯状细胞样细胞和刷状缘明显的小肠样柱状上皮, 管状腺体体部的壁细胞和主细胞减少; 固有层和黏膜下层有浆细胞与淋巴细胞散在浸润, 很少见到淋巴滤泡样结构(图5G, H, I); (4)模型3 mo组: 病变随造模时间有加重的趋势, 10倍物镜下, 从黏膜肌层到被覆上皮的腺体厚度变薄, 腺腔扩大而腺体变小, 腺腔内容物质稀薄, 黏膜肌层及黏膜下层增厚且血管有不同程度玻璃样变; 40倍物镜下, 管状腺体体部的壁细胞和主细胞显著减少, 管状腺体颈部的未分化细胞数量有增多趋势, 管状腺体底部的增生细胞构成比有增大趋势; 固有层和黏膜下层有浆细胞与淋巴细胞散在浸润, 很少见到淋巴滤泡样结构(图5J, K, L); (5)模型4 mo组: 与模型3 mo组病变程度相似. 病变随造模时间有加重的趋势. 10倍物镜下, 从黏膜肌层到被覆上皮的腺体厚度显著变薄, 腺腔扩大而腺体变小, 腺腔内容物质稀薄, 黏膜肌层及黏膜下层增厚且血管玻璃样变明显; 40倍物镜下, 管状腺体体部的壁细胞和主细胞显著减少, 管状腺体颈部的未分化细胞数量有增多趋势, 管状腺体底部的增生细胞构成比有增大趋势; 固有层和黏膜下层见浆细胞与淋巴细胞浸润(图5M, N, O, P, Q).
针对模型动物病变, 各组10倍物镜下随机采图10张, 使用Image-Pro Plus图像分析系统, 对胃黏膜体积构成比进行形态计量.
2.4.1 胃黏膜体积构成比: 与空白组比较, 假手术组、造模2、3、4 mo组的胃黏膜体积构成比依次降低3.30%(P>0.05)、9.82%(P<0.05)、17.28%(P<0.01)、20.44%(P<0.01). 与假手术组比较, 造模2、3、4 mo组的胃黏膜体积构成比依次降低6.31%(P>0.05)、13.53%(P<0.01)、16.59%(P<0.01). 与模型2 mo组比较, 模型3、4 mo组的胃黏膜体积构成比依次降6.79%(P>0.05)、9.67%(P>0.05). 与模型3 mo组比较, 模型4 mo组的胃黏膜体积构成比降低2.70%(P>0.05, 表3, 图6).
2.4.2 效能单位: 效能单位数据分析结果表明: 胃黏膜体积构成比效能单位由低到高为空白组(0.000)、假手术组(0.1884)、模型2 mo组(0.527)、模型3 mo组(0.868)、模型4 mo组(1.000)(图6).
2.4.3 时效曲线: Prism软件计算取材部位所代表胃黏膜萎缩效能(Y, 体积变化相对百分百)与对数造模时间(X, h)的时效曲线方程为Y = 0.1882+0.9108/[1+10(11.828001-3.709X)](R = 0.9992), 胃黏膜萎缩半效时间为1 545 h(95%CI: 618.4 -3 858 h), 约为2 mo(图7).
依据Correa等提出了肠型胃癌的发病模式: AG→肠上皮化生(intestinal metaplasia, IM)→异型增生(dysplasia, Dys)→浸润性癌[26,27], AG属胃癌前状态, 其发生与胃癌发生的高危因素相似, 治疗AG是胃癌二级预防的重要组成部分, 故建立一种符合我国AG发病特点、稳定、便捷的动物模型是进行AG防治研究的基础, 降低胃癌发病率的有效途径.
AG发病与幽门螺杆菌(Helicobacter pylori, H.pylori)感染、高盐高热饮食、胆汁反流等相关. 经常吃过热的食物可损伤消化道黏膜, 过热饮食是胃炎的重要的致病原因之一, 同时过热饮食刺激和损伤消化道黏膜可导致其细胞癌变[28], 实验室研究发现60-80 ℃的热水可导致动物胃黏膜损伤[29]. 故本实验灌胃温度为60-70 ℃. 高浓度的氯化钠能破坏胃黏膜屏障和延长胃排空时间, 间接促进致癌物进入胃黏膜上皮靶细胞, 直接损伤胃黏膜上皮, 导致上皮再生性增殖, 故高盐饮食既是帮助致癌物渗透的辅助致癌因素, 也是促进癌变细胞增殖的促癌因素[28]. 摄入盐或用盐加工的食物可以促进胃癌的发生, 平时喜欢食盐或者喜欢食用用盐加工肉类的人的胃癌发生率高出普通人群的3倍, 高盐饮食作为胃恶性疾病的促进因素已经广泛地应用于胃癌及癌前病变模型制作过程[30], 本实验采用15%氯化钠溶液灌胃, 模拟高盐饮食习惯. 同时在灌胃溶液中加入25%的可溶性淀粉, 不仅可以使灌胃溶液在胃内停留时间延长, 强化灌胃溶液对胃黏膜的损伤, 更重要的是, Kato等[31]研究发现增加淀粉类蔬菜的摄入, 使癌前病变进展加速, 淀粉类蔬菜在肠化生及胃萎缩方面影响较大, 游伟程等[28]在山东省临朐县进行的人群对照也研究发现, 高淀粉食物可能增加胃癌的危险性, 故在灌胃液中掺入淀粉, 不仅仅是辅助作用, 而是AG形成的一个独立的刺激因素. 临床中发现一部分AG患者并无H.pylori感染, 但胃镜下可见胆汁反流. 胆汁反流与胃黏膜腺体萎缩和IM呈正相关, 是胃癌发生的启动因素之一[32,33]. 其机制与连续诱导SHP和CDX1转录, 使COX-2基因表达上调相关[34]. 本实验采用手术法将弹簧由胃穿过幽门进入十二指肠后固定, 强制使幽门括约肌功能失常, 导致持续胆汁反流. 所以本模型的刺激因素包括高热、高盐、淀粉、胆汁反流、弹簧刺激等多种因素, 符合我国一部分人群AG的发病特点. 不仅如此, 本次实验在前几次实验的基础上做出若干改进, 使本手术成功率显著提高, 更有利于推广. 具体改进如下: (1)改变弹簧制作方法: 原来制备弹簧为将避孕环彻底拉成直线后手工缠绕而成, 这样制作的弹簧直径大小不好控制, 本次实验直接轻微拉直避孕环, 使螺距为0.2-0.3 mm, 这样的弹簧直径均为避孕环出厂的直径0.2 mm, 大小统一且表面光滑, 对大鼠的物理刺激明显减小, 故出现胃黏膜溃疡糜烂的数量和比例显著减少, 模型组大部分胃黏膜发白, 无明显糜烂红肿等急性炎症病变, 更符合人类AG特点. 而且弹簧在造成胆汁反流的同时, 其直径大小足以通过胃内容物, 100%不发生梗阻, 大鼠大便通畅; (2)放入弹簧前用无菌纱布将胃壁开口包紧, 将胃内容物全部排空到无菌纱布上, 严禁胃内容物流入腹腔引起腹膜炎, 使术后腹膜炎发生率下降至2%. 经过以上改进, 大鼠术后成活率达97%以上. 由于弹簧直径较前减小, 三处缝线在胃酸及胃蛋白酶的作用下逐渐被消化, 术后2 mo时50%的弹簧已经脱落, 术后4 mo弹簧脱落率约为100%, 进入治疗期后弹簧物理支撑及刺激的作用完全消除, 所有胃黏膜损伤因素消除, 功能异常的幽门括约肌在药物的治疗作用下逐渐恢复, 这与以前弹簧即使在治疗阶段也无法除去相比是一个进步.
在模型评价方面, 我们采用了动态分析方法, 从造模2 mo开始每个月取10只进行形态学评价, 并借用药理学的公式算出半数萎缩有效时间, 建立胃黏膜萎缩效能与对数造模时间的时效曲线方程, 使研究者对该模型病理的进展更加清晰可控. 如果将术后灌胃4 mo的大鼠萎缩效能设为1, 空白组大鼠胃黏膜萎缩效能设为0, 那么在术后灌胃2 mo时大鼠胃黏膜萎缩效能达到0.5, 得出胃黏膜萎缩半效时间为2 mo.
PGE2保护胃黏膜的作用机制几乎涉及了与黏膜损伤可能有关的所有因素[35]: (1)增加胃黏膜血流; (2)促进胃黏液和碳酸氢根的分泌; (3)刺激胃基底细胞向表面迁移, 促进细胞更新, 加快胃黏膜修复; (4)提高胃黏膜磷脂含量, 防止水溶性攻击因子对黏膜的损害; (5)可介导适应性细胞保护作用[36]. 本AG模型血清PGE2水平显著低于空白对照组, 说明该模型的制备方法干扰了胃黏膜保护因子PGE2的合成或释放, 其具体机制有待于进一步研究.
胃泌素是由胃窦G细胞分泌的胃肠激素, 90%以上为17肽的蛋白, AG患者胃窦黏膜萎缩, G细胞的数量减少, 胃泌素的分泌也下降[37], 在其他刺激因素下, 胃泌素的分泌不增加或增加不多[38], 低血清胃泌素是胃窦AG的生物标志[39], 故血清胃泌素的分泌可反映胃黏膜萎缩的情况[40]. 本大鼠AG模型的血清胃泌素水平显著低于空白对照组和假手术组, 这一特点与其他AG大鼠模型的结果相似[41,42].
总之, 幽门弹簧植入术配合高盐热淀粉糊灌胃法制作的AG大鼠模型以胃窦黏膜萎缩为主, 其血清PGE2、胃泌素水平低于正常大鼠, 符合我国人群AG发病特点. 该模型综合了高热、高盐、高淀粉、胆汁反流、弹簧物理刺激等多种因素, 各因素之间相互作用大大缩短了单一造模所需的时间, 其萎缩半效时间为术后2 mo, 继续造模至4 mo, 胃黏膜全部萎缩, 未见典型的IM及上皮内瘤变, 模型造模成功率达96%, 是一种稳定、便捷的AG大鼠模型.
萎缩性胃炎属慢性胃炎, 是消化系统的常见病和疑难病之一, 也是常见的胃癌前疾病之一.
陈治水, 主任医师, 中国人民解放军第211医院中医科
研究符合我国人群AG发病特点且稳定便捷的一系列动物模型是目前研究的热点. 通过模拟胆汁反流、进食高热高盐食物来制备AG动物模型也是众多研究者探索的热点.
Kato等研究发现增加淀粉类蔬菜的摄入, 使癌前病变进展加速, 淀粉类蔬菜在肠化生及胃萎缩方面影响较大.
目前符合中国人群AG发病特点、便捷稳定的动物模型较少, 本模型模拟了人体长期胆汁反流, 饮食过热、过咸造成的AG, 其血清PGE2和胃泌素的水平符合人AG发病特点, 而且通过连续取材, 对不同造模时间模型的胃黏膜的形态学进行量化观察, 并找到萎缩半效时间, 使该模型的稳定性提高, 可控性增强, 减少造模周期.
本AG模型可以用于研究针对胆汁反流、饮食过热过咸造成的萎缩性胃炎的药效学评价.
胃黏膜萎缩: 胃黏膜固有腺体丧失, 分为非化生性萎缩和化生性萎缩, 前者特点是腺体丧失伴黏膜固有层中纤维化或纤维肌性增生, 后者特点是胃黏膜正常的腺体被化生的腺体所替换.
本文设计合理, 结果真实, 对于推动消化病学的实验研究工作有重要的意义.
编辑: 李军亮 电编:李薇
| 3. | Yokota K, Kurebayashi Y, Takayama Y, Hayashi S, Isogai H, Isogai E, Imai K, Yabana T, Yachi A, Oguma K. Colonization of Helicobacter pylori in the gastric mucosa of Mongolian gerbils. Microbiol Immunol. 1991;35:475-480. [PubMed] |
| 4. | 张 占海, 杨 丽彩, 危 北海, 刘 晋生, 赵 敏. 建立萎缩性胃炎幽门螺旋杆菌感染动物模型的方法. 中国中西医结合脾胃杂志. 1996;4:46-47. |
| 10. | 赵 敏, 张 占海, 危 北海, 刘 晋生, 杨 丽彩. 胃安素防治慢性萎缩性胃炎及胃癌前病变的实验病理研究. 中国中西医结合脾胃杂志. 1996;4:225-229. |
| 13. | 崔 儒涛, 蔡 淦, 陈 莲芳, 周 敏, 尉 萍萍, 尹 兆宝, 林 江, 孙 克兴, 杨 秋泓, 孙 文善. 养胃冲剂对大鼠慢性萎缩性胃炎治疗作用的实验研究. 中国中医药科技. 1998;5:142-143. |
| 16. | 李 春越, 施 新猷, 周 绍娟, 张 经济, 任 登先, 桂 郁富, 巴 善铎, 孙 桂华, 李 兴培, 孙 起文. 胃尔康治疗慢性萎缩性胃炎的临床及实验研究. 中国中西医结合杂志. 1995;15:21-24. |
| 19. | Wang TC, Dangler CA, Chen D, Goldenring JR, Koh T, Raychowdhury R, Coffey RJ, Ito S, Varro A, Dockray GJ. Synergistic interaction between hypergastrinemia and Helicobacter infection in a mouse model of gastric cancer. Gastroenterology. 2000;118:36-47. [PubMed] [DOI] |
| 20. | Hahm KB, Lee KM, Kim YB, Hong WS, Lee WH, Han SU, Kim MW, Ahn BO, Oh TY, Lee MH. Conditional loss of TGF-beta signalling leads to increased susceptibility to gastrointestinal carcinogenesis in mice. Aliment Pharmacol Ther. 2002;16 Suppl 2:115-127. [PubMed] [DOI] |
| 24. | 石 雪迎, 赵 凤志, 戴 欣, 马 连生, 董 秀云, 方 杰. 复方健脾益胃胶囊对大鼠慢性萎缩性胃炎胃黏膜形态与血流量的影响. 世界华人消化杂志. 1998;6:1068-1072. [DOI] |
| 25. | 张 玉禄, 李 军祥, 鲁 香凤, 戴 欣, 朱 陵群, 尹 军祥, 孙 海芸. 幽门弹簧插入配合高盐热糊灌胃复制大鼠慢性萎缩性胃炎癌前病变模型形态学观察及早期细胞凋亡分析. 中华中医药杂志. 2008;23:693-696. |
| 26. | Correa P. A human model of gastric carcinogenesis. Cancer Res. 1988;48:3554-3560. [PubMed] |
| 29. | Graham DY, Abou-Sleiman J, el-Zimaity HM, Badr A, Graham DP, Malaty HM. Helicobacter pylori infection, gastritis, and the temperature of choice for hot drinks. Helicobacter. 1996;1:172-174. [PubMed] [DOI] |
| 30. | Dregval L, Zickute J, Strumylaite L, Dudzevicius J. Associations between gastric cancer and dietary exposures. Epidemiology. 2006;17:S137. [DOI] |
| 31. | Kato I, Vivas J, Plummer M, Lopez G, Peraza S, Castro D, Sanchez V, Cano E, Andrade O, Garcia R. Environmental factors in Helicobacter pylori-related gastric precancerous lesions in Venezuela. Cancer Epidemiol Biomarkers Prev. 2004;13:468-476. [PubMed] |
| 32. | Sobala GM, O'Connor HJ, Dewar EP, King RF, Axon AT, Dixon MF. Bile reflux and intestinal metaplasia in gastric mucosa. J Clin Pathol. 1993;46:235-240. [PubMed] [DOI] |
| 33. | Dixon MF, Mapstone NP, Neville PM, Moayyedi P, Axon AT. Bile reflux gastritis and intestinal metaplasia at the cardia. Gut. 2002;51:351-355. [PubMed] [DOI] |
| 34. | Park MJ, Kim KH, Kim HY, Kim K, Cheong J. Bile acid induces expression of COX-2 through the homeodomain transcription factor CDX1 and orphan nuclear receptor SHP in human gastric cancer cells. Carcinogenesis. 2008;29:2385-2393. [PubMed] [DOI] |
| 37. | Germaná B, Di Mario F, Cavallaro LG, Moussa AM, Lecis P, Liatoupolou S, Comparato G, Carloni C, Bertiato G, Battiestel M. Clinical usefulness of serum pepsinogens I and II, gastrin-17 and anti-Helicobacterpylori antibodies in the management of dyspeptic patients in primary care. Dig Liver Dis. 2005;37:501-508. [PubMed] [DOI] |
| 38. | Broutet N, Plebani M, Sakarovitch C, Sipponen P, Mégraud F. Pepsinogen A, pepsinogen C, and gastrin as markers of atrophic chronic gastritis in European dyspeptics. Br J Cancer. 2003;88:1239-1247. [PubMed] [DOI] |
| 39. | Cao Q, Ran ZH, Xiao SD. Screening of atrophic gastritis and gastric cancer by serum pepsinogen, gastrin-17 and Helicobacter pylori immunoglobulin G antibodies. J Dig Dis. 2007;8:15-22. [PubMed] [DOI] |
| 40. | 李 红涛, 吴 开春, 李 彩宁, 乔 泰东, 郭 学刚, 王 新, 郝 志明, 宋 瑛, 丁 杰, 樊 代明. 血清胃泌素对老年人慢性萎缩性胃炎的诊断. 中华老年医学杂志. 2004;23:238-240. |
| 41. | 朱 方石, 姒 健敏, 王 良静, 王 冬飞, 陈 萍. 萎缩性胃炎大鼠胃黏膜主、壁细胞和G、D细胞及外周血胃泌素、生长抑素的变化. 世界华人消化杂志. 2006;14:3261-3267. [DOI] |
| 42. | Wang LJ, Chen SJ, Chen Z, Cai JT, Si JM. Morphological and pathologic changes of experimental chronic atrophic gastritis (CAG) and the regulating mechanism of protein expression in rats. J Zhejiang Univ Sci B. 2006;7:634-640. [PubMed] [DOI] |