修回日期: 2010-10-18
接受日期: 2010-10-26
在线出版日期: 2011-01-08
目的: 探讨外周血B淋巴细胞活化因子(BAFF)和B淋巴细胞活化因子受体(BAFF-R)之间的相关性以及两者与I型自身免疫性肝炎(AIH-I)患者临床特征的关系.
方法: 检测30例AIH-I患者治疗前后外周血BAFF(酶联免疫吸附法)及BAFF-R(流式细胞仪)的表达水平和30名健康志愿者外周血中二者的表达水平, 同时收集实验对象相应的IgG、ALT、AST、GLO、CRP检查结果, 通过SPSS统计软件进行分析.
结果: AIH-I患者外周血BAFF及BAFF-R水平较正常对照组有统计学差异(747.83 ng /L±66.96 ng/L vs 203.50 ng/L±43.99 ng/L; 18.78%±5.08% vs 1.98%±0.89%, 均P<0.05); AIH-I患者外周血BAFF与BAFF-R水平呈正相关(P<0.05); AIH-I患者外周血BAFF及BAFF-R水平在治疗前后有统计学差异(747.83 ng/L±66.96 ng/L vs 582.83 ng/L±51.89 ng/L; 18.78%±5.08% vs 9.93%±3.53%, 均P<0.05); AIH-I患者外周血BAFF及BAFF-R水平与疾病活动指标(IgG、ALT、AST、GLO、CRP)水平无明显相关(均P>0.05).
结论: AIH-I患者外周血BAFF与BAFF-R水平明显升高, 激素治疗前后差异显著, 二者与疾病的发展过程相关, 对评价疾病的治疗具有一定的指导意义.
引文著录: 梁伊乐, 徐芸, 孙会潇. BAFF及受体BAFF-R在Ⅰ型自身免疫性肝炎中的表达及其临床意义. 世界华人消化杂志 2011; 19(1): 89-93
Revised: October 18, 2010
Accepted: October 26, 2010
Published online: January 8, 2011
AIM: To detect serum level of B-lymphocyte activating factor (BAFF) and percentage of B cells positive for B-cell activating factor receptor (BAFF-R) on B cells in patients with type I autoimmune hepatitis (AIH-I) and to analyze their relations to the clinical features of AIH-I.
METHODS: Thirty patients with AIH-I and 30 healthy subjects were included in the study. Serum BAFF was detected by enzyme-linked immunosorbent assay (ELISA), and the percentage of BAFF-R-positive B cells was measured by flow cytometry. Meanwhile, serum levels of AL T, AST, GLO, CRP and IgG were measured.
RESULTS: There were significant differences in mean serum BAFF level and percentage of BAFF-R-positive B cells between AIH-I patients and healthy subjects (747.83 ng /L ± 66.96 ng/L vs 203.50 ng/L ± 43.99 ng/L; 18.78% ± 5.08% vs 1.98% ± 0.89%, both P < 0.05). There is a positive correlation between serum BAFF level and percentage of BAFF-R-positive B cells in AIH-I patients (P < 0.05). Significant differences were noted in mean serum BAFF and percentage of BAFF-R-positive B cells in AIH-I patients between before and after treatment (BAFF: 747.83 ng/L ± 66.96 ng/L vs 582.83 ng/L ± 51.89 ng/L, P < 0.05; BAFF-R: 18.78% ± 5.08% vs 9.93% ± 3.53%, P < 0.05). Serum BAFF level and percentage of BAFF-R-positive B cells showed no correlation with serum ALT, AST, GLO, CRP, or IgG in AIH-I patients (all P > 0.05).
CONCLUSION: The level of serum BAFF and percentage of BAFF-R-positive B cells are significantly increased in AIH-I patients but significantly descended after treatment.
- Citation: Liang YL, Xu Y, Sun HX. Clinical significance of serum BAFF level and percentage of BAFF-R-positive B cells in patients with type I autoimmune hepatitis. Shijie Huaren Xiaohua Zazhi 2011; 19(1): 89-93
- URL: https://www.wjgnet.com/1009-3079/full/v19/i1/89.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i1.89
B淋巴细胞活化因子(B lymphocyte activating factor, BAFF)于1999年被发现, 属于肿瘤坏死因子超家族的成员[1]. 相关研究发现, BAFF在B淋巴细胞的生存和成熟过程中发挥着重要的作用. BAFF通过与其受体结合发挥作用, 其受体分别为B细胞成熟抗原(B cell maturation antigen, BCMA)、穿膜蛋白活化物(transmembrane activator and CAML interactor, TACI)、B细胞活化因子受体(BA FF receptor, BAFF-R)[2], 3个受体中BAFF-R与BAFF的结合具有特异性, 在BAFF发挥作用的过程中扮演着十分重要的角色. 越来越多的研究发现, BAFF的异常与自身免疫性疾病的发生、发展有着密切的关系[3,4]. 本研究主要探讨BAFF及B淋巴细胞活化因子受体(B cell activating factor receptor, BAFF-R)在I型自身免疫性肝炎(autoimmune hepatitis type-I, AIH-I)中的表达以及二者与AIH-I临床特点之间的关系, 以进一步明确二者在AIH-I发病和治疗过程中的作用.
郑州大学第一附属医院消化内科2009-07/2010-07住院部AIH-I患者30例, 均为女性, 年龄32-63岁, 均符合1998年国际AIH小组制定的AIH诊断评分标准[5], 满足激素治疗标准, 入组前均未进行免疫治疗, 除外遗传性疾病(Wilson病、α1-胰蛋白酶缺乏症和遗传性血色病)、感染性疾病(甲型肝炎、乙型肝炎及丙型肝炎等)和药物性肝脏损害(米诺霉素、呋喃坦啶、异烟肼、丙硫氧嘧啶和α甲基多巴等所致)、酒精性肝损伤、肿瘤性疾病. 郑州大学第一附属医院体检中心30例健康志愿者, 均为女性, 年龄30-60岁, 体检结果均无明显异常, 近3 mo来未患感染性疾病.
1.2.1 治疗: 根据标准治疗方案符合单一应用糖皮质激素治疗. 选用甲泼尼龙48 mg/d, 1 wk; 40 mg/d, 1 wk; 32 mg/d, 1 wk; 24 mg/d, 2 wk; 16 mg/d维持治疗.
1.2.2 BAFF的检测: (1)通过静脉穿刺的方法收集研究对象外周血2 mL, 置于EDTA-K2抗凝试管中, 静置20 min后离心, 以3 000 r/min离心20 min, 收集上清编号后保存于-20℃的冰箱中待测; (2)将标本收集完毕后, 按照ELISA试剂盒(RD公司)说明逐步进行操作, 测出样本的A值, 制作标准曲线, 根据酶标仪显示的结果得出样本的浓度.
1.2.3 BAFF-R的检测: (1)通过静脉穿刺的方法收集研究对象外周血2 mL, 置于EDTA-K2抗凝试管中, 从样本中取100 µL全血置于检测管中, 在检测管中分别加入10 µL PE标记CD19单抗(CR5019, 广州长瑞生物公司)、10 µL FITC标记 BAFF-R单抗(11-9117, eBioscience公司), 避光室温静置20 min后, 加入2 mL溶血素(BD公司), 混匀室温避光静置10 min后, 离心、弃上清, 加缓冲液3 mL洗涤, 再次离心、弃上清, 加多聚甲醛固定待测; (2)将待测标本置于流式细胞仪上, 通过软件自动分析获得BAFF-R的表达率.
1.2.4 其他指标的检测: HITACHI7600-020Automatic Analyzer检测血清丙氨酸转氨酶(alanine transaminase, ALT)、天冬氨酸转氨酶(aspartate transaminase, AST)、球蛋白(globin, GLO)水平, NephstarTM Nephelometric Kit(国赛GOL SITE深圳市国赛生物技术有限公司产品编号: DK022)检测血清C反应蛋白(C-reactive protein, CRP)水平, NephstarTM Nephelometric Kit(国赛GOL SITE深圳市国赛生物技术有限公司产品编号: DK022)检测血清IgG水平.
统计学处理 相关数据采用SPSS17.0进行统计分析. 计量数据采用mean±SD表示; 组间差异比较采用两组独立样本资料t检验; 治疗前后比较采用配对设计资料t检验; 两变量之间相关性采用Pearson(双变量正态分布)、Spearman(非正态分布)直线回归分析法, 并求相关系数r; 显著性检验水准为α = 0.05.
AIH-I组与健康对照组外周血BAFF表达水平具有明显的差异性(747.83 ng/L±66.96 ng/L vs 203.50 ng/L±43.99 ng/L, t = 37.21, P<0.05). AIH-I组治疗前后外周血BAFF表达水平具有明显的差异性(747.83 ng/L±66.96 ng/L vs 582.83 ng/L±51.89 ng/L, t = 10.67, P<0.05). 实验结果显示, AIH-I患者外周血BAFF表达水平与生化及炎症指标(ALT、AST、GLO、CRP、IgG)表达水平无明显相关性(P>0.05, 表1).
| 生化及炎症指标 | BAFF | |
| r值 | P值 | |
| ALT | 0.158 | 0.403 |
| AST | 0.243 | 0.195 |
| GLO | 0.186 | 0.325 |
| CRP | -0.202 | 0.284 |
| IgG | 0.223 | 0.236 |
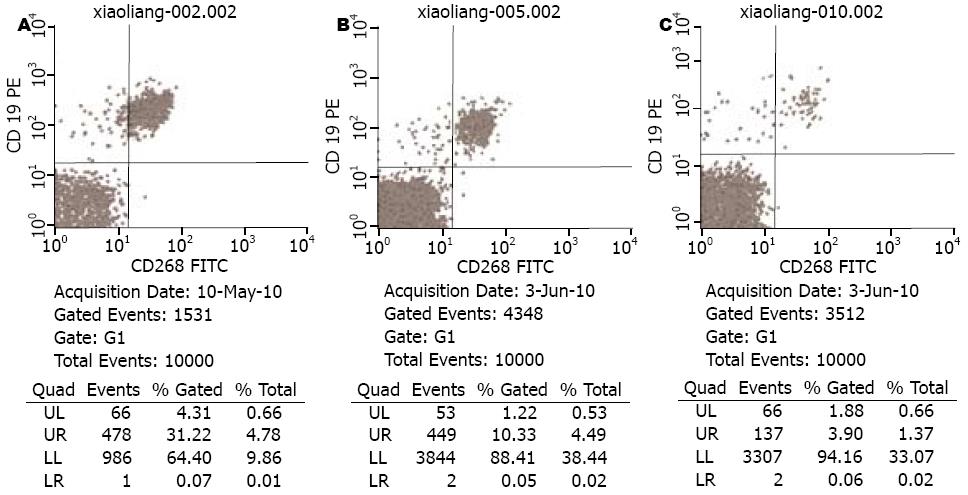
应用流式细胞仪检测外周血CD19+B细胞表面BAFF-R(%)表达水平(单抗为CD268)结果如图1所示. AIH-I组与健康对照组外周血BAFF-R(%)表达水平具有明显的差异性(18.78±5.08 vs 1.98±0.89, t = 17.86, P<0.05). AIH-I组治疗前后外周血BAFF-R(%)表达水平具有明显的差异性(18.78±5.08 vs 9.93±3.53, t = 7.85, P<0.05). 实验结果显示, AIH-I患者外周血BAFF-R(%)表达水平与生化及炎症指标(ALT、AST、GLO、CRP、IgG)表达水平无明显相关性(P>0.05, 表2).
| 生化及炎症指标 | BAFF-R(%) | |
| r值 | P值 | |
| ALT | 0.185 | 0.328 |
| AST | 0.142 | 0.455 |
| GLO | 0.008 | 0.968 |
| CRP | 0.260 | 0.891 |
| IgG | 0.239 | 0.204 |
AIH-I患者外周血BAFF与BAFF-R(%)表达呈中等强度相关(r = 0.49, P<0.05).
本研究探讨的是I型AIH. AIH以女性多见, 在我国以中老年女性多见. 临床特点为高丙种球蛋白血症、血清自身抗体和对免疫抑制治疗应答[6]. 无特异性的症状和体征, 常出现疲劳、食欲减退、恶心、腹痛、瘙痒及小关节疼痛等症状. 体格检查常无异常, 但也可有肝脾肿大、黄疸以及慢性肝炎的症状和体征. 约10%的患者可表现为急性肝炎甚至暴发性肝炎, 并可快速进展至肝硬化[7]. 根据自身抗体谱将其分为2个血清学亚型[8]. Ⅰ型AIH最为常见, 约占AIH的60%-80%, 抗核抗体、抗平滑肌抗体、抗可溶性肝抗原/肝胰抗原抗体阳性或核周型抗中性粒细胞胞浆抗体阳性为其特征.
BAFF是B淋巴细胞存活与成熟的必需因子,也被称为肿瘤坏死因子和凋亡配体相关的白细胞表达配体, 为肿瘤坏死因子家族成员. BAFF有膜结合蛋白和可溶性配体(human soluble BAFF, hsBAFF)两种形式存在. 本研究研究指标为hsBAFF. 他能够增强B淋巴细胞、CD4 T淋巴细胞、NK细胞的活性,使机体的免疫应答增强. BAFF受体有3种: BCMA、TACI和BAFF-R, 主要表达在B淋巴细胞上, 3个受体中, 唯有BAFF-R与BAFF的结合具有特异性, 主要表达在CD19 B淋巴细胞上, 在BAFF的生化作用中起着最重要的作用.
本文关于BAFF及其受体BAFF-R在AIH-I中的研究在国内外尚属首例. 相关研究表明, B淋巴细胞在自身免疫疾病中起到了重要作用, 而BAFF与BAFF-R结合使B淋巴细胞活化为浆细胞, 分泌大量免疫球蛋白, 包括自身抗体, 使机体出现炎性反应和免疫性损伤[9].
本研究检测了30例AIH-I患者治疗前后和30例健康志愿者外周血BAFF及BAFF-R的表达水平, 结果表明AIH-I组与健康组相比较[10]、AIH-I组治疗前后相比较, BAFF及BAFF-R的表达均具有明显差异性(P<0.05), 提示可将BAFF及BAFF-R的检测作为AIH-I诊断和治疗的辅助指标. 这与国内在其他自身免疫性疾病如类风湿性关节炎(rheumatoid arthritis, RA)、系统性红斑狼疮(systemic lupus erythematosus, SLE)中的研究具有一致性[11], 国内关于原发性胆汁肝硬化(primary biliary cirrhosis, PBC)的研究中BAFF水平显著升高[12], 亚洲其他国家也有类似的研究报道[13], 但在国外白人的PBC研究中BAFF水平并不显著升高[14].
实验中关于BAFF及BAFF-R与临床生化及炎症指标(ALT、AST、GLO、CRP、IgG)相关性的研究表明, 现有的数据不能说明前者与后者存在相关性(P>0.05), 提示BAFF还不能作为AIH-I活动与否的指标, BAFF对B淋巴细胞的激活可能不是通过产生抗体而是通过其他途径导致机体免疫紊乱, 这与Becker-Merok等关于BAFF在RF中的表达的研究结果相一致[15].
研究结果还显示AIH-I中BAFF与BAFF-R的表达具有中等强度的相关性(r = 0.49, P<0.05), 并且经过激素的治疗后, 二者的水平均显著降低, 提示二者的表达参与了AIH-I的病理发展过程, 从一定程度上说明抑制BAFF与BAFF-R的相互作用将干扰AIH-I的病理过程, 从而阻碍或延缓疾病的发展过程. 这与当前在其他自身免疫性疾病中如SLE、RF中以BAFF为目标的单抗治疗的研究相符合. BAFF能够有效参与并促进T、B淋巴细胞的活化, 他的过量表达与自身免疫疾病密切相关[16]. 因此, BAFF及其受体作为治疗自身免疫疾病的新靶标, 目前受到广泛的关注.
本实验初步探讨了AIH-I中BAFF及BAFF-R的表达, 研究了二者与临床相关检查指标之间的相关性, 属于小样本小范围的研究, 但相关研究在国内外未见报道, 欲进一步探讨二者与临床特征之间的关系及机制, 还需要大样本、多中心的研究.
自身免疫性肝病是一组免疫介导的肝脏损伤, 以AIH-I最为常见. 该病的临床表现不具有明显的特异性, 早期的诊断和治疗有利于延缓疾病的进展和提高患者的生存质量. 因此, 探讨AIH-I的发病机制、寻找特异性强并且能够评价疾病治疗效果的生化指标就成为当今对AIH-I临床和基础研究的主要方向.
宣世英, 教授, 山东省青岛市市立医院肝病内科
本实验应用ELISA和流式细胞仪分别检测BAFF和BAFF-R在AIH-I中的表达及其在临床治疗前后的变化, 在一定程度上为AIH-I的早期诊断以及评价临床治疗效果提供了新的重要参考指标.
本实验证实了BAFF和BAFF-R与AIH-I的发生及进展具有明显的相关性, 为进一步揭示AIH-I的发病机制提供了新的线索和思路. 二者在治疗前后表现出的明显差异性, 又为评价AIH-I的治疗效果提供了新的参考指标.
本文新颖性较好, 对评价疾病的治疗具有一定的指导意义.
编辑: 曹丽鸥 电编:李薇
| 1. | Moore PA, Belvedere O, Orr A, Pieri K, LaFleur DW, Feng P, Soppet D, Charters M, Gentz R, Parmelee D. BLyS: member of the tumor necrosis factor family and B lymphocyte stimulator. Science. 1999;285:260-263. [PubMed] [DOI] |
| 3. | Moisini I, Davidson A. BAFF: a local and systemic target in autoimmune diseases. Clin Exp Immunol. 2009;158:155-163. [PubMed] [DOI] |
| 5. | Alvarez F, Berg PA, Bianchi FB, Bianchi L, Burroughs AK, Cancado EL, Chapman RW, Cooksley WG, Czaja AJ, Desmet VJ. International Autoimmune Hepatitis Group Report: review of criteria for diagnosis of autoimmune hepatitis. J Hepatol. 1999;31:929-938. [PubMed] [DOI] |
| 6. | Granito A, Muratori P, Ferri S, Pappas G, Quarneti C, Lenzi M, Bianchi FB, Muratori L. Diagnosis and therapy of autoimmune hepatitis. Mini Rev Med Chem. 2009;9:847-860. [PubMed] [DOI] |
| 7. | Krawitt EL. Autoimmune hepatitis. N Engl J Med. 2006;354:54-66. [PubMed] [DOI] |
| 8. | Dalekos GN, Zachou K, Liaskos C, Gatselis N. Autoantibodies and defined target autoantigens in autoimmune hepatitis: an overview. Eur J Intern Med. 2002;13:293-303. [PubMed] [DOI] |
| 10. | Migita K, Abiru S, Maeda Y, Nakamura M, Komori A, Ito M, Fujiwara S, Yano K, Yatsuhashi H, Eguchi K. Elevated serum BAFF levels in patients with autoimmune hepatitis. Hum Immunol. 2007;68:586-591. [PubMed] [DOI] |
| 12. | Liang Y, Yang ZX, Zhu Y, Wang Y, Zeng XM, Deng AM, Zhong RQ. [Study on association of BAFF receptors gene expression and primary biliary cirrhosis]. Zhonghua Yixue Zazhi. 2007;87:128-130. [PubMed] |
| 13. | Migita K, Ilyassova B, Kovzel EF, Nersesov A, Abiru S, Maeda Y, Komori A, Ito M, Yano K, Yatsuhashi H. Serum BAFF and APRIL levels in patients with PBC. Clin Immunol. 2010;134:217-225. [PubMed] [DOI] |
| 14. | Mackay IR, Groom J, Mackay CR. Levels of BAFF in serum in primary biliary cirrhosis and autoimmune diabetes. Autoimmunity. 2002;35:551-553. [PubMed] [DOI] |