修回日期: 2010-11-26
接受日期: 2010-12-01
在线出版日期: 2011-01-08
目的: 观察JAM-C单克隆抗体对小鼠急性坏死性胰腺炎(ANP)模型胰腺和全身炎症的抑制作用.
方法: 采用雨蛙素和脂多糖联合腹腔注射的方法建立小鼠重症急性胰腺炎模型. 生理盐水对照组(NS组): 小鼠给予腹腔注射无菌生理盐水(10 mL/kg), 共注射6次, 间隔1 h; ANP模型组(ANP组): 小鼠给予腹腔注射雨蛙素(50 μg/kg)6次, 间隔1 h, 末次注射后立即给予腹腔注射内毒素(10 mg/kg); 抗小鼠JAM-C单抗处理组(anti-JAM-C mAb组): 小鼠给予腹腔注射雨蛙素(50 μg/kg)6次, 间隔1 h, 在首次注射30 min时, 予每只小鼠腹腔内注射anti-JAM-C mAb 0.3 mL(300 μg), 末次雨蛙素注射后予腹腔内注射内毒素(10 mg/kg). 在末次注射3 h后, 收集血液检测血清淀粉酶和血TNF-α浓度, 并收集胰腺组织称胰腺湿质量和进行组织积分分析.
结果: 与ANP组小鼠比较, anti-JAM-C mAb的使用明显减轻了小鼠胰腺的水肿, 炎症细胞浸润, 坏死和出血, 病理学评分明显降低(1.9±0.1 vs 2.4±0.3; 1.5±0.2 vs 2.4±0.2; 1.1±0.2 vs 2.0±0.2; 1.0±0.2 vs 1.8±0.2, 均P<0.05). 此外, ANP组小鼠的胰腺湿质量、血清淀粉酶含量和血清TNF-α浓度明显高于NS组和anti-JAM-C组(348 mg±27 mg vs 235 mg±24 mg, 286 mg±36 mg; 17 985 U/L±1 064 U/L vs 1 876 U/L±245 U/L, 13 870 U/L±988 U/L; 628 ng/L±48 ng/L vs 320 ng/L±23 ng/L, 58 ng/L±13 ng/L, 均P<0.05).
结论: anti-JAM-C mAb能有效缓解小鼠ANP模型的胰腺炎症损伤和全身炎症反应.
引文著录: 胡端敏, 杨勇, 唐文. JAM-C单抗对小鼠急性坏死性胰腺炎的抑制作用. 世界华人消化杂志 2011; 19(1): 74-77
Revised: November 26, 2010
Accepted: December 1, 2010
Published online: January 8, 2011
AIM: To investigate whether anti-JAM-C mAb exerts a protective effect against pancreatic and systemic inflammation in mice with acute necrotizing pancreatitis (ANP).
METHODS: A mouse model of ANP was induced by intraperitoneal injection of cerulein and lipopolysaccharide. ANP mice were divided into three groups: mice undergoing an intraperitoneal injection of anti-JAM-C mAb (anti-JAM-C mAb group), ANP group and those receiving normal saline (NS group). Blood samples were taken to determine serum amylase and TNF-α concentrations, and pancreatic samples was collected for morphological study and histological scoring.
RESULTS: Compared to the ANP group, treatment with anti-JAM-C mAb significantly reduced the severity of pancreatic injury, including edema (1.9 ± 0.1 vs 2.4 ± 0.3, P < 0.05), inflammatory cell infiltration (1.5 ± 0.2 vs 2.4 ± 0.2, P < 0.05), necrosis (1.1 ± 0.2 vs 2.0 ± 0.2, P < 0.05) and hemorrhage (1.0 ± 0.2 vs 1.8 ± 0.2, P < 0.05). In addition, the wet weight, serum amylase and TNF-α concentrations in ANP group were markedly higher than NS group and anti-JAM-C mAb group (348 mg ± 27 mg vs 235 mg ± 24 mg, 286 mg ± 36 mg; 17 985 U/L ± 1 064 U/L vs 1 876 U/L ± 245 U/L, 13 870 U/L ± 988 U/L; 628 ng/L ± 48 ng/L vs 320 ng/L ± 23 ng/L, 58 ng/L ± 13 ng/L, all P < 0.05).
CONCLUSION: Treatment with anti-JAM-C mAb significantly reduces pancreatic and systemic inflammation in mice with ANP.
- Citation: Hu DM, Yang Y, Tang W. Treatment with anti-JAM-C mAb attenuates pancreatic and systemic inflammation in mice with acute necrotizing pancreatitis. Shijie Huaren Xiaohua Zazhi 2011; 19(1): 74-77
- URL: https://www.wjgnet.com/1009-3079/full/v19/i1/74.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i1.74
急性坏死性胰腺炎(acute necrotizing pancreatitis, ANP)时, 胰腺组织大量渗出的白细胞引发并加剧了胰腺的炎症和坏死, 而白细胞与内皮细胞的相互作用则是导致白细胞募集的中心环节, 各种黏附分子在这一环节中起着关键作用[1]. 连接黏附分子C(junctional adhesion molecule-C JAM-C)是近年新发现的在血管内皮细胞上分布的细胞黏附分子, 他介导了中性粒细胞向炎症部位和组织损伤处的浸润和聚集[2]. 我们的前期研究发现, 在小鼠ANP模型中, JAM-C在胰腺、肾脏和肺脏上的表达均明显增高, 这一结果提示JAM-C在ANP发病过程中起到重要的作用[3]. 本研究通过小鼠JAM-C单克隆抗体干预治疗小鼠ANP模型, 旨在观察抑制JAM-C介导的黏附作用对ANP小鼠胰腺及全身炎症的保护作用.
清洁级昆明小鼠18只, 雌雄不分, 体质量20 g±2 g, 购自苏州大学动物实验中心. 雨蛙素(cerulein)、内毒素(endotoxin)(E.coli O127:B8)购自美国Sigma公司; AF1213羊抗小鼠JAM-C mAb 购自美国RnD公司. 小鼠TNF-α ELISA Kit试剂盒购自武汉博士德生物有限公司.
1.2.1 造模及给药: 动物随机被分成3组, 每组6只. 生理盐水对照组(NS组): 小鼠给予腹腔注射无菌生理盐水(10 mL/kg), 共注射6次, 间隔1 h; ANP模型组(ANP组): 小鼠给予腹腔注射雨蛙素(50 μg/kg)6次, 间隔1 h, 末次注射后立即给予腹腔注射内毒素(10 mg/kg). 抗小鼠JAM-C单抗处理组(anti-JAM-C mAb组): 小鼠给予腹腔注射雨蛙素(50 μg/kg)6次, 间隔1 h, 在首次注射30 min时予每只小鼠腹腔内注射anti-JAM-C mAb 0.3 mL(300 μg), 末次雨蛙素注射后予腹腔内注射内毒素(10 mg/kg).
1.2.2 血清淀粉酶测定和TNF-α浓度测定: 在末次注射完毕3 h后, 用股动脉取血法收集血液, 小鼠血清经过稀释后通过Olympus全自动生化仪进行血清淀粉酶检测, 同时用ELISA测定血清TNF-α浓度, 操作步骤均严格按试剂盒说明书.
1.2.3 取材及光镜检查: 取血后用颈椎脱臼法处死小鼠, 剖腹, 肉眼观察胰腺及胰外各器官变化. 仔细分离胰腺, 称胰腺湿质量. 取胰组织置40 g/L甲醛溶液固定, 常规石蜡包埋、切片, 苏木素和伊红(HE)染色, Olympus光镜下观察, 显微摄影.
1.2.4 病理学分析: 每只小鼠胰腺标本, 在光镜下选取10个高倍视野, 用双盲法按Schmidt's标准[4]行胰腺组织病理学评分.
统计学处理 采用SPSS13.0统计软件, 所有数据均用mean±SD表示. 两组数据比较时采用Mann-Whitney检验. P<0.05认为有显著性差异.
NS组: 胰腺无明显外观异常; 胰外器官正常. ANP组: 2只小鼠腹腔内可见少量淡红色腹水; 胰腺腺体肿胀, 色暗红, 表面可见多处白色点状皂化斑及出血点, 胰腺与周围组织粘连; 小肠积气扩张明显; 肝脏暗红, 体积增大; 大网膜、肠系膜可见出血点; anti-JAM-C mAb组: 所有小鼠腹腔未见腹水, 腺体肿胀发红, 包膜紧张少量出血点但未见点状皂化斑; 胰外器官无异常变化.
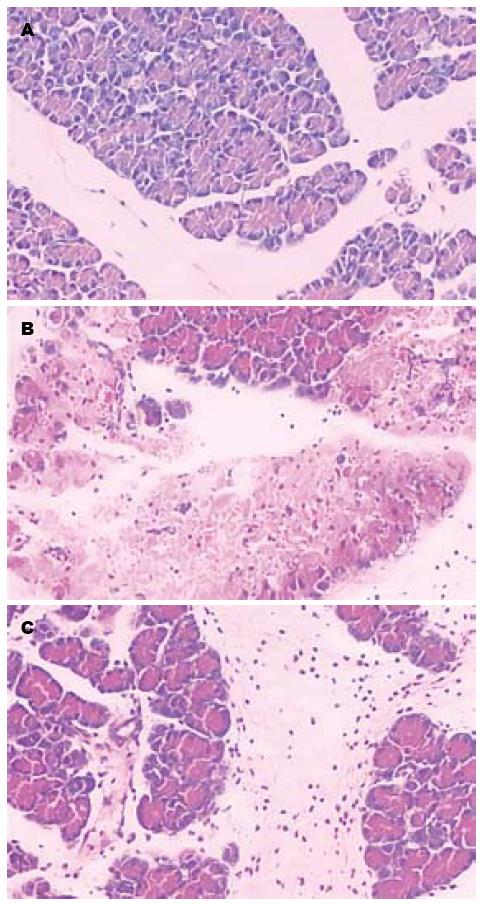
NS组, 胰腺组织正常(图1A). ANP组, 胰腺高度水肿, 腺泡呈孤岛状, 广泛腺细胞坏死, 细胞结构模糊不清, 胞质内空泡形成, 局部有融合性坏死灶; 坏死区有大量中性粒细胞和单核细胞浸润(图1B). 胰周脂肪有大量炎症细胞浸润, 血管扩张充血, 有脂肪坏死; 胰腺间质内动脉痉挛, 静脉明显扩张淤血, 炎症细胞附边, 局部血管壁出血、坏死. anti-JAM-C mAb组, 胰腺间质充血水肿, 有中性粒细胞和单核细胞浸润, 有少量局灶性腺泡坏死, 血管病变不明显, 无出血(图1C).
各组小鼠胰腺标本的Schmidt's胰腺病理评分显示, anti-JAM-C mAb组胰腺的水肿、炎症浸润、坏死及出血积分均明显低于ANP组(表1).
与NS组相比, ANP组和anti-JAM-C mAb组的胰腺湿质量、血清淀粉酶含量和血清TNF-α浓度均明显升高(P<0.05), 但anti-JAM-C mAb组胰腺湿质量、血清淀粉酶含量和血清TNF-α浓度均明显低于ANP组(P<0.05, 表2).
JAM-C是免疫球蛋白超家族成员之一, 他主要分布在白细胞、血小板、各种上皮, 及血管内皮细胞上. 在对腹膜炎[5]、肺炎[6]、皮肤炎症[7]、关节炎[8]等动物模型的研究中发现JAM-C增加了中性粒细胞的在炎症部位和组织损伤处的浸润和聚集.
目前的研究认为重症急性胰腺炎(severe acute pancreatitis, SAP)时, 白细胞过度激活是引起胰腺病情加重、多器官功能衰竭以致死亡的重要原因[9]. 其中细胞黏附分子主要作用于炎症细胞的黏附过程, 对白细胞过度激活以及SAP的发生、发展及器官功能衰竭的发生有重要意义, 因此以各种黏附分子为靶点的治疗手段被认为可能是治疗SAP的突破口, 针对各种胰腺炎模型的抗黏附治疗一直是近年来研究的热点之一. Rau等[10]使用细胞间黏附分子-1(intercellular adhesion molecule 1, ICAM-1)的单克隆抗体预处理大鼠ANP模型后发现, anti-ICAM-1单抗能有效地减少大鼠ANP胰腺内的白细胞浸润、明显改善了胰腺炎症的病理积分、抑制了胰腺的早期坏死和后期的胰腺细胞的凋亡. Hartwig等[11]在他们的研究中也发现, 阻断黏附分子L选择素的表达能明显降低白细胞渗出和肺损害. 但既往的这些抗黏附治疗研究的重点主要是针对介导白细胞趋边、滚动和初步黏附的分子, 而JAM-C主要分布在血管内皮细胞之间的紧密连接上, 他的配体主要是分布在各种白细胞上的整合素Mac-1(αLβ2, CD11b/CD18), 正是由于这种细胞膜分布上的特异性, JAM-C在白细胞激活向炎症区域募集的过程中主要作用于白细胞的跨壁穿越过程. Vonlaufen等[12]发现JAM-C高表达的小鼠ANP模型的胰腺炎症积分明显高于对照组. Chavakis等[5]在他们的研究中使用JAM-C的可溶形式(sJAM-C)结合中性粒细胞上的整合素Mac-1后, 发现血管炎症明显减轻, 且白细胞渗出也明显减少. Scheiermann等[13]发现拮抗JAM-C能使缺血再灌注损伤小鼠模型的中性粒细胞血管外渗出明显减少. 本研究同样发现JAM-C单抗处理后的ANP小鼠胰腺白细胞浸润显著减少, 胰腺炎症的病理积分得到明显改善. 我们同时还发现JAM-C单抗使ANP小鼠的淀粉酶和血清TNF-α明显下降, 因TNF-α是ANP合并全身炎症反应综合征的主要的炎症因子, 与急性胰腺炎的临床预后密切相关[14], 故JAM-C不仅可以改善ANP小鼠胰腺的局部炎症还能有可能减轻ANP合并的全身炎症反应和预防肺、脑等远隔重要脏器的损害. 重症胰腺炎患者多在发病数小时后就诊, 故对针对全身炎症反应的上游细胞因子的干预很难保证其及时性和有效性, 因此拮抗JAM-C这种参与ANP后期细胞事件的黏附分子可能成为治疗ANP及时有效的治疗方法.
急性坏死性胰腺炎(ANP)时, 胰腺组织大量渗出的白细胞引发并加剧了胰腺的炎症和坏死, 而白细胞与内皮细胞的相互作用则是导致白细胞募集的中心环节, 各种黏附分子在这一环节中起着关键作用.
周国雄, 主任医师, 南通大学附属医院消化内科
目前的研究认为细胞黏附分子介导的白细胞过度激活对SAP的发生、发展及器官功能衰竭的发生有重要意义, 针对各种胰腺炎模型的抗黏附治疗一直是近年来研究的热点之一.
Bettina等使用细胞间黏附分子-1(ICAM-1)的单克隆抗体预处理大鼠ANP模型后发现, anti-ICAM-1单抗能有效地减少大鼠ANP胰腺内的白细胞浸润、明显改善了胰腺炎症的病理积分、抑制了胰腺的早期坏死和后期的胰腺细胞的凋亡. Hartwig等在他们的研究中也发现, 阻断黏附分子L选择素的表达能明显降低白细胞渗出和肺损害.
临床上重症胰腺炎患者多在发病数小时后就诊, 故对针对全身炎症反应的上游细胞因子的干预很难保证其及时性和有效性, 因此拮抗JAM-C这种参与ANP后期细胞事件的黏附分子可能成为治疗ANP及时有效的治疗方法.
本文选题较好, 有一定的临床参考价值.
编辑: 曹丽鸥 电编:何基才
| 1. | Raraty MG, Connor S, Criddle DN, Sutton R, Neoptolemos JP. Acute pancreatitis and organ failure: pathophysiology, natural history, and management strategies. Curr Gastroenterol Rep. 2004;6:99-103. [PubMed] [DOI] |
| 2. | Ody C, Jungblut-Ruault S, Cossali D, Barnet M, Aurrand-Lions M, Imhof BA, Matthes T. Junctional adhesion molecule C (JAM-C) distinguishes CD27+ germinal center B lymphocytes from non-germinal center cells and constitutes a new diagnostic tool for B-cell malignancies. Leukemia. 2007;21:1285-1293. [PubMed] [DOI] |
| 4. | Shimizu T, Shiratori K, Sawada T, Kobayashi M, Hayashi N, Saotome H, Keith JC. Recombinant human interleukin-11 decreases severity of acute necrotizing pancreatitis in mice. Pancreas. 2000;21:134-140. [PubMed] [DOI] |
| 5. | Chavakis T, Keiper T, Matz-Westphal R, Hersemeyer K, Sachs UJ, Nawroth PP, Preissner KT, Santoso S. The junctional adhesion molecule-C promotes neutrophil transendothelial migration in vitro and in vivo. J Biol Chem. 2004;279:55602-55608. [PubMed] [DOI] |
| 6. | Aurrand-Lions M, Lamagna C, Dangerfield JP, Wang S, Herrera P, Nourshargh S, Imhof BA. Junctional adhesion molecule-C regulates the early influx of leukocytes into tissues during inflammation. J Immunol. 2005;174:6406-6415. [PubMed] |
| 7. | Ludwig RJ, Zollner TM, Santoso S, Hardt K, Gille J, Baatz H, Johann PS, Pfeffer J, Radeke HH, Schön MP. Junctional adhesion molecules (JAM)-B and -C contribute to leukocyte extravasation to the skin and mediate cutaneous inflammation. J Invest Dermatol. 2005;125:969-976. [PubMed] [DOI] |
| 8. | Palmer G, Busso N, Aurrand-Lions M, Talabot-Ayer D, Chobaz-Péclat V, Zimmerli C, Hammel P, Imhof BA, Gabay C. Expression and function of junctional adhesion molecule-C in human and experimental arthritis. Arthritis Res Ther. 2007;9:R65. [PubMed] [DOI] |
| 9. | Babu BI, Siriwardena AK. Functional protein C levels during the early phase of clinical acute pancreatitis. Pancreas. 2010;39:1077-1081. [PubMed] [DOI] |
| 10. | Rau B, Paszkowski A, Esber S, Gansauge F, Poch B, Beger HG, Möller P. Anti-ICAM-1 antibody modulates late onset of acinar cell apoptosis and early necrosis in taurocholate-induced experimental acute pancreatitis. Pancreas. 2001;23:80-88. [PubMed] [DOI] |
| 11. | Hartwig W, Jimenez RE, Fernandez-del Castillo C, Kelliher A, Jones R, Warshaw AL. Expression of the adhesion molecules Mac-1 and L-selectin on neutrophils in acute pancreatitis is protease- and complement-dependent. Ann Surg. 2001;233:371-378. [PubMed] [DOI] |
| 12. | Vonlaufen A, Aurrand-Lions M, Pastor CM, Lamagna C, Hadengue A, Imhof BA, Frossard JL. The role of junctional adhesion molecule C (JAM-C) in acute pancreatitis. J Pathol. 2006;209:540-548. [PubMed] [DOI] |
| 13. | Scheiermann C, Colom B, Meda P, Patel NS, Voisin MB, Marrelli A, Woodfin A, Pitzalis C, Thiemermann C, Aurrand-Lions M. Junctional adhesion molecule-C mediates leukocyte infiltration in response to ischemia reperfusion injury. Arterioscler Thromb Vasc Biol. 2009;29:1509-1515. [PubMed] [DOI] |