修回日期: 2010-11-26
接受日期: 2010-12-01
在线出版日期: 2011-01-08
目的: 探讨氧化苦参碱(OM)对SW1990细胞侵袭力的影响.
方法: 取人胰腺癌细胞SW1990为研究对象, 随机分为对照组和OM组, OM组再按照OM剂量不同, 分为1, 2, 4 g/L 3组. 用RT-PCR检测MMP-2 mRNA表达变化, 以细胞划痕试验和Transwell小室法检测SW1990细胞侵袭力和迁移的变化, 用四甲基偶氮唑蓝(MTT)比色法检测OM对SW1990细胞增殖的影响作用.
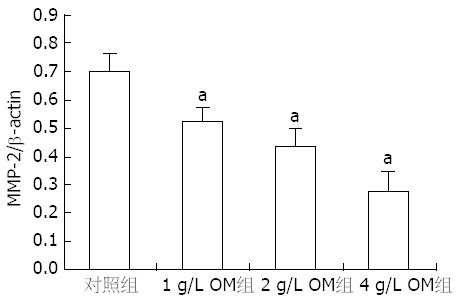
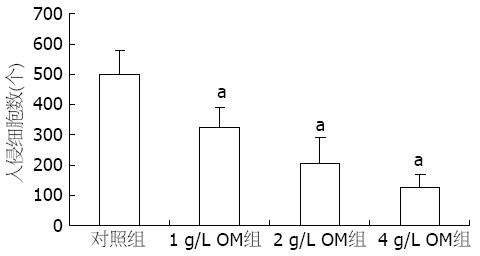
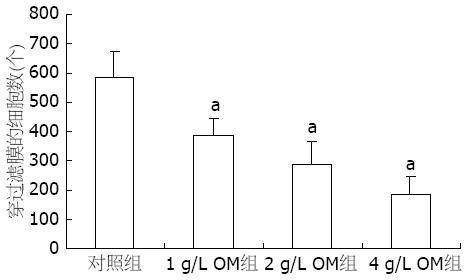
结果: RT-PCR显示MMP-2 mRNA在SW1990细胞中的表达, OM各组较对照组显著降低(0.53±0.03, 0.42±0.02, 0.29±0.03 vs 0.70±0.03, 均P<0.05). 细胞侵袭力测定显示, OM各组侵袭过Matrigel胶的细胞数显著低于对照组(325.00±64.43, 206.00±84.76, 124.00±46.78 vs 498.00±78.54, 均P<0.05), OM组细胞侵袭能力较对照组显著降低. 细胞迁移实验结果显示, OM各组穿过滤膜的细胞数显著低于对照组(385.0±58.9, 287.0±79.8, 186.0±60.9 vs 586.0±85.8, 均P<0.05).
结论: OM可能通过下调MMP-2 mRNA的表达, 抑制胰腺癌细胞侵袭转移能力.
引文著录: 冀润利, 邸瑶, 夏时海, 李飞. 氧化苦参碱对SW1990细胞MMP-2表达的抑制作用及对细胞侵袭力的影响. 世界华人消化杂志 2011; 19(1): 19-24
Revised: November 26, 2010
Accepted: December 1, 2010
Published online: January 8, 2011
AIM: To examine the effects of treatment with oxymatrine (OM) on MMP-2 expression and cell invasion in human pancreatic carcinoma cell line SW1990.
METHODS: Cultured SW1990 cells were randomly divided into two groups: control group and OM group. The OM group was further divided into three subgroups, which were treated with three different doses of OM (1, 2 and 4 g/L). MMP-2 expression in SW1990 cells was analyzed by real-time RT-PCR. Cell invasion, migration and proliferation were measured by scratch assay, transwell invasion assay and MTT assay, respectively.
RESULTS: The expression levels of MMP-2 mRNA in SW1990 cells in the three OM subgroups were significantly lower than that in the control group (0.53 ± 0.03, 0.42 ± 0.02, 0.29 ± 0.03 vs 0.70 ± 0.03, all P < 0.05). The invasion of cells in the three OM subgroups was markedly lower than that in the control group (325 ± 64.43, 206 ± 84.76, 124 ± 46.78 vs 498 ± 78.54, all P < 0.05). The mobility of cells in the three OM subgroups was also significantly lower than that in the control group (385.0 ± 58.9, 287.0 ± 79.8, 186.0 ± 60.9 vs 586.0 ± 85.8, all P < 0.05).
CONCLUSION: OM reduces the invasion of SW1990 cells possibly by inhibiting the expression of MMP-2.
- Citation: Ji RL, Di Y, Xia SH, Li F. Oxymatrine inhibits MMP-2 expression and reduces cell invasion in human pancreatic carcinoma cell line SW1990. Shijie Huaren Xiaohua Zazhi 2011; 19(1): 19-24
- URL: https://www.wjgnet.com/1009-3079/full/v19/i1/19.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i1.19
胰腺癌(pancreas carcinoma)是恶性肿瘤中恶性程度较高、易转移且预后极差的消化系肿瘤, 在癌症死亡原因顺位中, 排在男性的第6-8位, 女性的9-10位[1,2], 且其发病率呈逐年上升趋势. 2008年的调查研究显示, 在美国恶性肿瘤死亡人数中, 胰腺癌在第4位[3]. 早期出现侵袭转移行为严重影响了胰腺癌患者生存率的提高[4], 防治肿瘤的侵袭、转移是降低肿瘤死亡率的重要途径之一. 细胞外基质(extracellular matrix, ECM)和基底膜的降解被认为是肿瘤侵袭转移的首要步骤, 帮助瘤细胞行使破坏作用的工具就是蛋白酶, 主要有纤维蛋白溶解酶(plasmin)、基质金属蛋白酶(matrix metalloproteinases, MMPs)和肝素酶(heparanase), 其中以MMPs最为重要. MMPs通过降解改建ECM, 改变肿瘤细胞微环境, 提高肿瘤细胞侵袭力来发挥作用[5,6]. 目前尚无针对胰腺癌侵袭转移的确切治疗措施, 导致胰腺癌的治疗仍是一个世界级难题, 积极寻找对抗胰腺癌侵袭转移行为的药物的成为当务之急. 本文以人胰腺癌细胞株SW1990为研究对象, 研究氧化苦参碱(oxymatrine, OM)对SW1990中MMP-2 mRNA表达的影响, 探讨OM对SW1990细胞体外侵袭转移能力的影响作用, 为中药OM治疗胰腺癌提供实验数据.
优质胎牛血清购自中科院天津血液学研究所; RPMI 1640培养基购自Gibson公司; OM购自正大天晴公司, MMP-2抗体购自Santa Cruz公司; TRIzol购自Invitrogen公司; PCR Marker、RT-PCR试剂盒购自大连宝生物公司; Matrigel胶购自BD Biosciences公司、Transwell小室购自Millipore公司、MMP-2引物合成自Invitrogen生物技术公司.
1.2.1 细胞培养: SW1990细胞由协和医科大学基础学院细胞中心提供, 细胞生长于含100 mL/L小牛血清的DMEM培养液中, 置于37 ℃、50 mL/L CO2的孵育箱(相对湿度为95%)中培养.
1.2.2 分组: 随机分为对照组和OM组, OM组再随机分为1, 2, 4 g/L组. 选用含100 mL/L小牛血清的DMEM培养液, 待细胞长满培养瓶底部70%-80%时, 用0.25%胰蛋白酶与0.03% EDTA(1∶1)混匀消化传代, 取对数生长期细胞用于实验.
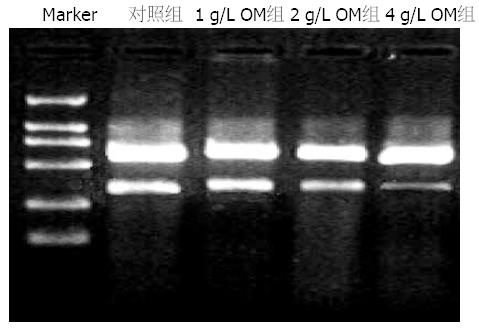
1.2.3 RT-PCR: 采用TRIzol试剂从细胞中提取总RNA, 检测RNA的含量和纯度(A260/A280 = 1.8-2.0). 以1%琼脂糖凝胶电泳鉴定其完整性(28S和18S RNA条带比值≥2.0). 用1 μg细胞总RNA进行逆转录, 结果经凝胶自动成像系统扫描, 以β-actin校正相对量, 数值以两者吸光度的比值表示.
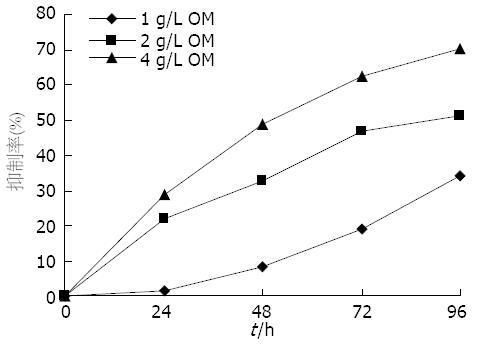
1.2.4 细胞增殖实验: 按照1、2、4 g/L 3个浓度梯度设置OM处理组, 每组再按照培养时间分为0、24、48、72、96 h 5个时相点小组, 各小组均设置3个重复孔. 将传代培养的SW1990细胞株用胰酶消化液消化后制备成1×108个/L的细胞悬液, 并接种于96孔细胞板, 每孔加入50 μL, 培养24 h后, 分别加入50 μL含OM的培养基, 使得每孔溶液中含药终浓度符合设计要求. 以此记为0 h, 继续培养, 分别于相应时相点取出细胞板置于室温(27 ℃), 每孔加入25 μL Cell Titer Glo反应液, 静置10 min. 每孔取出100 μL溶液置于空白的96孔板中, 通过多标记微孔板检测仪测定各孔发光信号, 测定其发光值, 通过测得发光值计算OM处理各组的细胞增殖抑制率.
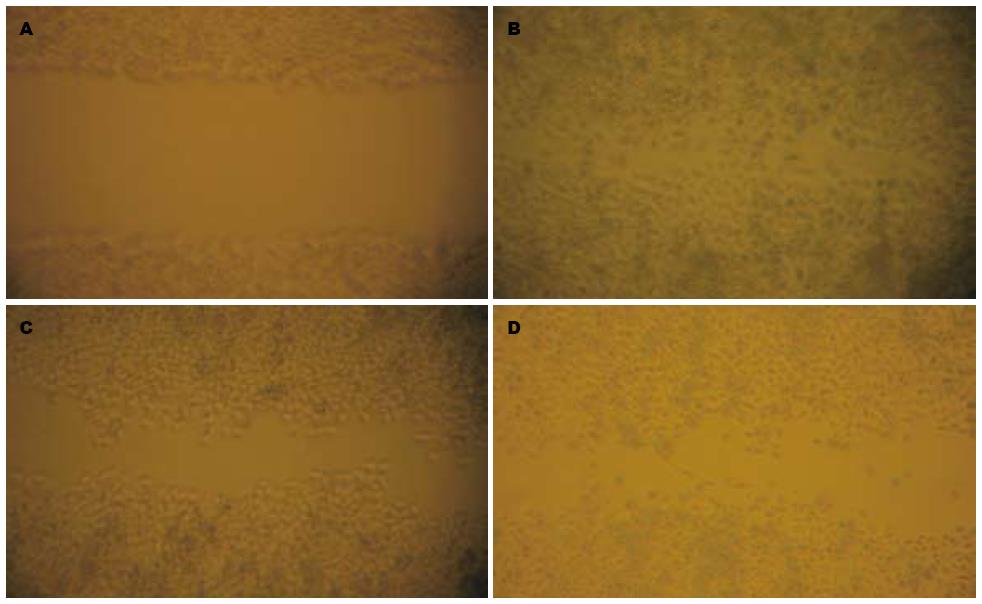
1.2.5 细胞划痕实验: 各组细胞接种于24孔培养板中, 细胞数约为每孔2×104个, 待长到完全融合时, 用10 μL Tip头在每孔单层细胞上划痕, 造成培养细胞伤口模型. 划痕后, 弃取培养基, PBS冲洗2次, 继续培养. 每12 h于倒置显微镜下观察伤口愈合程度, 并拍照1次.
1.2.6 细胞侵袭实验: 采用Transwell法检测细胞体外侵袭能力, 收集对数生长期细胞, 分别用含有PBS(对照组)和1, 2, 4 g/L OM的DMEM培养基悬浮细胞, 制成1×109/L的单细胞悬液, 按照郭坤等[7]方法操作. 细胞在小室内培养48 h后, 染色并拍照, 显微镜下观察穿过膜的细胞数, 计数中间及四周5个高倍(×400)镜下视野细胞数, 计算平均数.
1.2.7 细胞迁移实验: 收集对数生长期细胞, 分别用含有PBS(对照组)和1, 2, 4 g/L OM的DMEM培养基悬浮细胞, 制成1×109/L的单细胞悬液, 利用Transwell小室进行测定. 细胞在小室内培养48 h后, 染色并拍照, 显微镜下计数迁移细胞数, 计算平均数, 按照以下公式计算抑制率. 抑制率 = (阴性对照组平均迁移细胞数-实验药物组平均迁移细胞数)/阴性对照组平均迁移细胞数×100%.
统计学处理 实验数据经SPSS11.5软件分析. 样本均数的比较采用方差分析和t检验. 以P<0.05为差异有显著性.
结果显示不同浓度的OM(1, 2, 4 g/L)作用于胰腺癌细胞SW1990 24 h后, MMP-2 mRNA表达量与对照组相比显著降低(0.53±0.03, 0.42±0.02, 0.29±0.03 vs 0.70±0.03, 均P<0.05, 图1, 2).
氧化苦参碱可抑制SW1990细胞增殖, 成时间-剂量依赖性. 随着氧化苦参碱药物浓度和时间的增加, 对细胞的增殖抑制率也显著提高(图3).
对照组, 经24 h培养逐渐愈合, 划痕消失; 而2 g/L OM组, 4 g/L OM组细胞划痕, 经24 h培养仍未愈合, 划痕依然明显, 尤其以4 g/L OM更为明显(图4).
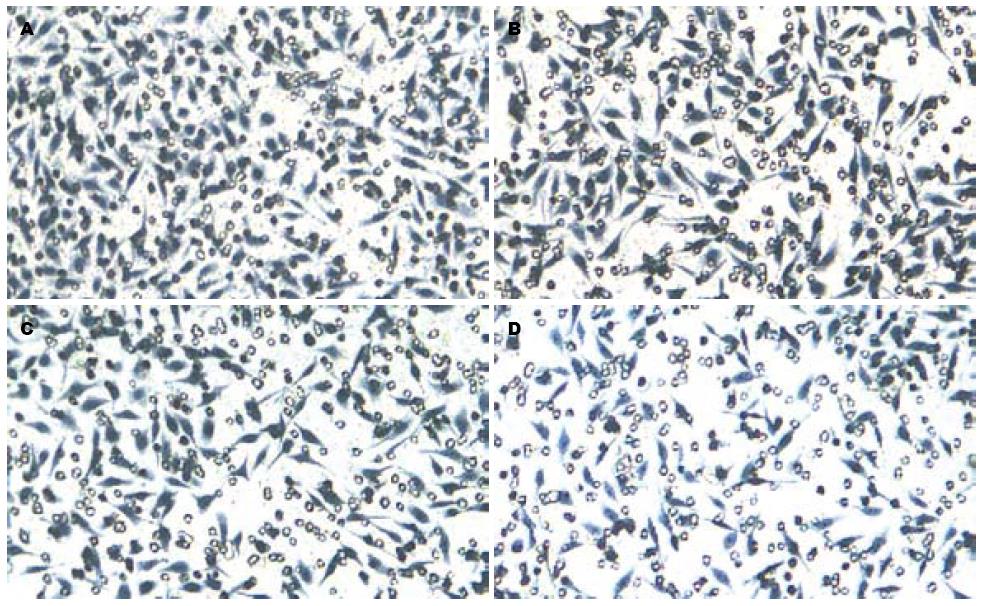
OM处理SW1990细胞48 h后, Transwell侵袭力测定显示1, 2, 4 g/L OM组侵袭过细胞Matrigel胶的细胞数显著低于对照组(325.00±64.43, 206.00±84.76, 124.00±46.78 vs 498.00±78.54), OM各组的细胞侵袭力均显著低于对照组(均P<0.05, 图5, 6).
细胞迁移实验结果显示1, 2, 4 g/L OM组穿过滤膜的细胞数显著低于对照组(385.0±58.9, 287.0±79.8, 186.0±60.9 vs 586.0±85.8, 均P<0.05, 图7).
肿瘤由原位增殖到侵袭转移, 依靠肿瘤细胞降解ECM来实现[8], MMPs和基质金属蛋白酶抑制剂家族(tissue inhibitors of metalloproteinases, TIMPs)是调节细胞基底膜和ECM完整性的重要因素, 与肿瘤的侵袭转移和预后密切相关[9].
MMPs是一组锌离子依赖性内肽酶, 在胰腺癌组织和细胞株中存在着高表达, 几乎能降解ECM的所有成分[10,11], MMPs的主要作用在于[12-14]: (1)降解ECM, 包绕肿瘤的基质, 突破基质屏障, 促进肿瘤侵袭转移[15]; (2)调节细胞黏附; (3)促进毛细血管内生、新生血管的形成, 从而加速肿瘤的生长和扩散; (4)免疫功能, 研究发现MT1-MMP可以裂解补体C3b片段, 使乳腺细胞免受补体系统的[16]; (5)调节肿瘤细胞凋亡.
Ⅳ型胶原酶包括MMP-2和MMP-9两个亚型, 在正常胰腺组织及胰腺癌组织中均有MMP-9表达, 而MMP-2对胰腺癌的特异性较高. Koshiba等[17]认为正常胰腺则不存在MMP-2, 而在所有胰腺癌组织及其转移结节中均有表达. Jones等[18]免疫组织化学的结果表明MMP-2在66%的胰腺癌细胞中有表达, 且局限于癌细胞, 不表达于间质; 但他的实验同样在70%的胰腺组织在发现了MMP-2的存在, 目前有更多的研究证实在正常胰腺组织中存在少量的MMP-2.
Jones等[18]的RT-PCR结果显示, MMP-2在胰腺癌细胞中表达上调, 免疫组织化学也得到了相同的结果. 目前认为MMP-2的表达与胰腺癌的恶性表型相关[19], MMP-2的过度表达与肿瘤的淋巴结转移和血行转移密切相关, 也与胰腺癌的进展有关, 是胰腺癌具有较强侵袭、转移潜能和患者预后差的重要标志[20]. Liu等[21]和Chandru等[22]报道乳腺癌患者肿瘤组织中MMP-2明显升高, 且在肿瘤组织和血浆中的表达与肿瘤的大小正相关; 在肿瘤发展的不同阶段MMP-2的水平也有显著差别, 此外MMP-2表达水平还与肿瘤是否转移相关. 有研究表明, MMP-2, 9在胃癌, 非小细胞肺癌、肝癌等肿瘤中均升高[23-26]. Giannopoulos等[27]对胰腺壶腹腺癌组织中MMP-2的表达进行了检测, 发现MMP-2的表达与微血管密度相关, 支持MMP-2的表达与血管发生相关的假说. 在我们的实验中发现, 随着OM给药剂量的增加, MMP-2 mRNA在SW1990细胞中的表达量逐渐降低.
OM是从中药苦参、苦豆子、广豆根中提取的一种生物碱, 有多方面的药理作用[28,29], 包括抗菌、抗炎、抗风湿、抗肿瘤、抗过敏、免疫及生物反应调节等作用[30]. 大量的文献表明OM可以抑制肿瘤细胞的增殖、转移, 诱导其凋亡[31]、向正常细胞分化, 具有抗肿瘤的活性[32-34].
本研究测定了OM对SW1990细胞增殖的影响作用, 发现随着OM用药浓度的加大和作用时间的延长, 细胞存活率逐渐下降, 增殖抑制率显著上升, 表明OM对SW1990细胞的增殖抑制作用呈时间和剂量依赖关系. 同时划痕试验、Transwell侵袭实验及细胞迁移实验也证实OM可以抑制SW1990细胞的侵袭力和迁移能力, 尤其以4 g/L OM组更为明显.
肿瘤的侵袭和转移是牵涉多个分子生物学事件的极其复杂过程, 他是决定肿瘤恶性度的最重要因素[35]. 在胰腺癌的发生发展过程中, 肿瘤的包膜浸润、周围神经浸润、血管浸润和腹腔淋巴结转移是胰腺癌进展的特点. 我们的实验证实, OM可以通过下调MMP-2 mRNA在SW1990细胞中的表达量从而抑制SW1990细胞的增殖、迁移与侵袭, 从而延缓胰腺癌发展进程, 对胰腺癌的治疗产生了一定的积极作用, 是否能以MMP-2为靶点, 对早期胰腺癌患者施加中药OM来预防肿瘤转移, 进行治疗, 还需进一步实验的证实.
胰腺癌是恶性肿瘤中恶性程度较高、易转移且预后极差的消化系肿瘤, 其发病率呈逐年上升趋势. 早期出现侵袭转移行为严重影响了胰腺癌患者生存率的提高, 防治肿瘤的侵袭、转移是降低肿瘤死亡率的重要途径之一.
陈光, 教授, 吉林大学第一医院消化器官外科
目前尚无针对胰腺癌侵袭转移的确切治疗措施, 导致胰腺癌的治疗仍是一个世界级难题, 积极寻找对抗胰腺癌侵袭转移行为的药物成为当务之急.
Jones等免疫组织化学的结果表明MMP-2在66%的胰腺癌细胞中有表达, 且局限于癌细胞, 不表达于间质; 但他的实验同样在70%的胰腺组织在发现了MMP-2的存在.
本文以人胰腺癌细胞株SW1990为研究对象, 研究OM对SW1990中MMP-2 mRNA表达的影响, 探讨OM对SW1990细胞体外侵袭转移能力的影响作用, 为中药OM治疗胰腺癌提供实验数据.
OM通过下调MMP-2 mRNA在SW1990细胞中的表达量, 抑制SW1990细胞的增殖、迁移与侵袭, 延缓胰腺癌发展进程, 对胰腺癌的治疗产生了一定的积极作用. 以MMP-2为靶点, 对早期胰腺癌患者施加中药OM来预防肿瘤转移, 为临床治疗肿瘤提出新的思路.
本文学术价值较高, 对胰腺癌的治疗产生了一定的积极作用, 为中药氧化苦参碱治疗胰腺癌提供实验数据.
编辑: 李军亮 电编:何基才
| 1. | Wang L, Yang GH, Lu XH, Huang ZJ, Li H. Pancreatic cancer mortality in China (1991-2000). World J Gastroenterol. 2003;9:1819-1823. [PubMed] [DOI] |
| 3. | Jemal A, Siegel R, Xu J, Ward E. Cancer statistics, 2010. CA Cancer J Clin. 2010;60:277-300. [PubMed] [DOI] |
| 5. | Pratap J, Javed A, Languino LR, van Wijnen AJ, Stein JL, Stein GS, Lian JB. The Runx2 osteogenic transcription factor regulates matrix metalloproteinase 9 in bone metastatic cancer cells and controls cell invasion. Mol Cell Biol. 2005;25:8581-8591. [PubMed] [DOI] |
| 6. | Chinni SR, Sivalogan S, Dong Z, Filho JC, Deng X, Bonfil RD, Cher ML. CXCL12/CXCR4 signaling activates Akt-1 and MMP-9 expression in prostate cancer cells: the role of bone microenvironment-associated CXCL12. Prostate. 2006;66:32-48. [PubMed] [DOI] |
| 7. | 郭 坤, 沙 焕臣, 马 清涌, 王 连才, 胡 恒通. 去甲肾上腺素对胰腺癌细胞株MiaPaCa-2侵袭能力的影响. 西安交通大学学报(医学版). 2010;31:265-268. |
| 8. | Binker MG, Binker-Cosen AA, Richards D, Oliver B, Cosen-Binker LI. EGF promotes invasion by PANC-1 cells through Rac1/ROS-dependent secretion and activation of MMP-2. Biochem Biophys Res Commun. 2009;379:445-450. [PubMed] [DOI] |
| 9. | Han F, Zhu HG. Caveolin-1 regulating the invasion and expression of matrix metalloproteinase (MMPs) in pancreatic carcinoma cells. J Surg Res. 2010;159:443-450. [PubMed] [DOI] |
| 10. | Bloomston M, Zervos EE, Rosemurgy AS 2nd. Matrix metalloproteinases and their role in pancreatic cancer: a review of preclinical studies and clinical trials. Ann Surg Oncol. 2002;9:668-674. [PubMed] [DOI] |
| 11. | Leung E, McArthur D, Morris A, Williams N. Cyclooxygenase-2 inhibition prevents migration of colorectal cancer cells to extracellular matrix by down-regulation of matrix metalloproteinase-2 expression. Dis Colon Rectum. 2008;51:342-347. [PubMed] [DOI] |
| 12. | Ishizaki T, Katsumata K, Tsuchida A, Wada T, Mori Y, Hisada M, Kawakita H, Aoki T. Etodolac, a selective cyclooxygenase-2 inhibitor, inhibits liver metastasis of colorectal cancer cells via the suppression of MMP-9 activity. Int J Mol Med. 2006;17:357-362. [PubMed] |
| 13. | Kurihara Y, Hatori M, Ando Y, Ito D, Toyoshima T, Tanaka M, Shintani S. Inhibition of cyclooxygenase-2 suppresses the invasiveness of oral squamous cell carcinoma cell lines via down-regulation of matrix metalloproteinase-2 production and activation. Clin Exp Metastasis. 2009;26:425-432. [PubMed] [DOI] |
| 14. | Suh Y, Afaq F, Johnson JJ, Mukhtar H. A plant flavonoid fisetin induces apoptosis in colon cancer cells by inhibition of COX2 and Wnt/EGFR/NF-kappaB-signaling pathways. Carcinogenesis. 2009;30:300-307. [PubMed] [DOI] |
| 15. | Zervos EE, Norman JG, Gower WR, Franz MG, Rosemurgy AS. Matrix metalloproteinase inhibition attenuates human pancreatic cancer growth in vitro and decreases mortality and tumorigenesis in vivo. J Surg Res. 1997;69:367-371. [PubMed] [DOI] |
| 16. | Rozanov DV, Savinov AY, Golubkov VS, Postnova TI, Remacle A, Tomlinson S, Strongin AY. Cellular membrane type-1 matrix metalloproteinase (MT1-MMP) cleaves C3b, an essential component of the complement system. J Biol Chem. 2004;279:46551-46557. [PubMed] [DOI] |
| 17. | Koshiba T, Hosotani R, Wada M, Fujimoto K, Lee JU, Doi R, Arii S, Imamura M. Detection of matrix metalloproteinase activity in human pancreatic cancer. Surg Today. 1997;27:302-304. [PubMed] [DOI] |
| 18. | Jones LE, Humphreys MJ, Campbell F, Neoptolemos JP, Boyd MT. Comprehensive analysis of matrix metalloproteinase and tissue inhibitor expression in pancreatic cancer: increased expression of matrix metalloproteinase-7 predicts poor survival. Clin Cancer Res. 2004;10:2832-2845. [PubMed] [DOI] |
| 19. | Bramhall SR, Neoptolemos JP, Stamp GW, Lemoine NR. Imbalance of expression of matrix metalloproteinases (MMPs) and tissue inhibitors of the matrix metalloproteinases (TIMPs) in human pancreatic carcinoma. J Pathol. 1997;182:347-355. [PubMed] [DOI] |
| 20. | 李 霞, 孙 玲玲, 李 宏, 付 伟伟, 邢 晓明, 李 玉军. 胰腺癌中CXCR-4和MMP-2的表达及其临床意义. 临床与实验病理学杂志. 2009;25:295-297. |
| 21. | Liu SC, Yang SF, Yeh KT, Yeh CM, Chiou HL, Lee CY, Chou MC, Hsieh YS. Relationships between the level of matrix metalloproteinase-2 and tumor size of breast cancer. Clin Chim Acta. 2006;371:92-96. [PubMed] [DOI] |
| 22. | Chandru H, Sharada AC, Manjunath S. [Expression of matrix metalloproteinase (MMP-2) and extracellular matrix metalloproteinases inducer (EMMPRIN) in benign and advanced breast cancer tissue samples]. Biomed Khim. 2007;53:461-467. [PubMed] |
| 23. | Wu ZS, Wu Q, Yang JH, Wang HQ, Ding XD, Yang F, Xu XC. Prognostic significance of MMP-9 and TIMP-1 serum and tissue expression in breast cancer. Int J Cancer. 2008;122:2050-2056. [PubMed] [DOI] |
| 24. | Frich L, Bjørnland K, Pettersen S, Clausen OP, Gladhaug IP. Increased activity of matrix metalloproteinase 2 and 9 after hepatic radiofrequency ablation. J Surg Res. 2006;135:297-304. [PubMed] [DOI] |
| 25. | Sillanpää S, Anttila M, Voutilainen K, Ropponen K, Turpeenniemi-Hujanen T, Puistola U, Tammi R, Tammi M, Sironen R, Saarikoski S. Prognostic significance of matrix metalloproteinase-9 (MMP-9) in epithelial ovarian cancer. Gynecol Oncol. 2007;104:296-303. [PubMed] [DOI] |
| 26. | Iniesta P, Morán A, De Juan C, Gómez A, Hernando F, García-Aranda C, Frías C, Díaz-López A, Rodríguez-Jiménez FJ, Balibrea JL. Biological and clinical significance of MMP-2, MMP-9, TIMP-1 and TIMP-2 in non-small cell lung cancer. Oncol Rep. 2007;17:217-223. [PubMed] |
| 27. | Giannopoulos G, Pavlakis K, Parasi A, Kavatzas N, Tiniakos D, Karakosta A, Tzanakis N, Peros G. The expression of matrix metalloproteinases-2 and -9 and their tissue inhibitor 2 in pancreatic ductal and ampullary carcinoma and their relation to angiogenesis and clinicopathological parameters. Anticancer Res. 2008;28:1875-1881. [PubMed] |
| 29. | Ho JW, Ngan Hon PL, Chim WO. Effects of oxymatrine from Ku Shen on cancer cells. Anticancer Agents Med Chem. 2009;9:823-826. [PubMed] |