修回日期: 2009-12-20
接受日期: 2009-12-29
在线出版日期: 2010-03-28
目的: 研究不同时程低强度束缚水浸应激对大鼠Cajal间质细胞(interstitial cells of Cajal, ICC)数量的影响, 探讨慢性应激导致胃动力改变与ICC的相关性.
方法: 雄性SPF级SD大鼠48只被随机分为6组, 即实验3 d、7 d、28 d组和对照3 d、7 d、28 d组, 每组8只. 实验组23℃水域箱内束缚水浸1 h/d, 对照组自由摄食饮水. 4 d、8 d、29 d晨序贯脱颈处死. 取膜胃小弯侧(ICC-1)、腺胃小弯侧(ICC-3)、腺胃大弯侧上1/3处(ICC-5)、腺胃幽门旁0.5 cm处(ICC-7)组织各一块放入固定液中, 制成石蜡切片; 抗c-kit免疫组织化学染色, 观察不同层次ICC计数.
结果: 正常大鼠胃内ICC主要分布在肌内(ICC-MY)和肌间(ICC-IM), 而黏膜下(ICC-SM)和深肌丛(ICC-DMP)较少. 实验3 d组的各层ICC数量与对照组相比无明显差异, 实验7 d和28 d组大鼠不同部位、不同层次及同一部位不同层次ICC数量明显异于同期对照组. 应激时间长短对不同部位不同层次及同一部位不同层次ICC总数有明显影响, 其大致规律是先正常后增加再减少, 即先升高后降低. 应激主要引起ICC-MY及ICC-IM数量发生变化, 而本来较少的ICC-SM和ICC-DMP受影响较轻.
结论: 长时间低强度的慢性束缚水浸应激可以使大鼠胃窦ICC数量发生变化.
引文著录: 张丹, 夏志伟, 韩亚京. 长期慢性束缚水浸应激对大鼠胃窦Cajal间质细胞数量的影响. 世界华人消化杂志 2010; 18(9): 920-925
Revised: December 20, 2009
Accepted: December 29, 2009
Published online: March 28, 2010
AIM: To investigate the impact of long-term chronic water immersion-restraint stress on the number of interstitial cells of Cajal (ICC) in the gastric antrum of rats and to explore the relationship between ICC and gastric motility changes caused by chronic stress.
METHODS: Forty-eight male Sprague-Dawley rats were randomly and equally divided into six groups: three experiment groups and three matched control groups. The three experimental groups underwent water immersion-restraint stress for one hour daily for 3, 7 and 14 d, respectively, while the three control groups were allowed free access to food and water. On days 4, 8 and 29, the rats in both groups were sacrificed. Gastric tissue samples were collected from areas at the lesser curvature of the membranous stomach and the lesser curvature of the glandular stomach as well as areas near the upper one third of the great curvature of the glandular stomach and the pylorus of the glandular stomach. Paraffin-embedded sections were then made. The number of ICC was counted after immunohistochemical staining for c-Kit.
RESULTS: Intermuscular (ICC-MY) and intramuscular ICC (ICC-IM) were predominant types of ICC in normal rats, whereas submucosal ICC (ICC-SM) and ICC in the deep muscular plexus (ICC-DMP) were minor ones. The number of ICC were statistically different between the experiment and control groups on days 7 and 28 after stress: the number of ICC increased on day 7 but decreased on day 28 in the experiment groups. After stress, significant changes were found in the number of ICC-MY and ICC-IM, but not in that of ICC-SM and ICC-DMP.
CONCLUSION: Long-term chronic water immersion-restraint stress alters the number of ICC in the gastric antrum of rats.
- Citation: Zhang D, Xia ZW, Han YJ. Long-term chronic water immersion-restraint stress alters the number of interstitial cells of Cajal in the gastric antrum of rats. Shijie Huaren Xiaohua Zazhi 2010; 18(9): 920-925
- URL: https://www.wjgnet.com/1009-3079/full/v18/i9/920.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i9.920
近年来, 随着现代生活方式的转变及旧医学模式向社会-心理-生物医学模式的转变, 应激对机体造成的心身损害越来越引起人们的重视. 一些腹胀、腹痛、腹泻、便秘等胃肠道症状而无相应器质性病变的功能性胃肠病(functional gastrointestinal diseases, FGIDs)已成为一种常见病多发病. 精神因素在本组疾病发生中起重要作用, 而胃肠动力障碍及其电活动异常又是FGIDs的主要病生理基础[1,2]. 在胃肠电活动及其动力功能的研究中, 越来越多的研究已证实Cajal间质细胞(interstitial cell of Cajal, ICC)在其中发挥了重要作用, 然而目前的研究大多集中在胃肠器质性病变与ICC关系和机制的研究上, 对于慢性应激及胃肠的功能性病变与ICC的变化未见研究[3-5]. 本研究旨在通过慢性应激动物模型来观察ICC在不同应激阶段内的数量变化, 以探讨ICC在慢性应激导致的胃功能改变中所起的作用.
SPF级成年同龄SD大鼠48只, ♂(实验动物许可证号SCXK京2006-0008), 体质量150 g左右, 购自北京大学医学部实验动物部. 本研究得到北京大学医学部动物保护委员会认可.
1.2.1 分组: 首先将大鼠置于昼夜节律光照条件下, 自由进食进水, 室温在18 ℃-22 ℃, 饲养1 wk以适应环境, 每日触摸1次, 每次5 min. 随后将48只大鼠随机分成实验3、7、28 d组和同期对照组, 共6组, 每组8只.
1.2.2 造模: 对照组不接受任何刺激, 自由摄食饮水; 实验组大鼠2 ℃水域箱内束缚水浸1 h/d, 分别于第4、8、29天晨将相应组别的大鼠于禁食12 h后序贯脱颈处死.
1.2.3 取材: 每组大鼠禁食12 h后予阿拉伯胶炭糊15 mL/kg灌胃, 30 min后脱颈处死, 开腹, 结扎胃贲门和幽门, 游离全胃, 用滤纸拭干后称全质量; 注入2%多聚甲醛5 mL内固定20 min; 沿胃大弯剪开胃体, 洗去胃内容物后拭干, 称净质量. 分别剪取ICC-1(膜胃小弯侧)、ICC-3(腺胃上部小弯侧)、ICC-5(腺胃上部大弯侧)、ICC-7(腺胃幽门前区0.5 cm前壁大弯侧)各1块全层组织约0.5 cm×0.5 cm×0.5 cm大小立即置于40 g/L多聚甲醛溶液中固定2 h, 常规洗涤、脱水、透明、浸蜡、石蜡包埋后, 切片待测.
1.2.4 ICC测定方法: 采用c-kit免疫组织化学法(选用美国Santa Cruz PV-6001二步法, C-Kit/CD117试剂盒, 购自北京中杉金桥公司). 石蜡切片脱蜡至水→抗原修复液(购自北京世济合力生物科技有限公司)修复抗原: 微波高火15 min, 自然冷却20 min, 冷水浴10 min→去离子水涮洗后PBS浸洗5 min→3% H2O2室温孵育10 min以阻断内源性过氧化物酶→PBS浸洗5 min 3次→3%牛血清白蛋白45 ℃温箱孵20 min→滤纸吸干→滴加1:400一抗温箱孵育2 h→PBS浸洗5 min 4次→滴加二抗(PV-6001山羊抗兔IgG抗体-HRP多聚体)温箱孵育30 min→PBS浸洗5 min 4次→DAB(3 mL去离子水加A、B、C各1滴)显色3-10 min, 光镜下观察见细胞质出现褐色片状或颗粒状物为c-Kit阳性→PBS涮洗, 去离子水涮洗→苏木素复染→分色→返蓝→脱水透明→树胶封片.
1.2.5 ICC数量观察: 按照ICC分布的4个层次观察: 黏膜下ICC(ICC-SM): 位于黏膜下及环状肌层表面; 肌间ICC(ICC-MY): 存在于环状和纵行肌之间; 肌内ICC(ICC-IM): 存在于环状肌和纵行肌束内; 深肌丛ICC(ICC-DMP): 处于环状肌层内. 在×400镜下, 每个部位每个层次随机选取10个视野, 计数ICC阳性胞体和突起的个数之和. 免疫组织化学法染色后ICC呈现棕黄色, 分布在肌间、肌内、黏膜下、深肌层, 为梭形、圆形、多角形和不规则形等, 高倍光镜下容易辨别[6-8].
统计学处理 采用SPSS13.0对数据进行统计学处理, 采用T-Test、一般线性模型、LSD-t检验分析, 以P = Sig(2-tail)<0.05为差异有统计学意义, P = Sig(2-taile)<0.01为差异有显著统计学意义.
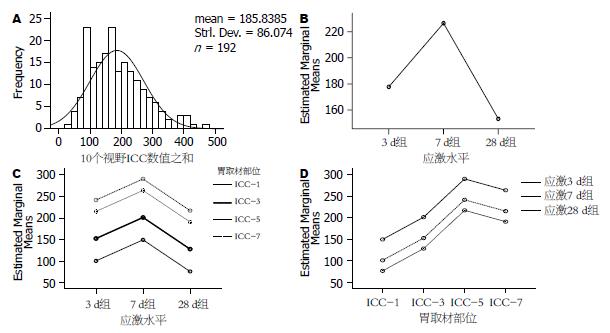
2.1.1 T-Test: 正态性检验结果符合正态分布(图1A). 由表1可知, 实验3 d组和对照3 d组比较, ICC-1、3、5、7四个部位的ICC数量无差异(P>0.05). 而实验7 d组和对照7 d组比较, ICC-1组差异有统计学意义(P<0.05), 而ICC-3、5、7组差异显著(P<0.01). 实验28 d组和对照28 d组比较四个部位的数值均有显著差异(P<0.01).
| 分组 | ICC-1 | ICC-3 | ICC-5 | ICC-7 | ||||
| 对照组 | 实验组 | 对照组 | 实验组 | 对照组 | 实验组 | 对照组 | 实验组 | |
| 3 d | 100.6±23.4 | 99.6±21.7 | 150.3±36.8 | 153.8±39.5 | 259.1±46.7 | 253.3±41.0 | 204.3±42.3 | 200.8±42.9 |
| 7 d | 111.0±19.4 | 157.3±45.2 | 161.0±28.3 | 229.5±82.8 | 251.3±42.7 | 305.7±79.5 | 212.4±27.1 | 384.5±53.1 |
| 28 d | 121.1±28.7 | 64.0±19.7 | 163.9±49.1 | 106.1±28.2 | 270.0±56.1 | 161.4±44.4 | 221.2±67.3 | 121.4±67.3 |
2.1.2 一般线性模型: 应激时间长短对不同部位ICC总的影响, 有显著意义(F = 25.081, P<0.01, 图1B); 同一大鼠各取材部位ICC总数的组间比较: 实验3 d组与实验7 d组、实验7 d组与实验28 d 组比较均差异显著(P<0.01), 实验3 d组与实验28 d组比较有统计学差异(P = 0.021<0.05, 图1C). 不同部位对ICC总值间的影响, 有明显统计学差异(F = 54.46, P<0.01); 各部位间比较均有统计学意义(P≤0.05或0.01, 图1D).
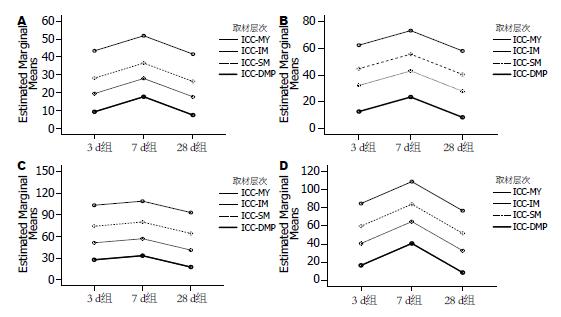
2.2.1 T-Test: 3 d时实验组各层次ICC数量与对照组无差别; 7 d时, 部位1、3、5的ICC-SM、ICC-DMP与对照组无差别, 上述部位的ICC-MY和ICC-IM数量、部位7的各层ICC数量与对照组差别明显. 应激28 d时, 部位1、3的ICC-SM、ICC-DMP和部位5的ICC-SM与对照组无差别, 上述部位其他层次及部位5、7的各层ICC数量均与对照组间存在差异(表2, 3).
| 分组 | ICC-1 | ICC-3 | ||||||
| ICC-MY | ICC-IM | ICC-SM | ICC-DMP | ICC-MY | ICC-IM | ICC-SM | ICC-DMP | |
| 实验3 d组 | 41.3±10.2 | 29.2±5.6 | 9.7±3.4 | 20.5±4.9 | 68.3±15.4 | 44.7±13.5 | 16.9±4.2 | 31.3±8.0 |
| 对照3 d组 | 40.1±10.2 | 28.0±6.2 | 12.1±3.9 | 21.8±4.5 | 63.8±16.1 | 42.5±9.1 | 14.6±3.4 | 31.9±11.7 |
| 实验7 d组 | 66.2±18.2 | 45.8±12.5 | 15.0±6.5 | 32.4±10.3 | 92.3±30.6 | 70.2±28.1 | 21.9±8.7 | 47.2±19.1 |
| 对照7 d组 | 48.7±5.7 | 30.2±10.2 | 9.3±5.4 | 26.1±8.0 | 62.5±13.6 | 47.1±12.1 | 13.9±5.2 | 38.8±8.3 |
| 实验28 d组 | 27.3±7.3 | 17.2±7.0 | 9.9±3.7 | 16.8±5.7 | 41.6±12.5 | 30.8±9.2 | 9.4±3.3 | 24.2±6.5 |
| 对照28 d组 | 50.3±16.2 | 31.6±12.8 | 16.4±4.1 | 24.1±2.8 | 63.7±22.6 | 48.2±17.5 | 15.6±5.4 | 35.3±8.9 |
| 分组 | ICC-5 | ICC-7 | ||||||
| ICC-MY | ICC-IM | ICC-SM | ICC-DMP | ICC-MY | ICC-IM | ICC-SM | ICC-DMP | |
| 实验3 d组 | 102.1±14.4 | 77.8±12.8 | 24.6±5.5 | 50.2±10.8 | 80.7±19.4 | 60.1±12.0 | 19.7±4.7 | 39.2±8.8 |
| 对照3 d组 | 107.7±19.9 | 76.5±14.4 | 23.9±4.5 | 53.4±10.3 | 87.8±20.4 | 58.7±14.3 | 16.9±8.4 | 42.4±6.6 |
| 实验7 d组 | 123.6±31.7 | 88.0±24.6 | 33.4±7.8 | 61.3±20.2 | 157.1±25.7 | 111.9±16.9 | 39.4±17.5 | 76.2±12.4 |
| 对照7 d组 | 91.7±21.4 | 72.3±7.2 | 28.2±7.2 | 50.7±10.5 | 83.8±18.0 | 63.4± 9.9 | 19.2±4.8 | 47.4±2.0 |
| 实验28 d组 | 65.9±17.3 | 46.2±10.7 | 19.5±6.6 | 32.1±12.7 | 45.8±15.6 | 34.3±19.9 | 11.7±3.3 | 28.6±9.5 |
| 对照28 d组 | 109.4±25.1 | 78.3±17.4 | 30.0±6.2 | 52.8±11.7 | 87.3±25.8 | 64.4±19.3 | 28.3±12.8 | 44.8±12.1 |
2.2.2 一般线形模型: 应激时间对部位1各层ICC数量有显著影响(F = 17.07, P<0.01), 部位1不同层次ICC数量有明显差异(P<0.01); 组间比较: 部位1的ICC-SM数量在不同应激时间组间比较无差别; ICC-DMP的3 d与28 d组间比较无差异(P = 0.329>0.05), 其余层次ICC数量各组间比较均有显著统计学差异, 见图2A.
应激时间对部位3各层ICC数量有显著影响(F = 16.05, P<0.01). 组间比较: 部位3的ICC-SM各组间比较无显著性差异; ICC-DMP的3 d与28 d组间比较无差异(P = 0.12>0.05), 其余层次ICC数量各组间比较均有显著统计学差异(图2B). 应激时间对部位5各层ICC数量有显著影响(F = 12.79, P<0.01). 组间比较: 部位5之ICC-DMP的3 d与7 d组间比较无差异(P>0.05), 其余各层次ICC数量各组间比较均有显著统计学差异(均P<0.01, 图2C). 应激时间对部位7各层ICC数量有显著影响(F = 37.2,P<0.01). 组间比较: 部位7之ICC-DMP的3 d与28 d组间比较无差异(P>0.05). 其余各层次ICC数量各组间比较有显著统计学差异(均P<0.01, 图2D).
研究表明, ICC是胃肠慢波的起搏细胞, 并推进电活动的传播; ICC对肠神经信号的传递具有调节作用[9,10]. ICC的缺失或处于病生理条件时可出现胃肠道平滑肌反射能力减弱的现象[11]. 因此在众多胃肠动力障碍性疾病中都有ICC的参与. 慢传输性便秘、Hirschsprung病、慢性假性肠梗阻, 甚至炎症性肠病等也有ICC数目减少, 以及ICC形态和超微结构的改变[12-15].
慢性束缚水浸应激(以下简称应激)可导致类似功能性胃肠病的胃肠功能改变, 在其病生理机制中除有肠神经系统(enteric nervous system, ENS)、胃肠激素、中枢神经系统(central nervous system, CNS)等参与外, 还有不可忽视的肌源性机制-即ICC的参与. 胃肠神经-ICC-平滑肌网络作为胃肠动力的基本单位, ICC在其中担当接受与传递兴奋和抑制性神经递质的角色, 即起搏和传递胃慢波的功能.
除3 d外, 应激7 d、28 d后不同部位、不同层次及同一部位不同层次ICC总数均值几乎均较对照组有明显改变; 应激时间长短对不同部位、不同层次及同一部位不同层次ICC总数有明显影响, 其大致规律是先正常后增加再减少, 即先不变再升高后降低; 应激主要引起ICC-MY及ICC-IM数量发生变化, 而本来较少的ICC-SM和ICC-DMP受影响较轻. 也就是说, 除3 d组外, 应激对大鼠胃内不同部位、不同层次及同一部位不同层次ICC总数是有明显影响的, 且随着应激时间的延长, 其规律是: 不变(3 d)-升高(7 d)-下降(28 d). 在此先升后降的过程中, 还伴随发生了ICC细胞分布上的变化, 所有对照组及应激3天组的ICC细胞分布均以胃体大弯部数量最多, ICC细胞数量多少顺序为: 腺胃大弯部>腺胃窦部>腺胃体小弯部>膜胃部; 而7天应激组却以胃窦部ICC数量最多, 依次顺序为: 腺胃窦部>腺胃体大弯部>腺胃体小弯部>膜胃部, 且各部位ICC数量均较3 d组相同部位增多, 并以具有起搏和传导功能的ICC-MY和ICC-IM增多为主; 应激28 d组ICC细胞的分布部位又恢复到以腺胃体大弯部数量最多, 且各部位ICC数量均较3 d组相同部位明显减少, 并以ICC-MY和ICC-IM减少为主. 而正常状态下, 腺胃体大弯上1/3处是胃的主要起搏区域, 该部位ICC的数量对胃动力起着至关重要的作用. 据此推测, 应激刺激后ICC的变化一方面主要体现在数量上, 而随着应激时间的延长, 实验组ICC胃内分布的优势区域与对照组比较发生明显的变化. 这种变化主要体现在ICC-MY、ICC-IM的数量上. 而幽门前区的ICC数量明显增加, 提示胃驱动蠕动发生的起搏部位可能发生变化, 因此可能导致胃运动功能紊乱[16,17]. 继续延长应激时间后, 各部位ICC的数量均明显减少, 而最突出的体现在ICC-MY和ICC-IM的数量上变化. 这种变化是否可逆, 有待于进一步研究.
以往的研究表明, 大鼠在接受应激刺激后可出现胃运动功能的障碍, 胃排空降低, 且随着应激时间的延长逐渐加重[18,19], 但其所采用的应激实验均为较高强度的应急刺激.
慢性应激和急性应激情况下, 胃功能的改变可能有不同. 本文作者此前的资料显示: 慢性应激可以导致大鼠胃排空变化, 早期排空加快, 后期减慢, 这可能与神经、内分泌、肌源性多种机制的调节剂补偿机制存在相关.
总之, 大鼠接受慢性应激刺激初期, ICC的数量变化并不明显, 分布亦无变化, 而随着应激时间延长, 大鼠ICC的数量和分布的优势区域发生变化. 这种数量和分布的变化可能参与应激刺激后胃运动功能异常的改变.
在胃肠电活动及其动力功能的研究中, 越来越多的研究已证实Cajal间质细胞(ICC)在其中发挥了重要作用, 然而目前的研究大多集中在胃肠器质性病变与ICC关系和机制的研究上, 对于慢性应激及胃肠的功能性病变与ICC的变化未见研究. 本研究旨在通过慢性应激动物模型来观察ICC在不同应激阶段内的数量变化, 以探讨ICC在慢性应激导致的胃功能改变中所起的作用.
魏睦新, 教授, 南京医科大学第一附属医院中医内科.
继续延长应激时间后, 各部位ICC的数量均明显减少, 而最突出的体现在ICC-MY和ICC-IM的数量上变化. 这种变化是否可逆, 有待于进一步研究.
研究表明, ICC是胃肠慢波的起搏细胞, 并推进电活动的传播; ICC对肠神经信号的传递具有调节作用.
本研究设计合理, 数据可信, 有助于了解胃运动调节机制, 有很好的学术价值.
编辑: 李军亮 电编:吴鹏朕
| 3. | 林 琳, 徐 丽明, 罗 云, 吴 高珏, 汤 玉蓉, 张 红杰, 李 学良. 糖尿病结肠动力障碍时Cajal间质细胞和干细胞因子的变化以及胰岛素的干预效应. 胃肠病学. 2008;13:200-204. |
| 4. | Bennett EJ, Piesse C, Palmer K, Badcock CA, Tennant CC, Kellow JE. Functional gastrointestinal disorders: psychological, social, and somatic features. Gut. 1998;42:414-420. [PubMed] |
| 7. | Ward SM, Sanders KM, Hirst GD. Role of interstitial cells of Cajal in neural control of gastrointestinal smooth muscles. Neurogastroenterol Motil. 2004;16 Suppl 1:112-117. [PubMed] [DOI] |
| 9. | Ward SM, Beckett EA, Wang X, Baker F, Khoyi M, Sanders KM. Interstitial cells of Cajal mediate cholinergic neurotransmission from enteric motor neurons. J Neurosci. 2000;20:1393-1403. [PubMed] |
| 11. | Ward SM, Brennan MF, Jackson VM, Sanders KM. Role of PI3-kinase in the development of interstitial cells and pacemaking in murine gastrointestinal smooth muscle. J Physiol. 1999;516:835-846. [PubMed] [DOI] |
| 12. | Lyford GL, He CL, Soffer E, Hull TL, Strong SA, Senagore AJ, Burgart LJ, Young-Fadok T, Szurszewski JH, Farrugia G. Pan-colonic decrease in interstitial cells of Cajal in patients with slow transit constipation. Gut. 2002;51:496-501. [PubMed] [DOI] |
| 13. | Horiguchi K, Keef KD, Ward SM. Distribution of interstitial cells of Cajal in tunica muscularis of the canine rectoanal region. Am J Physiol Gastrointest Liver Physiol. 2003;284:G756-G767. [PubMed] |
| 14. | Isozaki K, Hirota S, Miyagawa J, Taniguchi M, Shinomura Y, Matsuzawa Y. Deficiency of c-kit+ cells in patients with a myopathic form of chronic idiopathic intestinal pseudo-obstruction. Am J Gastroenterol. 1997;92:332-334. [PubMed] |
| 15. | Porcher C, Baldo M, Henry M, Orsoni P, Julé Y, Ward SM. Deficiency of interstitial cells of Cajal in the small intestine of patients with Crohn's disease. Am J Gastroenterol. 2002;97:118-125. [PubMed] [DOI] |
| 16. | 张 侃, 杨 杰, 余 晓云, 侯 晓华. 正向低频长脉冲对逆向刺激模拟胃异位起搏点诱发胃电过速的治疗作用. 胃肠病学和肝病学杂志. 2008;17:460-463. |