修回日期: 2010-01-09
接受日期: 2010-01-26
在线出版日期: 2010-03-28
结直肠癌与其他实体肿瘤一样是我国乃至世界范围的重要疾病负担, 其治疗也面临许多挑战. 近几年, 日益受到重视的癌症干细胞理论似乎可以解释结直肠癌的发生发展、复发转移的细胞学机制. 本文就结直肠癌干细胞的研究进展作一综述.
引文著录: 杨治力, 王志刚, 郑起. 结直肠癌干细胞研究进展. 世界华人消化杂志 2010; 18(9): 913-919
Revised: January 9, 2010
Accepted: January 26, 2010
Published online: March 28, 2010
Colorectal cancer is a worldwide enormous cancer burden and a major therapeutic challenge as other solid tumors. The cancer stem cell hypothesis provides a cellular mechanism to account for the development, progression, recurrence and metastasis of colorectal cancer. The aim of this paper is to review the advances in research on colorectal cancer stem cells.
- Citation: Yang ZL, Wang ZG, Zheng Q. Advances in research on colorectal cancer stem cells. Shijie Huaren Xiaohua Zazhi 2010; 18(9): 913-919
- URL: https://www.wjgnet.com/1009-3079/full/v18/i9/913.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i9.913
结直肠癌与其他实体肿瘤一样是我国乃至世界范围的重要疾病负担, 其治疗也面临许多挑战. 近几年, 日益受到重视的癌症干细胞(cancer stem cell, CSC)理论似乎可以解释结直肠癌的发生发展、复发转移的细胞学机制, 可能为改进结直肠癌的治疗策略提供理论依据, 从而改善结直肠癌患者的预后.
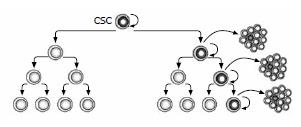
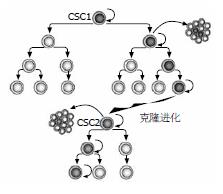
同一组织的恶性肿瘤存在不同的病理学分类, 且表达不同的生物标志. 随着基因芯片与蛋白组学技术的进展, 对同一组织的恶性肿瘤分类已达到分子水平. 这些肿瘤生物学现象可以理解为不同亚型的肿瘤起源于不同的细胞. 然而, 同一细胞来源的肿瘤经常显示出细胞在功能上的异质性(functional heterogeneity), 表现为不同的增殖与分化能力[1,2]. 目前, 能解释此现象的CSC模型(图1)越来越被大多数学者所接受. CSC是指具有自我更新及产生组成肿瘤不同细胞能力的肿瘤细胞亚群[3-5]. 这些细胞显示出干细胞样特性与持续维持致瘤的能力. Lapidot等对急性粒系白血病细胞的研究首次证实CSC的存在[6]: 大约占白血病细胞总数的0.01%-1%的细胞移植入免疫缺陷小鼠后能诱导形成白血病. 尤其值得关注的是在实体肿瘤中也被证实CSC的存在. Al-Hajj等从乳腺癌组织中分离出CD44+CD24-/low的细胞亚群, 并发现他们具有起始肿瘤的能力[7]. Singh等利用CD133作为分选标志分离并鉴定出脑肿瘤中的CSC[8]. 此后, 日益增加的证据显示几乎所有的实体肿瘤包括结肠、肝[9]、胰[10]、前列腺[11]、卵巢[12]、肺[13]、黑色素瘤[14]等都被特有的CSC亚群按等级组织与维持. 至今, 乳腺癌与脑恶性肿瘤的CSC研究更为深入. 已有证据显示CSC的生物学行为随整个肿瘤生长进展或经受临床干预过程而变化(图2), Barabe等[15]研究显示白血病干细胞具有随时间积累而出现进化潜能, 表现为从最初细胞类型到含有重分配的免疫球蛋白H基因, 这一研究提示CSC本身可能出现克隆进化(clonal evolution); Clark等[16]报道肿瘤细胞体内系列移植可产生更多的侵袭性肿瘤; Creighton等[17]对经历常规内分泌与化学治疗后残余乳腺癌的研究显示其中CD44+CD24-/low表型的CSCs出现更多间质标志基因表达. 这些研究报道均提示CSCs受其所处小境(niche)的影响可能出现生物学特性的变化.
首次报道结直肠癌干细胞存在的两个研究小组是O'Brien等[18]与Ricci-Vitiani等[19], 前者在17例原发与转移结肠癌组织中用FACS分析显示原发结肠癌组织中CD133+细胞占7.5%-15.9%, 转移结肠癌中CD133+细胞占3.2%-24.5%, 分选出CD133+与CD133-细胞后, 分别植入NOD/SCID小鼠肾囊内鉴定肿瘤起始细胞(colon cancer-initiating cell, CC-IC), 结果显示262个CD133+肿瘤细胞中有1个CC-IC; 后者的19例结肠癌组织中有16例含有CD133+细胞, 约占总细胞的0.7%-6.1%, 另3例未检出CD133+细胞, 通过体内外实验显示一小群未分化的CD133+细胞皮下植入NOD/SCID小鼠能产生与父代相似的结肠癌. 随后, Todaro等[20]报道在21例结肠癌组织中CD133表达为0.3%-3%, 裸鼠皮下移植结果显示2×106 CD133-细胞在15 wk的观察期间无肿瘤生长, 而2.5×103 CD133+细胞生成肿瘤体积在1.5 cm3左右; 进一步分析显示CD133+细胞能通过自分泌IL-4保护这些细胞免于凋亡以及抵抗常规治疗. 至此, CD133作为结直肠CSC的标志已被大多数学者所认可.
除了CD133作为结直肠CSC的标志外, CD44与结直肠CSC的研究也有报道. Dalerba等[21]对人类结肠CSCs的表型研究显示: (EpCAM)high/CD44+表型的结肠癌细胞为CSC, 同时对此表型的细胞表面标志谱分析发现CD166也能作为CSC的表型; 此外, 作者还发现CD44+细胞代表了CD133+细胞群中的小部分亚群细胞. 即与CD133+结肠癌细胞比较, CD44+结肠癌细胞中更有效地富集了CSCs. Du等[22]利用慢病毒RNA干扰技术敲出结直肠癌细胞中的CD44或CD133基因后显示: 仅CD44基因敲出能明显阻止癌细胞克隆形成以及抑制移植模型中细胞的致瘤性. 该研究提示CD44在结直肠CSC中具有很重要的功能意义.
为了验证再生一个异质性结直肠癌的能力是否存在于一个单克隆结直肠癌细胞群体或依靠多个不同的CSCs, 也即按目前研究所定义的单个结直肠CSC是否确实具有多向分化潜能. Vermeulen等[23]对原发与肝转移结直肠癌细胞行结肠球培养, 这些球能在免疫缺陷小鼠中成瘤, 从球分离成单个癌细胞培养结果显示20个细胞中大约有1个细胞能形成克隆, 同时在球培养中大约16个CD133+细胞中有1个细胞能形成球, 而CD133-细胞需250个中有1个细胞能形成球; 在与CD133共表达的标志如CD44、CD166、CD24、CD29中, 以CD133+CD24+细胞有更高的克隆形成能力(约20%); 通过对单细胞克隆的结肠CSCs的体内外研究显示CSCs具有多向分化潜能, PI3K信号通路参与了CSCs分化的决定. 该研究支持了拥有多向分化潜能的CSC导致了组成肿瘤的细胞层级的假说.
为了解决单用免疫方法检测CD133表达的不确定性, Shmelkov等[24]建立了在CD133基因的启动区域敲进报道基因lacZ的遗传小鼠模型, 结果发现CD133广泛表达在成年小鼠结肠上皮细胞; 用CD133抗体检测成年人正常结肠上皮显示其表达在绝大多数分化的上皮细胞; 在原发的人结肠癌标本中免疫染色也显示CD133广泛表达在所有恶性上皮细胞中; 随后的Il10-/-CD133lacZ的自发结肠癌小鼠模型中也得到一致的CD133表达的结果. 该研究结果引起了人们对CD133作为原发结直肠癌干细胞标志的质疑. 随后Horst等[25]与Kojima等[26]应用作用于不同表位的抗体对结直肠癌的CD133免疫染色结果也支持该研究, 即CD133并不局限表达在少数结直肠癌上皮细胞中.
醛脱氢酶1(aldehyde dehydrogenase 1, ALDH1)近来被认为是一个有前景的CSC标志. ALDH是氧化细胞内醛的一个解毒酶, 他的存在可能是干细胞长期存活的基础. 自从Jones等[27]首次描述了利用测量细胞内ALDH酶活性分离造血祖细胞之后, 已有研究报道在鼠脑中分离出ALDH+细胞具有自我更新与多向分化的潜能以及ALDH1是乳腺CSC的特异性标志[28,29]. Huang等[30]对7例结肠癌患者的研究显示: ALDH+ESA+细胞范围在3.5%±1.0%, 低于CD44+ESA+与CD133+ESA+细胞范围的5-7倍; 500个ALDH+ESA+细胞NOD/SCID小鼠移植在30 d内能形成肿瘤, 而10 000 ALDH- ESA+细胞在50 d内仍不能形成肿瘤; ALDH+CD133+ESA+细胞比ALDH+ESA+细胞的致瘤率高(89% vs 58%), ALDH+CD44+ESA+细胞与ALDH+ESA+细胞的致瘤率相同(70%). 该研究提示ALDH1是结肠CSC的一个标志, 结合CD133可以稍稍增加CSC的富集. 但Chu等[31]却报道了不一致的结果, 从4例原发结肠癌小鼠移植瘤中分离出CD44hi具有高的致瘤性, 结合ALDH标志分选的细胞其致瘤性较单独的CD44hi有明显增加, 而CD44hi与CD133结合却不增加其致瘤能力. 比较这两个研究, 可能与后者的研究采用了CD44表达强度高的细胞有关.
综合目前所有的结直肠CSC的研究, 尽管在分选标志上的差异, 甚至有矛盾的结果, 但仍可认为在结直肠癌中存在干细胞样的细胞亚群, 其特异性细胞表型还需深入研究.
CSCs是否直接起源于突变的干细胞或肿瘤形成过程中获得干细胞特性的成熟细胞目前还不清楚. Mani等[32]对永生化的人乳腺上皮细胞行上皮间质转换(epithelial-masenchymal transition, EMT)诱导后, 产生了有干细胞特性的细胞, 同时乳腺癌中分离的干样细胞也表达EMT的标志. 该研究提示癌细胞受EMT的临时诱导可能是CSC的来源. 另一方面, CSCs 的特性极其类似于正常的干细胞, 都具有自我更新与多潜力分化的能力以及表达共同的表面标志[33]. 在大多数实体组织中, 由于他们的干细胞及其子代细胞还无确切的细胞表面免疫表型, 因此更难确定CSCs类似的细胞类型或起源于某种细胞. 但就结直肠CSC的起源目前已有一些研究显示可能来源于干细胞的突变.
Zhu等[34]用Cre及LacZ报道基因敲入Prom1(即CD133)的基因位点(Prom1C-L)建立小鼠模型, 谱系跟踪研究显示Prom1+细胞位于小肠隐窝基底部, 并共表达另一个肠干细胞基因Lgr5[35], 产生完整的小肠上皮, 因此是小肠干细胞; 当该小鼠含有β-catenin突变时, 出现了隐窝结构破坏与隐窝基底部不相称地Prom1+细胞扩展, 谱系跟踪证实Prom1+细胞的子代细胞代替了整个小肠肿瘤黏膜, 其病理为局灶性高级别上皮内瘤变与隐窝腺瘤形成, 有7%的这些子代肿瘤细胞仍表达Prom1. 此研究提示Prom1标记的成体小肠干细胞易受肿瘤转化并维持部分突变的Prom1+肿瘤细胞.
Barker等[36]建立了敲入Lgr5并他莫昔芬诱导Cre重组酶表达在肠长期生存的干细胞或短生存期的传递-放大细胞的小鼠模型, 当诱导肠Lgr5+干细胞APC基因缺失的数天内就出现肿瘤性转化, 转化的干细胞位于肠隐窝的底部, 驱动微腺瘤无阻止性生长, 从而在3-5 wk后发展成肉眼所见的腺瘤; 而当APC基因缺失在隐窝的传递至放大细胞时, 诱导的微腺瘤被明显推迟, 甚至在30 wk之后大的腺瘤仍非常少. 该研究提示隐窝干细胞特异性APC缺失将导致进行性生长的肿瘤.
目前多数研究提示人类结肠隐窝的干细胞数大约占隐窝总细胞数的1%, 即每个隐窝不到20个干细胞, 他们位于隐窝基底部. Boman等[37]通过对结肠癌触发事件行计算机模拟建立数学模型, 提出了干细胞过剩(stem cell overpopulation)假说, 即仅仅隐窝干细胞数量增加可能解释导致结肠癌发生的早期组织学异常, 而不是非干细胞群体的凋亡、分化或增殖变化所致. 并认为隐窝干细胞过剩是在细胞层面上连接结肠分子水平的触发(如典型的APC突变)到组织水平的早期变化(隐窝增殖异常)的关键事件. 随后, 在家族性腺瘤性息肉病标本中利用免疫组织化学染色显示腺瘤发生过程中结肠隐窝MSH2、Bcl-2、survivin等标志的变化, 得到了支持隐窝基底细胞扩展的证据[38]; 另两个利用结肠细胞表观遗传标志甲基化的研究显示在家族性腺瘤性息肉病中伴随结肠癌发生的干细胞生存能力被增强[39,40]; 这些研究间接支持了在结肠癌发生发展中干细胞过剩假说. 最近, Huang等[30]的研究显示ALDH1+细胞在人结肠隐窝中是稀少的, 并局限在隐窝基底部干细胞占据的位置, 在从正常上皮到APC突变上皮, 再到腺瘤, ALDH1+细胞在数量上增加以及向隐窝上段分布, 且少量ALDH1+结肠癌细胞就能在免疫缺陷小鼠中致瘤, 提示在结肠瘤变与驱动结肠癌发展过程中出现了进行性的结肠干细胞过剩. Boman等[41]进一步研究认为结肠癌变过程中导致干细胞过剩的机制可能与控制能增殖的结肠隐窝细胞比例与其处于细胞周期S期的概率失调有关.
结合以上关于肠干细胞与结肠癌的关系研究, 可以推测结肠隐窝干细胞在获得或遗传APC基因突变的第一次打击后出现突变的干细胞数量过剩, 在随后所处的小境变化时受到了再次突变的第二次打击后形成了CSCs, 在组织学上出现细胞癌变.
在癌细胞中仅CSCs具有自我更新与多向分化的特性, 可以预测也只有CSCs才能在远隔部位形成转移性肿瘤. Hermann等[10]对胰腺癌细胞系的研究支持了这个概念, 同时证实CSCs中独特亚群CD133+CXCR4+表型细胞为转移性胰腺CSCs. 早在此研究之前, Brabletz等[42]以结直肠癌为模型, 阐述了原发肿瘤细胞发生EMT后具有转移能力, 癌细胞经过循环迁移到远隔部位后发生MET并形成与原发肿瘤组织构型一致的肿瘤, 借此推断恶性肿瘤进展过程中可能存在具有运动迁移特性的CSCs, 首次提出迁移性CSCs(migrating cancer stem cells)的概念. 细胞发生EMT已经被发现能获得干细胞特性, 可能是CSCs的起源; 而CSCs发生EMT 是否能产生转移性CSCs还有待实验证实.
在结肠癌肝转移病例中, Shmelkov等[24]利用FACS分析了19例标本, 其中有11例出现CD133+细胞(1.9%-30%), 且在有CD133+的转移性结肠癌中分离出的CD133+细胞与CD133-细胞都能在免疫缺陷小鼠形成肿瘤; 与CD133+细胞比较, CD133-细胞体内展示更快生长率与体外显示有更高的反映肿瘤侵袭性标志CEA的阳性率. 提示CD133可能也不是转移性结直肠CSCs的标志.
我们通过对来源于同一患者的原发肿瘤所建立的细胞系SW480及其转移淋巴结所建立的细胞系SW620用FACS分析显示: CD133在SW480细胞系中阴性表达, 在SW620细胞系中为阴性与阳性两群细胞; 从SW620细胞系中分选出CD133+与CD133-细胞, 侵袭性实验显示CD133-细胞强于CD133+细胞; 软琼脂克隆形成实验示CD133-细胞形成克隆能力高于CD133+细胞; 鉴于结肠癌细胞体外3D球培养可模拟肿瘤早期微转移[43,44], 我们通过悬吊培养CD133-细胞与CD133+细胞, 二者都能形成球, 分析显示CD133-细胞的球中出现了CD133+细胞, 而CD133+细胞的球中并无CD133-细胞产生. 我们的研究支持CD133不是转移性结直肠CSCs的标志, 并提示转移性结直肠癌细胞中出现的CD133+细胞可能来源于从原发肿瘤中迁移出去的CD133-细胞.
结直肠癌组织的侵袭前沿(invasive front)常出现一些分离的或成簇的癌细胞, 称之为肿瘤出芽(budding), 大数量的研究提示肿瘤出芽与结直肠癌细胞EMT有密切关系[45]. 推测正是这些肿瘤出芽细胞发生了EMT, 并执行远处转移的生物行为. Horst等[25]对结直肠癌组织免疫染色示肿瘤腺泡CD133表达, 在其侵袭前沿未分化的肿瘤"芽"CD133染色阴性. 我们的研究也获得了一致的结果, 对50例组织学上有肿瘤出芽的结直肠癌标本行CD133免疫染色, 结果显示大多数肿瘤腺体细胞表达CD133, 而所有出芽的肿瘤细胞为CD133阴性表达, 其相应的转移淋巴结或肝转移灶免疫染色显示存在CD133+与CD133-的两群细胞.
综合以上研究, 我们提出CD133与结直肠癌转移的假说, 即结直肠癌侵袭前沿CD133-细胞经循环迁移至远隔淋巴结或肝脏等器官; 在局部微环境影响下, 部分CD133-细胞上调CD133的表达, 表现为转移灶中含有CD133+与CD133-细胞. 在转移肿瘤CD133-细胞中寻找转移性结直肠CSCs可能是一个有效的途径.
CD133是最先作为结直肠CSCs的标志, 但也是质疑较多的分子. 目前常用的CD133抗体为AC133与AC141单克隆抗体(Miltenyi, 德国), 他们作用于CD133的糖基化表位. 这就意味着当用这两个抗体识别与分选CSCs时, CD133的糖基化状态可能成为CSC表型的间接标志, 而不是CD133蛋白本身表达[46]. 已有研究报道在结肠癌中CD133表位(AC133)具有细胞周期依赖性变化的特点[47]. 因此, 应用CD133多克隆抗体以及结合其mRNA水平才能反应细胞CD133的表达. 由于在我们的研究中CD133-的结直肠癌细胞能形成结肠球, Shmelkov等[24]的研究中CD133-结直肠癌细胞移植在免疫缺陷小鼠能致瘤, 暗示CD133本身并不执行肿瘤生长的功能, 这与Du等[22]以及Horst等[48]. 在结肠癌细胞中敲出CD133后未观察到CD133具有功能作用的报道一致. 但是理解这一问题还有待阐明CD133的分子细胞功能. 到目前为止, 结直肠CSCs还缺乏特异性好、稳定性高、实用性强的单个或一组分选标志.
鉴定肿瘤细胞是否为CSC的"金标准"为移植成瘤实验. 大多数情况下异种移植的效率显著低于同种移植, 部分原因在于生长因子、细胞因子与相应受体、配体的种属特异性. 正如Kelly等[49]研究提示异种移植可能对在异种环境能生存的细胞具有选择性. 而就是这样生存下来的细胞被我们公认为CSCs. 但是, 建立完全拥有人体微环境的小鼠模型却是一个巨大的挑战. 另一个影响异种移植效率的因素是现有的免疫缺陷小鼠体内残存的免疫效应细胞. 比如目前广泛用于CSCs研究的NOD/SCID小鼠仍维持有自然杀伤细胞的活性. 而Quintana等[50]应用缺乏自然杀伤细胞的更加严重的免疫缺陷NOD/SCID-IL2Rγnull小鼠进行人黑色素瘤细胞致瘤实验, 结果显示能致瘤的细胞频率显著增加. 此外, 异种移植的部位也影响致瘤细胞的频率. O'Brien等[18]在结直肠CSC的鉴定过程中发现在肾囊内移植100-200个细胞就能出现显著差异, 而Ricci-Vitiani等[19]在皮下移植却需至少3 000个细胞才能显示出差异. 这可能与肾囊内丰富的血管环境有关系. 目前还没有结直肠CSC原位移植实验的报道.
随着CSC研究领域的快速发展, 以及基因组学等高通量的筛选技术的进步, 必将有助于识别结直肠CSC新的标志; 结合对结直肠癌干细胞起源机制的进一步研究, 将使靶向结直肠CSCs的治疗成为可能, 真正达到能治愈结直肠癌的目标.
近几年, 日益受到重视的癌症干细胞(CSC)理论似乎可以解释结直肠癌的发生发展、复发转移的细胞学机制, 可能为改进结直肠癌的治疗策略提供理论依据, 从而改善结直肠癌患者的预后.
王晓艳, 副教授, 湖南长沙中南大学湘雅三医院消化内科; 朴云峰, 教授, 吉林大学第一临床医院消化科.
目前所有的结直肠CSC的研究, 尽管在分选标志上的差异, 甚至有矛盾的结果, 但仍可认为在结直肠癌中存在干细胞样的细胞亚群, 其特异性细胞表型还需深入研究.
Mani等对永生化的人乳腺上皮细胞行上皮间质转换(EMT)诱导后, 产生了有干细胞特性的细胞, 同时乳腺癌中分离的干样细胞也表达EMT的标志.
随着CSC研究领域的快速发展, 以及基因组学等高通量的筛选技术的进步, 必将有助于识别结直肠CSC新的标志.
本文立题新颖, 证据充分, 可读性较好.
编辑: 李军亮 电编:吴鹏朕
| 1. | Southam CM, Brunschwig A, Levin AG, Dizon QS. Effect of leukocytes on transplantability of human cancer. Cancer. 1966;19:1743-1753. [PubMed] [DOI] |
| 2. | Heppner GH, Miller BE. Tumor heterogeneity: biological implications and therapeutic consequences. Cancer Metastasis Rev. 1983;2:5-23. [PubMed] [DOI] |
| 3. | Bonnet D, Dick JE. Human acute myeloid leukemia is organized as a hierarchy that originates from a primitive hematopoietic cell. Nat Med. 1997;3:730-737. [PubMed] [DOI] |
| 4. | Reya T, Morrison SJ, Clarke MF, Weissman IL. Stem cells, cancer, and cancer stem cells. Nature. 2001;414:105-111. [PubMed] [DOI] |
| 5. | Clarke MF, Dick JE, Dirks PB, Eaves CJ, Jamieson CH, Jones DL, Visvader J, Weissman IL, Wahl GM. Cancer stem cells--perspectives on current status and future directions: AACR Workshop on cancer stem cells. Cancer Res. 2006;66:9339-9344. [PubMed] |
| 6. | Lapidot T, Sirard C, Vormoor J, Murdoch B, Hoang T, Caceres-Cortes J, Minden M, Paterson B, Caligiuri MA, Dick JE. A cell initiating human acute myeloid leukaemia after transplantation into SCID mice. Nature. 1994;367:645-648. [PubMed] [DOI] |
| 7. | Al-Hajj M, Wicha MS, Benito-Hernandez A, Morrison SJ, Clarke MF. Prospective identification of tumorigenic breast cancer cells. Proc Natl Acad Sci U S A. 2003;100:3983-3988. [PubMed] [DOI] |
| 8. | Singh SK, Hawkins C, Clarke ID, Squire JA, Bayani J, Hide T, Henkelman RM, Cusimano MD, Dirks PB. Identification of human brain tumour initiating cells. Nature. 2004;432:396-401. [PubMed] [DOI] |
| 9. | Ma S, Chan KW, Hu L, Lee TK, Wo JY, Ng IO, Zheng BJ, Guan XY. Identification and characterization of tumorigenic liver cancer stem/progenitor cells. Gastroenterology. 2007;132:2542-2556. [PubMed] [DOI] |
| 10. | Hermann PC, Huber SL, Herrler T, Aicher A, Ellwart JW, Guba M, Bruns CJ, Heeschen C. Distinct populations of cancer stem cells determine tumor growth and metastatic activity in human pancreatic cancer. Cell Stem Cell. 2007;1:313-323. [PubMed] [DOI] |
| 11. | Collins AT, Berry PA, Hyde C, Stower MJ, Maitland NJ. Prospective identification of tumorigenic prostate cancer stem cells. Cancer Res. 2005;65:10946-10951. [PubMed] [DOI] |
| 12. | Curley MD, Therrien VA, Cummings CL, Sergent PA, Koulouris CR, Friel AM, Roberts DJ, Seiden MV, Scadden DT, Rueda BR. CD133 expression defines a tumor initiating cell population in primary human ovarian cancer. Stem Cells. 2009;27:2875-2883. [PubMed] |
| 13. | Eramo A, Lotti F, Sette G, Pilozzi E, Biffoni M, Di Virgilio A, Conticello C, Ruco L, Peschle C, De Maria R. Identification and expansion of the tumorigenic lung cancer stem cell population. Cell Death Differ. 2008;15:504-514. [PubMed] [DOI] |
| 14. | Monzani E, Facchetti F, Galmozzi E, Corsini E, Benetti A, Cavazzin C, Gritti A, Piccinini A, Porro D, Santinami M. Melanoma contains CD133 and ABCG2 positive cells with enhanced tumourigenic potential. Eur J Cancer. 2007;43:935-946. [PubMed] [DOI] |
| 15. | Barabé F, Kennedy JA, Hope KJ, Dick JE. Modeling the initiation and progression of human acute leukemia in mice. Science. 2007;316:600-604. [PubMed] [DOI] |
| 16. | Clark EA, Golub TR, Lander ES, Hynes RO. Genomic analysis of metastasis reveals an essential role for RhoC. Nature. 2000;406:532-535. [PubMed] [DOI] |
| 17. | Creighton CJ, Li X, Landis M, Dixon JM, Neumeister VM, Sjolund A, Rimm DL, Wong H, Rodriguez A, Herschkowitz JI. Residual breast cancers after conventional therapy display mesenchymal as well as tumor-initiating features. Proc Natl Acad Sci U S A. 2009;106:13820-13825. [PubMed] [DOI] |
| 18. | O'Brien CA, Pollett A, Gallinger S, Dick JE. A human colon cancer cell capable of initiating tumour growth in immunodeficient mice. Nature. 2007;445:106-110. [PubMed] [DOI] |
| 19. | Ricci-Vitiani L, Lombardi DG, Pilozzi E, Biffoni M, Todaro M, Peschle C, De Maria R. Identification and expansion of human colon-cancer-initiating cells. Nature. 2007;445:111-115. [PubMed] [DOI] |
| 20. | Todaro M, Alea MP, Di Stefano AB, Cammareri P, Vermeulen L, Iovino F, Tripodo C, Russo A, Gulotta G, Medema JP. Colon cancer stem cells dictate tumor growth and resist cell death by production of interleukin-4. Cell Stem Cell. 2007;1:389-402. [PubMed] [DOI] |
| 21. | Dalerba P, Dylla SJ, Park IK, Liu R, Wang X, Cho RW, Hoey T, Gurney A, Huang EH, Simeone DM. Phenotypic characterization of human colorectal cancer stem cells. Proc Natl Acad Sci U S A. 2007;104:10158-10163. [PubMed] [DOI] |
| 22. | Du L, Wang H, He L, Zhang J, Ni B, Wang X, Jin H, Cahuzac N, Mehrpour M, Lu Y. CD44 is of functional importance for colorectal cancer stem cells. Clin Cancer Res. 2008;14:6751-6760. [PubMed] [DOI] |
| 23. | Vermeulen L, Todaro M, de Sousa Mello F, Sprick MR, Kemper K, Perez Alea M, Richel DJ, Stassi G, Medema JP. Single-cell cloning of colon cancer stem cells reveals a multi-lineage differentiation capacity. Proc Natl Acad Sci U S A. 2008;105:13427-13432. [PubMed] [DOI] |
| 24. | Shmelkov SV, Butler JM, Hooper AT, Hormigo A, Kushner J, Milde T, St Clair R, Baljevic M, White I, Jin DK. CD133 expression is not restricted to stem cells, and both CD133+ and CD133- metastatic colon cancer cells initiate tumors. J Clin Invest. 2008;118:2111-2120. [PubMed] |
| 25. | Horst D, Kriegl L, Engel J, Kirchner T, Jung A. CD133 expression is an independent prognostic marker for low survival in colorectal cancer. Br J Cancer. 2008;99:1285-1289. [PubMed] [DOI] |
| 26. | Kojima M, Ishii G, Atsumi N, Fujii S, Saito N, Ochiai A. Immunohistochemical detection of CD133 expression in colorectal cancer: a clinicopathological study. Cancer Sci. 2008;99:1578-1583. [PubMed] [DOI] |
| 27. | Jones RJ, Barber JP, Vala MS, Collector MI, Kaufmann SH, Ludeman SM, Colvin OM, Hilton J. Assessment of aldehyde dehydrogenase in viable cells. Blood. 1995;85:2742-2746. [PubMed] |
| 28. | Corti S, Locatelli F, Papadimitriou D, Donadoni C, Salani S, Del Bo R, Strazzer S, Bresolin N, Comi GP. Identification of a primitive brain-derived neural stem cell population based on aldehyde dehydrogenase activity. Stem Cells. 2006;24:975-985. [PubMed] [DOI] |
| 29. | Ginestier C, Hur MH, Charafe-Jauffret E, Monville F, Dutcher J, Brown M, Jacquemier J, Viens P, Kleer CG, Liu S. ALDH1 is a marker of normal and malignant human mammary stem cells and a predictor of poor clinical outcome. Cell Stem Cell. 2007;1:555-567. [PubMed] [DOI] |
| 30. | Huang EH, Hynes MJ, Zhang T, Ginestier C, Dontu G, Appelman H, Fields JZ, Wicha MS, Boman BM. Aldehyde dehydrogenase 1 is a marker for normal and malignant human colonic stem cells (SC) and tracks SC overpopulation during colon tumorigenesis. Cancer Res. 2009;69:3382-3389. [PubMed] [DOI] |
| 31. | Chu P, Clanton DJ, Snipas TS, Lee J, Mitchell E, Nguyen ML, Hare E, Peach RJ. Characterization of a subpopulation of colon cancer cells with stem cell-like properties. Int J Cancer. 2009;124:1312-1321. [PubMed] [DOI] |
| 32. | Mani SA, Guo W, Liao MJ, Eaton EN, Ayyanan A, Zhou AY, Brooks M, Reinhard F, Zhang CC, Shipitsin M. The epithelial-mesenchymal transition generates cells with properties of stem cells. Cell. 2008;133:704-715. [PubMed] [DOI] |
| 33. | Clarke MF, Fuller M. Stem cells and cancer: two faces of eve. Cell. 2006;124:1111-1115. [PubMed] [DOI] |
| 34. | Zhu L, Gibson P, Currle DS, Tong Y, Richardson RJ, Bayazitov IT, Poppleton H, Zakharenko S, Ellison DW, Gilbertson RJ. Prominin 1 marks intestinal stem cells that are susceptible to neoplastic transformation. Nature. 2009;457:603-607. [PubMed] [DOI] |
| 35. | Barker N, van Es JH, Kuipers J, Kujala P, van den Born M, Cozijnsen M, Haegebarth A, Korving J, Begthel H, Peters PJ. Identification of stem cells in small intestine and colon by marker gene Lgr5. Nature. 2007;449:1003-1007. [PubMed] [DOI] |
| 36. | Barker N, Ridgway RA, van Es JH, van de Wetering M, Begthel H, van den Born M, Danenberg E, Clarke AR, Sansom OJ, Clevers H. Crypt stem cells as the cells-of-origin of intestinal cancer. Nature. 2009;457:608-611. [PubMed] [DOI] |
| 37. | Boman BM, Fields JZ, Bonham-Carter O, Runquist OA. Computer modeling implicates stem cell overproduction in colon cancer initiation. Cancer Res. 2001;61:8408-8411. [PubMed] |
| 38. | Boman BM, Walters R, Fields JZ, Kovatich AJ, Zhang T, Isenberg GA, Goldstein SD, Palazzo JP. Colonic crypt changes during adenoma development in familial adenomatous polyposis: immunohistochemical evidence for expansion of the crypt base cell population. Am J Pathol. 2004;165:1489-1498. [PubMed] |
| 39. | Yatabe Y, Tavaré S, Shibata D. Investigating stem cells in human colon by using methylation patterns. Proc Natl Acad Sci U S A. 2001;98:10839-10844. [PubMed] [DOI] |
| 40. | Kim KM, Shibata D. Methylation reveals a niche: stem cell succession in human colon crypts. Oncogene. 2002;21:5441-5449. [PubMed] [DOI] |
| 41. | Boman BM, Fields JZ, Cavanaugh KL, Guetter A, Runquist OA. How dysregulated colonic crypt dynamics cause stem cell overpopulation and initiate colon cancer. Cancer Res. 2008;68:3304-3313. [PubMed] [DOI] |
| 42. | Brabletz T, Jung A, Spaderna S, Hlubek F, Kirchner T. Opinion: migrating cancer stem cells - an integrated concept of malignant tumour progression. Nat Rev Cancer. 2005;5:744-749. [PubMed] [DOI] |
| 43. | Valcárcel M, Arteta B, Jaureguibeitia A, Lopategi A, Martínez I, Mendoza L, Muruzabal FJ, Salado C, Vidal-Vanaclocha F. Three-dimensional growth as multicellular spheroid activates the proangiogenic phenotype of colorectal carcinoma cells via LFA-1-dependent VEGF: implications on hepatic micrometastasis. J Transl Med. 2008;6:57. [PubMed] [DOI] |
| 44. | Weiswald LB, Richon S, Validire P, Briffod M, Lai-Kuen R, Cordelières FP, Bertrand F, Dargere D, Massonnet G, Marangoni E. Newly characterised ex vivo colospheres as a three-dimensional colon cancer cell model of tumour aggressiveness. Br J Cancer. 2009;101:473-482. [PubMed] [DOI] |
| 45. | Prall F. Tumour budding in colorectal carcinoma. Histopathology. 2007;50:151-162. [PubMed] [DOI] |
| 46. | Bidlingmaier S, Zhu X, Liu B. The utility and limitations of glycosylated human CD133 epitopes in defining cancer stem cells. J Mol Med. 2008;86:1025-1032. [PubMed] [DOI] |
| 47. | Jaksch M, Múnera J, Bajpai R, Terskikh A, Oshima RG. Cell cycle-dependent variation of a CD133 epitope in human embryonic stem cell, colon cancer, and melanoma cell lines. Cancer Res. 2008;68:7882-7886. [PubMed] [DOI] |
| 48. | Horst D, Scheel SK, Liebmann S, Neumann J, Maatz S, Kirchner T, Jung A. The cancer stem cell marker CD133 has high prognostic impact but unknown functional relevance for the metastasis of human colon cancer. J Pathol. 2009;219:427-434. [PubMed] [DOI] |